利用光镜-电镜关联方法研究发热伴血小板减少综合征病毒核蛋白的亚细胞定位
牛国宇 张尊 夏百成 刘淑慧 高旭 芜为 邹小辉 鲁茁壮 洪涛
261053 潍坊医学院公共卫生与管理学院(牛国宇、夏百成、刘淑慧、高旭);100052 北京,中国疾病预防控制中心病毒病预防控制所(张尊、芜为、邹小辉、鲁茁壮、洪涛);475000 开封,河南化工技师学院(张尊)
发热伴血小板减少综合征(severe fever with thrombocytopenia syndrome, SFTS)是一种新发出血性传染病,该病以发热、血小板减少为主要特征,大多数患者有恶心、呕吐及食欲不振等消化道症状,少数重症患者可因多脏器损害而死亡,病死率在10%至30%之间[1]。SFTS的病原体为发热伴血小板减少综合征病毒(SFTSV),隶属布尼亚病毒目phenuiviridae病毒科,是白蛉病毒属中的一个新的种,基因组由大(L)、中(M)、小(S)3个节段组成。L节段编码RNA依赖的RNA聚合酶(RdRP),M节段编码膜糖蛋白(G),S节段编码核蛋白(NP)和非结构蛋白(NSs)。核蛋白NP在病毒的转录、复制等方面发挥重要作用[2]。目前研究病毒蛋白在亚细胞水平(胞核、胞质及胞膜)的分布主要借助荧光标记技术[3],但荧光显微镜分辨能力有限,如要进一步定位到细胞器,需借助免疫电镜,而免疫电镜不仅操作繁琐,且具有一些无法回避的缺陷,比如固定剂会破坏蛋白;制备蛋白抗体困难;胶体金颗粒只能标记蛋白大概位置等[4]。因此,观察病毒蛋白在细胞超微结构的分布需利用新的电镜标记技术。
MiniSOG(mini Singlet Oxygen Generator)是近年来兴起的一种蛋白标记技术[5]。miniSOG仅含有106个氨基酸,分子量不到GFP大小的一半,在荧光显微镜下可以像GFP一样发射绿色荧光;在蓝光的激发下并有氧气存在时,产生的单线态氧能够催化二氨基联苯胺(DAB)聚合形成嗜锇颗粒,用四氧化锇固定电镜标本时,DAB聚合物吸附锇颗粒,在透射电镜下深染色而被电镜解析。本研究利用我们前期构建的基于miniSOG的光镜-电镜关联方法[6],在超微结构水平观察不同时相下SFTSV核蛋白NP在宿主细胞中的表达、定位情况,分析其与重要细胞器高尔基体和内质网的关系,并描述亚细胞结构的改变,进一步分析核蛋白NP形成包涵体的特点,为研究核蛋白NP在SFTSV复制、转录中的作用提供参考。
1 材料与方法
1.1材料293细胞为本室保存,pcDNA3-miniSOG为克隆有miniSOG基因的pcDNA3质粒以及携带miniSOG编码区的pTPL-IXSOG质粒均为本室前期构建[6]。pcDNA3-TPL质粒为CMV启动子下游含41型腺病毒三连体前导序列TPL的pcDNA3质粒(TPL有利于提高目的基因表达)。转染试剂Lipofectamine 3 000购自美国Life technologies公司。Q5高保真DNA聚合酶为美国NEB公司产品。限制性内切酶KpnI,XbaI,NcoI为日本TaKaRa公司产品。戊二醛、二甲胂酸钠、醋酸双氧铀、四氧化锇、环氧树脂Epon-812为美国SPI公司产品。PCR引物由北京六合华大基因有限公司合成。NP蛋白及NP蛋白兔抗血清由中国疾病预防控制中心病毒病预防控制所出血热室惠赠;HRP标记的山羊抗兔IgG购自北京中杉金桥生物技术有限公司。
1.2携带NP-miniSOG融合蛋白基因(NPSOG)的pTPL-NPSOG质粒构建及鉴定使用Q5高保真DNA聚合酶,以SFTSV-S片段为模板,以1709NPF1:5′-GCGCGGTACCATGTCGGAGTGGTCCAGGA -3′和1709NPR1:5′-CATCGTCATCCTTATAATCGGCAGACAGGTTTCTGTAAGCAGCAGCAGCA-3′为引物扩增NP基因;以pTPL-IXSOG为模板,以1709NPF2:5′-TGCTGCTGCTGCTTACAGAAACCTGTCTGCCGATTATAAGGATGACGATG-3′与1709NPR2:5′-GGCCTCTAGACTAGCCATCCAGCTGCACACCAAT-3′为引物扩增miniSOG基因。PCR产物经琼脂糖凝胶电泳后回收后作为扩增模板,以1709NPF1和1709NPR2为引物,经重叠延伸PCR(overlap extension PCR)方法扩增NP与miniSOG的融合基因(NPSOG)。PCR产物经琼脂糖凝胶电泳回收后,经KpnI与XbaI双酶切并与经同样双酶切的pTPL-IXSOG载体连接。连接产物转化TOP10感受态细胞,得到pTPL-NPSOG质粒。质粒经NcoI酶切鉴定后,选取鉴定正确的质粒用于测序验证。
1.3细胞转染及NPSOG蛋白检测使用Lipofectamine 3 000脂质体转染试剂,参照说明书进行操作,将1 μg pTPL-NPSOG转染至12孔板293细胞,于转染后24 h、36 h、48 h分别在荧光显微镜下观察NPSOG蛋白表达情况。质粒转染293细胞48 h后,收集细胞样品进行 SDS-PAGE电泳,将蛋白转到硝酸纤维素膜上后,5%脱脂奶封闭1 h,加入NP蛋白的兔抗血清(1∶2 500)室温孵育1 h;PBS洗膜3次(10 min/次);加入 HRP标记的山羊抗兔IgG(1∶2000),室温孵育1 h;PBS洗膜3次(10 min/次),检测。
1.4光氧化实验及电镜样品制备与观察质粒转染细胞后,于不同时间点(24 h、36 h、48 h),利用荧光指示定位NPSOG表达细胞,选取不同时相的NPSOG荧光阳性细胞,参照我们前期建立的方法进行光氧化反应及制备电镜样品[6]。样品制备后使用 Tecnai 12透射电镜观察。
2 结果
2.1pTPL-NPSOG质粒的构建与鉴定经PCR扩增分别得到长度为770 bp的NP基因及392 bp的miniSOG基因,电泳回收后,二者共同作为模板,重叠延伸PCR扩增获得长度为1 112 bp的NPSOG,该片段中miniSOG基因融合在NP基因3′端,二者融合表达。经酶切连接操作,NPSOG片段克隆至pcDNA3-TPL载体,得到pTPL-NPSOG质粒,经NcoI酶切鉴定,电泳结果表明质粒构建正确,质粒经北京六合华大基因有限公司测序验证序列无误后,用于后续实验。
2.2Westernblot检测NPSOG蛋白的表达收获转染pTPL-NPSOG质粒48 h后的293细胞,Western blot结果显示(图1),转染pTPL-NPSOG质粒的细胞样品在40 ×103处呈现单一的目的条带(泳道2),而未添加miniSOG标签的NP蛋白在25 ×103处呈现单一的目的条带(泳道1),两者大小均与预期结果相符,表明miniSOG标签蛋白与NP蛋白成功连接,NPSOG蛋白在293细胞中正确表达。

1:NP蛋白;2:NPSOC蛋白图1 NPSOG蛋白表达的检测1: protein of NP; 2: protein of NPSOGFig.1 Determination of NPSOG by western blot
2.3光镜-电镜关联方法观察NPSOG蛋白的表达情况pTPL-NPSOG质粒转染细胞后48 h(图1A),荧光显微镜下定位表达NPSOG蛋白的荧光细胞(图2B),细胞固定后进行DAB光氧化反应,可见表达NPSOG的细胞(荧光细胞)结构颜色变黄,而不发射绿色荧光的结构(不表达NPSOG蛋白)并未见到明显的颜色变化(图2C)。光氧化后再经OsO4后固定,可见表达NPSOG蛋白的荧光细胞颜色变成深褐色(图2D)。制备成超薄切片后,使用电镜观察,可见表达NPSOG蛋白的细胞结构呈深色,而光镜下无荧光的细胞结构颜色较浅,颜色深浅区别明显,容易辨别(图2F)。提高放大倍数后,可见表达NPSOG蛋白的细胞内有多处深色成簇聚集现象(图2E),说明NPSOG蛋白能够形成片状或块状聚集,而邻近质粒未转染细胞中由于没有NPSOG蛋白的表达,因此没有见到该现象。

293细胞转染pTPL-NPSOG质粒后48 h(A),在荧光显微镜下观察呈现绿色荧光(B);经2.5%戊二醛固定,DAB光氧化(C),1%四氧化锇固定(D)并制备成超薄切片后于电镜下观察(F)。E:图F中方框内区域放大后的图像。Cy:细胞浆,N:细胞核,IB:包涵体图2 光镜-电镜关联方法观察NP与miniSOG融合蛋白(NPSOG)在细胞内的定位Cy: Cytoplasm, N: Nucleus, IB: Inclusion bodies. The 293 cells were transfected with plasmid of pTPL-NPSOG, and observed under light microscope using bright field (A) or fluorescence (B) at 48 h post-transfection. Cells were fixed in 2.5% glutaraldehyde in situ, stained with DAB through photooxidation (C), post-fixed in 1% osmium tetroxide (D), and used to prepare ultrathin sections which were observed under transmission electron microscope(F), E:Enlargement of the region boxed in (F)Fig.2 Intracellular location of NPSOG protein with correlative light microscopy (LM) and electron microscopy (EM)
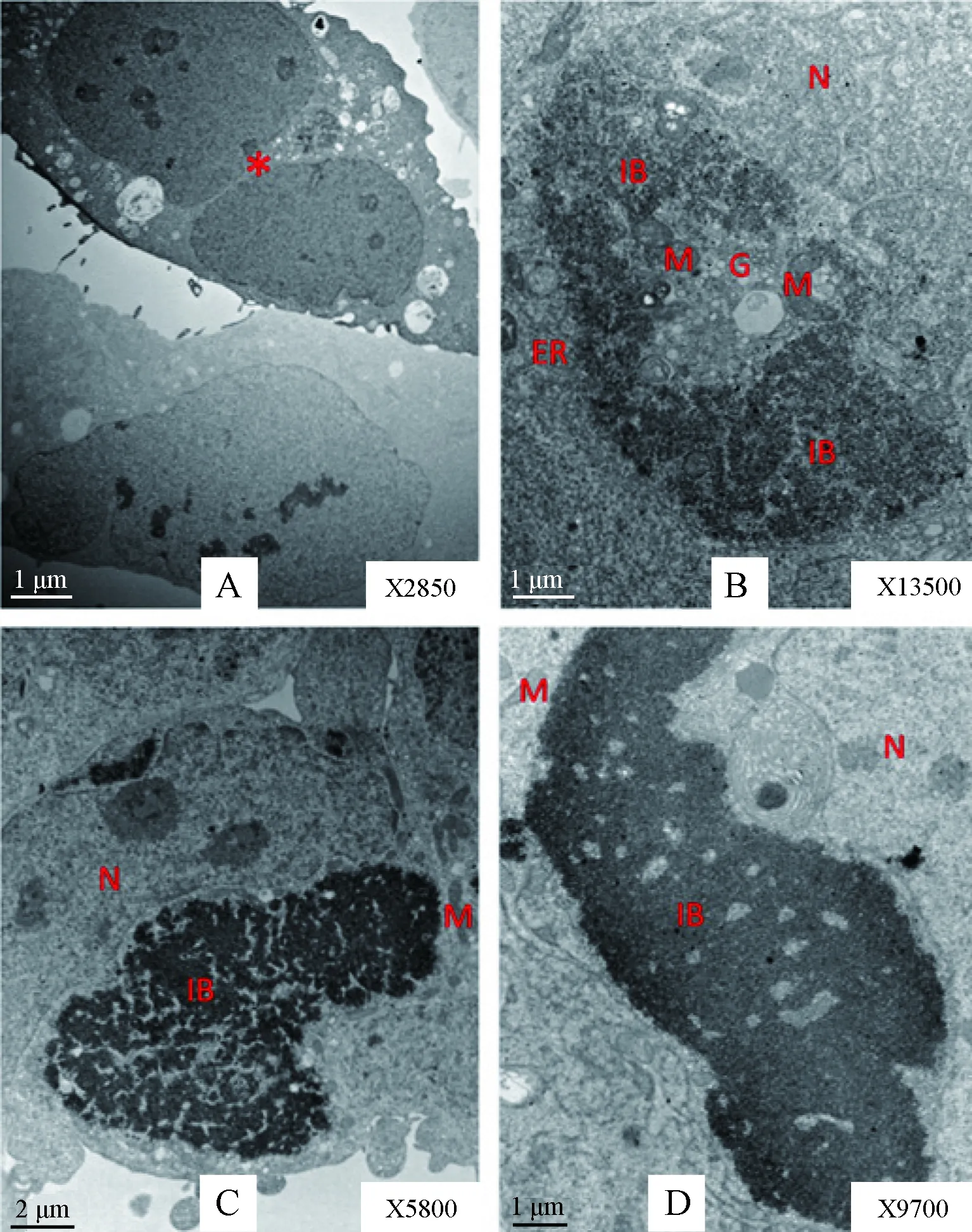
293细胞转染pTPL-NPSOG质粒后48 h(A),在荧光显微镜下观察呈现绿色荧光(B);经细胞经2.5%戊二醛固定,DAB光氧化及1%四氧化锇后固定制备超薄切片并在电镜下观察。A:pcDNA3-miniSOG转染后48 h;B:pTPL-NPSOG转染后24 h;C:pTPL-NPSOG转染后48 h。图A中*号指示的是表达miniSOG蛋白的细胞。N:细胞核;G:高尔基体;M:线粒体;ER:内质网;IBF:包涵体图3 转染不同时相的miniSOG或NPSOG蛋白表达情况Cells were fixed in 2.5% glutaraldehyde in situ, stained with DAB through photooxidation, post-fixed in 1% osmium tetroxide, and used to prepare ultrathin sections which were observed under transmissionn electron microscope after transfecting with plasmid of pcDNA3-miniSOG for 48 h (A) or pTPL-NPSOG for 24 h (B), 36 h (C) and 48 h (D), respectively. A: * indicates the cell expressing protein miniSOG. N: Nucleus, G: Golgi apparatus, M: Mitochondrion, ER: Endoplasmic Reticulum, IB: Inclusion bodiesFig.3 The expression of miniSOG or NPSOG protein in different transfection phases
2.4不同时相核蛋白NP形成包涵体的电镜观察为了观察不同时间点NPSOG蛋白在细胞内表达情况,我们分别在转染后24 h、36 h、48 h对细胞进行光氧化并制样。结果发现,转染24 h(图3B),胞浆内可见清晰的内质网、高尔基体、线粒体等细胞器,胞浆及核周出现散在的点状核蛋白,部分蛋白周围可见内质网或高尔基体附着,且蛋白有聚集的趋势;转染36 h(图3C)及48 h(图3D),核蛋白在核周聚集成块状包涵体样结构,除线粒体外,未在包涵体周围观察到内质网、高尔基体等其他细胞器的附着,也未见其他明显的亚细胞结构改变。而pcDNA3-miniSOG转染48 h的细胞,miniSOG蛋白均匀分布于细胞内(图3 A)。结果表明,293细胞胞浆内核蛋白NP数量积累到一定程度,就会聚集形成块状包涵体样结构。
3 讨论
布尼亚病毒基因组以核糖核蛋白复合物形式存在,核蛋白NP在病毒颗粒内通过与病毒基因组RNA和RNA聚合酶结合形成NP体(ribonucleopro-tein, RNP),除了具有保护作用外,同时又具有同型寡聚化和与RNA结合的特性,这些特性使得核蛋白NP在病毒的转录、复制以及病毒颗粒的组装过程中发挥重要作用。miniSOG蛋白不但可以在蓝光激发下呈现绿色荧光,而且经DAB和OsO4固定染色后可以被电镜解析,因此,经miniSOG标记的SFTSV核蛋白可以从更微观的水平对其与细胞的相互作用进行研究。
多种细胞系对SFTSV敏感,如非洲绿猴肾细胞系Vero、人巨噬细胞THP-1细胞、人肾上皮细胞293细胞等[7-8]。本研究采用293细胞作为核蛋白NP表达、定位研究细胞系。将成功构建并鉴定无误的pTPL-NPSOG质粒转染293细胞,得到了相关蛋白,并通过Western blot进行了验证。结果表明两种蛋白大小符合预期,说明miniSOG标签已成功添加到SFTSV核蛋白NP,且该标签未对NP蛋白的抗原性造成影响。
通过免疫荧光的方法来研究原布尼亚病毒科病毒蛋白的细胞内分布情况已有许多报道,如有研究发现裂谷热病毒Gc蛋白上有特异性甘油磷脂识别区域来驱动靶膜的插入[9];汉坦病毒核衣壳蛋白和Gc蛋白在细胞内集聚可以帮助Gn蛋白形态稳固和功能发挥等[10]。但共定位技术需要对不同蛋白、细胞器等进行荧光染色标记、漂洗,共聚焦时像素的强弱、背景信号及荧光分辨率等原因,可能会产生干扰现象。而mimiSOG标签分子量小,相关基因与目的基因融合操作简单,质粒导入细胞表达后可直接进行细胞切片,可以避免荧光染色、图像复合等步骤干扰,在电镜观察病毒蛋白在细胞内定位分布方面有较高的应用价值。本研究利用该技术成功建立了针对SFTSV核蛋白NP的光镜-电镜关联方法,通过荧光显微镜初步定位了表达NPSOG蛋白的细胞,进而通过电镜更为清晰地观察蛋白的亚细胞定位、转运情况,以及相关细胞的微观结构改变。
通过观察NPSOG蛋白转染后不同时相(24 h、36 h、48 h)的特征,我们发现随着质粒转染后时间的延长和NPSOG蛋白表达的增加,宿主细胞胞浆及核周开始出现散在的、体积较小的点状结构,并逐渐聚集,最终在转染后36 h及48 h在胞浆中形成体积较大、形状不规则的聚集性结构。据文献报道,这种结构很可能是由病毒蛋白形成的包涵体结构[11-12]。包涵体类似病毒工厂,许多病毒为了提高复制和组装效率,往往会利用宿主细胞器和某些蛋白在胞内形成一个聚集病毒成分的特殊结构,达到高效复制、转录、组装的目的[13]。布尼亚病毒科其他成员也能形成包涵体,例如汉坦病毒(HTNV)可在胞内形成颗粒状或丝状包涵体;拉克罗斯病毒NP蛋白在宿主细胞核周形成包涵体样结构[14-15]。研究结果显示:(1)单独表达SFTSV核蛋白NP即可形成包涵体样结构,没有其他病毒蛋白协助,可能是核蛋白NP具有定向聚集或包涵体形成信号;(2)包涵体的形成需要一定数量的核蛋白NP的积累与聚集,核蛋白表达后定向移动,逐渐累积,最终形成一个体积较大的聚集性结构。因此,通过单独对SFTSV核蛋白的电镜观察及性质研究,我们不仅避免了活病毒的操作,也屏蔽了病毒其他蛋白之间相互作用带来的影响,有利于核蛋白自身性质的研究,为下一步SFTSV其他结构蛋白及非结构蛋白的研究打下了基础。
在本研究中,我们发现293细胞在质粒转染24 h后,胞浆及核周开始出现散在的点状蛋白,蛋白周围可见一定数量的内质网和高尔基体,这可能与NPSOG蛋白的合成修饰有关,亚细胞结构未见明显改变;质粒转染48 h后,胞浆及核周点状蛋白消失,代之以一个或几个较大的聚集性结构,且远离胞核,胞浆中内质网及高尔基体数量减少,这可能是由于NPSOG蛋白聚集形成包涵体作为病毒工厂时吸纳了部分内质网和高尔基体等细胞器,而包涵体染色较深,导致细胞器被覆盖而无法观察所致。内质网和高尔基体是病毒成熟包装的重要场所,提示SFTSV核蛋白聚集形成包涵体结构可能是SFTSV复制周期中的必需环节,与病毒包装成熟密切相关。
综上所述,本研究通过电镜直接观察到了SFTSV核蛋白NP在293细胞中的表达、定位及形态特点,并通过观察不同时相下亚细胞结构的改变,描述了核蛋白NP所形成包涵体的特征,为进一步理解SFTSV胞内复制组装提供了线索。
利益冲突:无
[1]Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel bunyavirus in China[J]. N Engl J Med, 2011,364: 1523-1532.DOI: 10.1056/NEJMoa1010095.
[2]Brennan B, Rezelj VV, Elliott RM. Mapping of Transcription Termination within the S Segment of SFTS Phlebovirus Facilitated Generation of NSs Deletant Viruses[J]. J Virol,2017, 27:91(16). pii: e00743-17. DOI: 10.1128/JVI.00743-17.
[3]Tanenbaum ME, Gilbert LA, Qi LS, et al. A Protein-Tagging System for Signal Amplification in Gene Expression and Fluorescence Imaging[J]. Cell, 2014,23:159(3):635-646. DOI: 10.1016/j.cell.2014.09.039.
[4]李东卫, 王靖飞. 定量免疫电镜技术的研究进展[J]. 电子显微镜学报. 2012, 03, 273-277.
[5]Shu X, Lev-Ram V, Tsien R Y, et al. A genetically encoded tag for correlated light and electron microscopy of intact cells, tissues, and organisms [J]. PloS Biol,2012, 9(4):e1001041. DOI: 10.1371/journal.pbio.1001041.
[6]邹小辉, 邵博, 王敏,等. 建立基于miniSOG标签的光镜-电镜关联方法观察腺病毒IX蛋白的亚细胞定位[J]. 中华实验和临床病毒学杂志,2017, 32(1):8-12. DOI 10.3760/cma.j.issn.1003-9279.2017.01.002.
[7]Jin C, Liang M, Ning J, et al. Pathogenesis of emerging severe fever with thrombocytopenia syndrome virus in C57/BL6 mouse model[J]. Proc Natl Acad Sci USA, 2012, 109(25):10053-10058. DOI: 10.1073/pnas.1120246109.
[8]Li D. A highly pathogenic new bunyavirus emerged in China[J]. Emerg Microbes Infect, 2013,2(1):e1. DOI: 10.1038/emi.2013.1.
[9]Guardado-Calvo P, Atkovska K, Jeffers SA,et al.A glycerophospholipid-specific pocket in the RVFV class II fusion protein drives target membrane insertion[J]. Science,2017,3:358(6363):663-667. DOI:10.1126/suence.aai.2712.
[10]Ganaie SS, Mir MA.The role of viral genomic RNA and nucleocapsid protein in the autophagic clearance of hantavirus glycoprotein Gn[J]. Virus Res,2014,17:187:72-76.DOI:10.1016/virusres.2013.12.034.
[11]Ma D, George CX, Nomburg J, et al. Upon Infection the Cellular WD Repeat-containing Protein 5 (WDR5) Localizes to Cytoplasmic Inclusion Bodies and Enhances Measles Virus Replication[J]. J Virol,2017,13. pii: JVI.01726-17. DOI: 10.1128/JVI.01726-17.
[12]Novoa RR, Calderita G, Arranz R, et al. Virus factories: associations of cell organelles for viral replication and morphogenesis[J]. Biol Cell, 2005,97(2):147-172.
[13]Hoenen T, Shabman RS, Groseth A, et al. Inclusion bodies are a site of ebolavirus replication. J Virol, 2012,86(21):11779-11788. DOI: 10.1128/JVI.01525-12.
[14]Kochs G, Janzen C, Hohenberg H, et al. Antivirally active MxA protein sequesters La Crosse virus nucleocapsid protein into perinuclear complexes[J].Proc Natl Acad Sci USA,2002,5:99(5):3153-3158.
[15]Tao H, Xia SM, Chan ZY, et al. Morphology and morphogenesis of viruses of hemorrhagic fever with renal syndrome. II. Inclusion bodies--ultrastructural markers of hantavirus-infected cells[J]. Intervirology,1987,27(1):45-52.

