交叉引物恒温扩增技术在副溶血性弧菌毒力基因检测中的应用
吴晓芳 纪蕾 严伟 黄世旺 马学军
313000 湖州市疾病预防控制中心微生物检验科(吴晓芳、纪蕾、 严伟);310000 杭州市江干区疾病预防控制中心检验科(黄世旺);102206 北京,中国疾病预防控制中心病毒病预防控制所(马学军)
副溶血性弧菌 (vibrio parahaemolyticus,VP)是一种分布极为广泛的嗜盐性致病菌[1]。我国南方沿海地区每年都有副溶血性弧菌引起食物中毒的报道,已成为最严重的食源性病原菌[2]。
副溶血性弧菌致病性是由其产生的毒力因子决定的。即不耐热溶血素(TLH)、耐热直接溶血素(TDH)和耐热直接相关溶血素(TRH)[3]。TLH 基因具有种属特异性,无论是临床还是环境分离的副溶血性弧菌均携带TLH 基因[4];而副溶血性弧菌临床分离株通常携带TDH或TLH毒力基因[5]。
副溶血性弧菌常规的细菌培养方法操作繁琐费时,很难实现快速检测的要求。近年来很多分子生物学技术在VP的检测中发挥了很大的作用。但分子生物学方法都需要配备昂贵的仪器,且技术要求高,不利于现场、基层单位的使用。交叉引物恒温扩增技术(cross priming amplification,CPA)是一项全新的恒温扩增检测技术[6],与LAMP、NASBA等被广泛应用于各种病原的快速检测[7]。目前,CPA技术已成功应用到细菌和病毒的核酸检测中,如志贺氏菌和甲型H1N1流感病毒[8-9]。本研究采用交叉引物恒温扩增-核酸检测装置,建立了快速检测副溶血性弧菌TLH、TDH的方法。现将结果报道如下:
1 材料与方法
1.1实验材料
1.1.1菌株来源:副溶血性弧菌参考菌株ATCC 17802(TLH+)ATCC33847(TLH+和TDH+)由浙江省疾控中心提供;本实验室从水产品和临床腹泻患者标本中分离保存的副溶血性弧菌共464株(水产品128株,临床标本336株);其他致病菌16株由浙江省疾控中心提供(嗜水气单胞菌 ATCC 35654、类志贺邻单胞菌 ATCC 14029、非O1群霍乱弧菌 CMCC 04819、溶藻弧菌 ATCC 17749、创伤弧菌 ATCC 27562、大肠埃希氏菌 ATCC 25299、鼠伤寒沙门氏菌 ATCC 50013、阪崎肠杆菌 ATCC 29544、奇异变形杆菌 CMCC 49005、产气肠杆菌 CMCC 45103、福氏志贺菌2b型 ATCC 12202、肺炎克雷伯菌 ATCC 13883、金黄色葡萄球菌 ATCC 25923、蜡样芽孢杆菌 ATCC 14579、单核细胞增生李斯特菌 ATCC 54002、铜绿假单胞菌 ATCC 27853)。
1.1.2主要试剂:全封闭核酸检测装置购置杭州优思达生物技术有限公司(生产批号:20160920-34),副溶血性弧菌TRH、TDH、TLH 三重荧光PCR法检测试剂盒由深圳生科原生物股份有限公司提供(生产批号:17020907)。DNA提取试剂盒由北京卓诚惠生生物科技股份有限公司提供(生产批号:20160118)。
1.1.3主要仪器:ABI 7500型荧光定量PCR仪购置美国ABI公司,恒温金属浴购置杭州博日科技有限公司。
1.2实验方法
1.2.1引物和探针:根据TLH、TDH保守序列设计VP-CPA引物、探针,引物设计参考文献[10-11]。引物、探针委托大连宝生物工程有限公司合成。
1.2.2菌落计数:以无菌操作分别将副溶血性弧菌参考菌株培养液1 ml按10倍递增稀释至10-1~10-6浓度,并选择10-3、10-4、10-53个稀释度各0.2 ml 接种平板,同一稀释度做三个平行,37 ℃培养24 h后计数平板上可见菌落数,即可推算出原液中所含的细菌数。
1.2.3模板DNA的制备:取各类菌株分别接种选择性平板,37 ℃培养18 h,取纯菌落用DNA提取试剂盒提取模板。-20 ℃ 保存备用。
1.2.4CPA反应体系和条件:反应体积为20 μl,通过调整反应温度(56~64 ℃)、反应时间(20~70 min)等确定最佳的CPA-核酸检测试纸条法的反应条件[12]。
1.2.5CPA扩增产物分析:将CPA扩增产物直接放入全封闭式靶核酸检测装置中,5~10 min后观察结果:质控线(C)和检测线(T)都出现红线,结果为阳性;只在质控线(C)出现红线,结果为阴性。见图1。
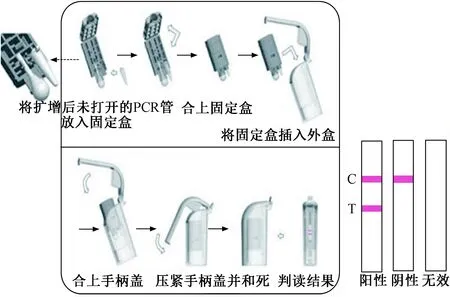
图1 全封闭式靶核酸检测装置使用说明及结果判断Fig.1 Closed target nucleic acid detection device instructions
1.2.6特异性实验:取水产品和临床标本中分离的VP菌株以及其他致病菌菌株,采用CPA-核酸检测试纸条法进行TLH、TDH 检测,验证特异性。
1.2.7灵敏性实验:分别取上述10-1~10-6的菌悬液用DNA提取试剂盒提取模板。采用CPA-核酸检测试纸条法和荧光定量PCR法同时进行TLH、TDH 检测,评价反应体系的敏感性。
1.2.8重复性实验:分别取上述10-1~10-6的菌悬液用DNA提取试剂盒提取模板,每个稀释度平行重复3次,通过对各次实验结果来评价反应体系的稳定性。
2 结果
2.1菌落计数选择副溶血性弧菌参考菌株10-3、10-4、10-53个稀释度的菌悬液,24 h培养后,可清晰观察到平板上生长的菌落,经比较筛选,以10-3的3个平板上生长的平均菌落数分别是36和32来计算原菌液的细菌含量,经计算原菌液的细菌浓度为1.8×105cfu/ml和1.6×105cfu/ml。
2.2CPA方法检测VPTLH、TDH最佳反应温度检测TLH、TDH 反应体系总体积20 μl,包括 Buffer 17 μl、混合酶 1 μl 以及DNA模板2 μl。取10-2~10-6的VP参考菌株菌悬液在不同反应温度下扩增 40 min,结果显示:最佳的反应温度为60 ℃。
2.3CPA方法检测VPTLH、TDH最佳反应时间取VP参考菌株菌悬液在60 ℃ 扩增条件下作用不同时间。结果显示:最佳的反应时间为40 min。
2.4CPA方法检测VPTLH、TDH的特异性CPA-核酸检测试纸条法分别对水产品、临床标本中分离的各10株VP菌株以及16株其他致病菌菌株进行TLH、TDH检测。结果显示:10株水产品中分离的VP菌株TLH阳性、TDH阴性;10株临床标本分离的VP菌株TLH和TDH均阳性;16株其他致病菌菌株TLH和TDH均阴性。

P:阳性对照;N:阴性对照;1∶1.8×105;2∶1.8×104;3∶1.8×103;4∶1.8×102;5∶1.8×101;6∶1.8×100;7∶1.8×10-1 cfu/ml图2 CPA方法检测VP TLH 灵敏性P:positive control;N:negative control;1∶1.8×105;2∶1.8×104;3∶1.8×103;4∶1.8×102;5∶1.8×101;6∶1.8×100;7∶1.8×10-1 cfu/mlFig.2 Sensitivity of CPA method to detect VP TLH

P:阳性对照,N:阴性对照,1∶1.6×105;2∶1.6×104;3∶1.6×103;4∶1.6×102;5∶1.6×101;6∶1.6×100;7∶1.6×10-1 cfu/ml图3 CPA方法检测VP TDH 灵敏性P:positive control;N:negative control;1∶1.6×105;2∶1.6×104;3∶1.6×103; 4∶1.6×102;5∶1.6×101;6∶1.6×100;7∶1.6×10-1 cfu/mlFig.3 Sensitivity of CPA method to detect VP TDH
2.5CPA方法检测VPTLH、TDH的灵敏性对10-1~10-6的VP参考菌株菌悬液进行TLH、TDH检测。结果显示:CPA-核酸检测试纸条法检测TLH、TDH的最低检测限分别达到1.8 cfu/ml 和16.0 cfu/ml,和荧光定量PCR法结果完全一致。见图2、3。对每个浓度的VP参考菌株菌悬液都作三次重复检测, 检测的结果均能判断为阳性。
2.6CPA方法检测不同样本分离株TLH、TDH对464株不同来源的VP菌株用CPA-核酸检测试纸条法和荧光定量PCR法同时进行TLH、TDH检测,结果相符合。464株VP菌株TLH基因阳性率为100.00%(464/464);水产品中分离的VP菌株TDH毒力基因阳性率为7.81%(10/128);临床标本分离的VP菌株TDH毒力基因阳性率为97.32%(327/336)。见表1。
2.7实际样品检测采集食源性疾病腹泻标本85份,分别用Real-Time PCR方法和CPA法进行平行实验,对比两种方法的优劣性,进而评价CPA方法。实验结果表明:应用CPA法检出9份副溶血性弧菌TDH和TLH阳性,与Real-Time PCR方法检测结果完全一致。

表 1 CPA-核酸检测试纸条法检测VP TLH、TDH结果
3 讨论
副溶血性弧菌是引起急性胃肠炎的重要致病菌之一[13]。患者可出现腹痛、腹泻、恶心等临床症状。湖州市连续几年的食源性疾病病例监测结果显示,引起腹泻症状的致病菌主要以副溶血性弧菌为主[14]。
副溶血性弧菌引起致病的主要原因是可产生TDH和TRH溶血毒素[3],超过90%的VP临床分离株携带TDH毒力基因,而环境分离株仅0%~6%携带TDH毒力基因[15]。而TRH很少在各类标本中检出。因此建立副溶血性弧菌 TLH和TDH快速准确的检测方法十分必要,对及时有效治疗患者、控制事件蔓延具有重要意义。
CPA 方法是一种新颖的恒温扩增方法,仪器设备简单,只需能够保持恒定的温度即可。CPA扩增体系中主要包含具有链置换功能的Bst DNA聚合酶,还包括扩增引物和两条交叉引物。这些寡聚核苷酸链能依靠Bst DNA聚合酶的高活性的链置换特性,使DNA的循环扩增能不断的实现,从而达到基因扩增的效果。整个扩增及结果观察可以在1 h内完成。由于其中一条特异性引物的5’末端标记了Biotin,特异性探针3’末端标记了FITC,扩增结束后的扩增产物分别与核酸检测装置中反应试剂条中的标记生物素结合链霉素共轭颜色颗粒以及测试线中的抗FITC抗体结合,测试结果显示颜色,可在5 ~10 min肉眼观察结果。更重要的是将扩增产物放在全封闭式核酸检测装置中,降低了由扩增产物引起的交叉污染[6]。本研究建立的副溶血性弧菌TLH、TDH CPA-核酸检测试纸条方法灵敏度高,对菌株的最低检测限达到1.8 cfu/ml 和16.0 cfu/ml;特异性好,与其他致病菌均没有交叉反应。重复性实验表明,CPA检测方法稳定性好,且与荧光定量PCR方法检测结果相符。
研究结果显示,用CPA-核酸检测试纸条法分别对464株不同来源的VP菌株进行TDH 检测,阳性率分别为7.81%(水产品分离株)和97.32%(临床分离株),与荧光定量PCR方法检测结果一致。
综上所述, 本研究建立的VP-CPA快速检测技术,是将高端的基因诊断技术转化为操作简单快捷、结果准确可靠的方法,无需特殊仪器设备, 实现了结果的可视化。另外,扩增产物放在一个全封闭的核酸检测装置中,完全避免了扩增产物的泄漏,产物间的交叉污染以及假阳性结果。因此非常适用于基层以及突发公共卫生事件的现场快速检测。
利益冲突:无。
[1]张勇,赖植发,周海涛,等.副溶血性弧菌临床分离株血清型、毒力基因和PFGE分子分型特征分析[J].卫生研究,2013,42(4):619-624.
[2]刘秀梅,陈艳,王晓英,等.1992-2001年食源性疾病暴发资料分析-国家食源性疾病监测网[J].卫生研究,2004,33(6):729-731.
[3]郑文龙,王卓,马洁,等.副溶血性弧菌病原学和分子流行病学流行特征研究进展[J].疾病监测,2015,30(41):337-341.DOI:10.3784/j.issn.1003-9961.2015.04.022.
[4]Shinoda S,Matsuoka H,Tsuchie T,et al.Purification and characterization of a lecithin-dependent haemolysin from Escherichia coli transformed by a Vibrio parahaemolyticus gene[J].J Gen Microbiol,1991,137(12):2705-2711.DOI:10.1099/00221287-137-12-2705.
[5]陈茂义,胡婕,陈婷,等.副溶血性弧菌毒力基因研究进展.公共卫生与预防医学,2013, 24(3):65-67.
[6]G.Xu,L.Hu,H.Zhong,et al.Cross priming amplification: mechanism and optimization for isothermal DNA amplification[J]. Sci Rep 2012,2(2012):246.DOI:10.1038/srep00246.
[7]聂凯,腾志平,曾毅,等.环介导等温扩增技术研究进展及其在病原检测中的应用[J].中华实验和临床病毒学杂志,2013,27(3): 316-318.DOI:10.3760/cma.j.issn.1003-9279.2013.03.025.
[8]祁军,张霞,蒋刚强,等.交叉引物等温扩增技术检测志贺氏菌[J].食品研究与开发,2013,34:65-67,76.DOI:10.3969/j.issn.1005-6521.2013.11.017.
[9]白志军,胡林,李魁彪,等.交叉引物等温扩增法检测甲型H1N1流感病毒及临床应用[J].中国人兽共患病学报,2015,31:208-211,215.DOI:10.3969/cjz.j.issn.1002-2694.
[10]徐苗苗,李健,李桂玲,等.CPA-核酸试纸条快速检测副溶血性弧菌(Vibrio parahaemolyticus)方法的建立及其在海产品检测中的应用[J].海洋与湖沼研究,2016, 47:681-688.DOI:10.11693/hyhz20160200036.
[11]黄世旺,卢亦愚,李剑,等.交叉引物恒温扩增技术快速检测副溶血性弧菌耐热直接溶血素基因[J].中国卫生检验杂志,2016,26:1906-1908,1953.
[12]De shun Xu, Xiaofang Wu,Jiankang,Han, et al.A cross-priming amplification assay coupled with vertical flow visualization for detection of Vibrio parahaemolyticus[J].Mol Cell Probes,2015,29(6):527-530.DOI:10.1016/j.mcp.2015.07.007.
[13]刘秀梅,程苏云,陈艳,等.2003 年中国部分沿海地区零售海产品中副溶血性弧菌污染状况的主动监测[J].中国食品卫生杂志,2005,17(2):97-99.
[14]付云,胡菊妹,张鹏.湖州市2013年腹泻病哨点医院监测结果分析[J].浙江预防医学,2013,27(9):931-932,934.
[15]Chao G,Jiao X,Zhou X,et al.Distribution of genes encoding four pathogenicity Islands (VPaIs),T6SS,biofilm,and type I pilus food and clinical strains of Vibrio parahaemolyticus in China[J].Foodborne Pathog Dis,2010,7(6):649-658.DOI:10.1089/fpd.2009.0441.

