真空冷冻喷雾干燥下川藏高原冰酒发酵菌剂复合保护剂的配方优化
,,*,,,,
(1.西华大学食品与生物工程学院,食品生物技术重点实验室,四川成都 610039; 2.理县塔斯酒庄有限公司,四川阿坝藏族羌族自治州 623100; 3.日本国际农业科学研究中心,日本筑波 30528686)
冰酒是采用结冰的葡萄经过压榨、低温发酵而酿造的葡萄酒,其酒体呈金黄色透明状,果香浓郁,风味独特,具有美容、养颜、保健等功效[1-2]。目前,全球冰酒产地有德国、奥地利、瑞士、加拿大和中国,而川藏高原是我国冰酒的主要产区之一[3],具有“海拔高、日照强、温差大”等气候优势。在冰酒的酿造过程中,酵母菌种的选择至关重要,影响酒的品质和香气。市售酿酒酵母菌剂大多为葡萄酒通用酵母,若用于酿造冰酒,所得产品将丧失冰酒特有风味[4],所以冰酒酿造专用菌剂的研发就显得尤为重要。将冰葡萄中分离纯化获得的酵母菌种所生产菌剂用于酿造冰酒,不仅发酵过程得以精准控制[5],还能保持冰酒独特的风味,酿出高品质的冰酒。
目前,国内外菌剂制备的主要方式为真空冷冻干燥法和喷雾干燥法,真空冷冻干燥法制得的菌剂活菌率高,但干燥时间长,成本高,干燥物料为块状[6],喷雾干燥法生产菌剂虽时间短,但产品活菌率较低。本研究采用真空冷冻喷雾干燥法制备川藏高原冰酒专用发酵菌剂,所需干燥时间短,生产成本低,干燥物料为粉末状,复水性强,保持了产品的生物活性[7-10]。实验优化了冰酒发酵菌剂的保护剂配方,并对最优配方下所制备的菌剂进行性能分析,为川藏高原冰酒发酵菌剂标准化生产提供参考。
1 材料与方法
1.1 材料与仪器
酿酒酵母(Saccharomycescerevisiae)从冰葡萄渣中分离得到[11],编号为JH2,保存于四川省微生物资源平台菌种保藏中心(SSIC);酵母浸出粉胨葡萄糖培养基(YPD)北京奥博星生物技术有限责任公司;葡萄糖无水,成都科龙化工试剂厂;甘油、蔗糖、麦芽糊精(食品级)康达食品工程有限公司;脱脂乳粉完达山乳业股份有限公司。
BKD-126M实验室喷雾冷冻干燥机上海雅程仪器设备有限公司;SRK-14D电热恒温隔水式培养箱黄石市恒丰医疗器械有限公司;SW-CJ-2F型双人双面净化工作台苏州净化设备有限公司;ZWY-1102C恒温培养振荡器上海智域分析仪器制造有限公司;LDZX-75KB立式压力蒸汽灭菌器上海申安医疗器械厂;JSM-7500F电子显微镜日本电子株式会社;IMP-Apollo热重分析仪Shimadzu Kyoto Japan。
1.2 实验方法
1.2.1菌种活化、富集活化:取保存的酿酒酵母甘油管一支,吸取1 mL加入装有10 mL无菌 YPD培养基的试管中,放于28 ℃摇床培养48 h。用接种环蘸取上述活化后的菌悬液,在虎红琼脂上划线,28 ℃恒温培养2~3 d,待用。
富集:将上述活化后的酿酒酵母,按4%接种量加到YPD培养基中,28 ℃摇床培养48 h后,4500 r/min、4 ℃离心20 min,收集沉淀,即为所富集菌体[12]。
1.2.2冰酒发酵菌剂真空冷冻喷雾干燥制备工艺在预实验基础上,实验优化得到4种保护剂,通过单因素和正交实验来优化保护剂配方,提高菌剂活菌率。将富集菌体和各种浓度的保护剂按1∶4的体积比混合后,磁力搅拌30 min,混合均匀,同时打开真空冷冻喷雾干燥机进行预冷,待当前物料温度为-40 ℃时,将混合溶液喷成小冰晶状进入真空冷冻喷雾干燥机,进行升华干燥,干燥后即为粉末状的菌剂[13-14]。
1.2.3复合保护剂单因素实验本实验中选取甘油、蔗糖、脱脂乳粉和麦芽糊精4种保护剂作为菌剂的保护剂,固定甘油的实验水平为4%,蔗糖实验水平为6%,脱脂乳粉实验水平为10%,麦芽糊精实验水平为14%。分别改变甘油添加量(2%、4%、6%、8%、10%)、蔗糖添加量(2%、4%、6%、8%、10%)、脱脂乳粉添加量(4%、6%、8%、10%、12%)、麦芽糊精添加量(10%、12%、14%、16%、18%),经过真空冷冻喷雾干燥制成菌剂,以菌剂的活菌率为评价指标,确定各保护剂的较优浓度。
1.2.4正交实验根据孟宪军[15]、张帆[16]的相关研究,复合保护剂的效果优于单一保护剂。结合单因素实验结果,对甘油、蔗糖、脱脂乳粉和麦芽糊精4种保护剂进行L9(34)正交实验,以活菌率为评价指标,优化复合保护剂配方,正交实验因素和水平见表1。
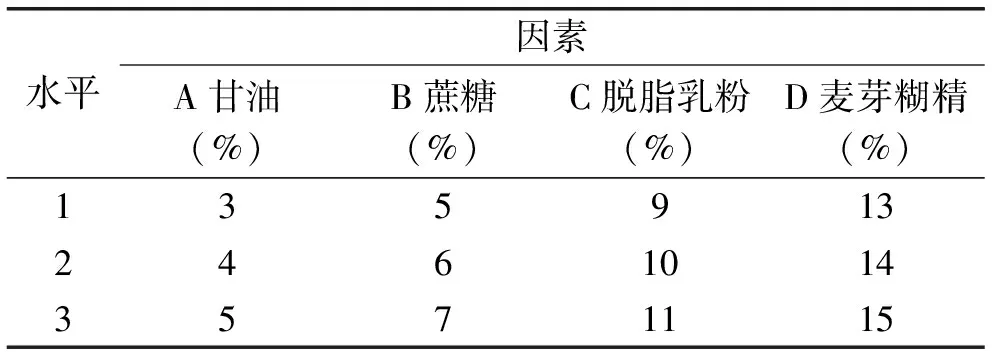
表1 正交实验因素和水平Table 1 Experimental factor and level of orthogonal test
1.2.5菌剂活菌率测定参考张帆[15]等的方法,并作一定的改进,冰酒发酵菌剂的活菌率计算公式为:

活菌数测定:参照GB 4789.15-2010进行测定[17]。
1.2.6菌剂性能分析在最优复合保护剂配方下,对冰酒发酵菌剂进行性能分析。
1.2.6.1微观形态分析用扫描电镜来观察发酵菌剂的微观形态[18]。在扫描电子显微镜样品台上贴上双面胶,将菌剂样品粘贴在双面胶上,然后镀膜观察;电压为15 kV,放大倍数为100和1000。
1.2.6.2热失重分析将菌剂样品放置在刚玉坩埚中,进行热失重分析,升温速度为10 ℃/min,初温30 ℃,终温400 ℃,记录热失重曲线[19]。
1.2.6.3热稳定性分析称取0.1 g菌剂产品至9.9 mL无菌蒸馏水中,分别置于40、50、60 ℃水浴锅中水浴20 min,每10 min进行一次活菌计数。
1.2.6.4低温稳定性分析称取0.1 g菌剂产品至9.9 mL无菌蒸馏水中,分别放置在4 ℃和10 ℃中,保持12周,每4周进行一次活菌计数[20];同时,称取0.1 g菌剂产品至9.9 mL无菌的YPD液体培养基中(事先放入杜氏小管),置于4 ℃和10 ℃培养14 d,每天观察菌剂产气情况并记录结果。
1.2.6.5发酵性能挑选大小均一,无机械损伤的冰葡萄,破碎后取汁,将葡萄汁转移到6个发酵罐中,每个发酵罐中500 mL。将冷冻喷雾干燥制得的冰酒发酵菌剂和市售安琪酵母菌剂按0.1 g的接种量分别接种到对应发酵罐中,并加入发酵液总体积1.5%的蔗糖溶液,加盖密封,3个平行为一组。将上述接种酵母后的发酵罐放入15 ℃的恒温培养箱中进行发酵,隔天定时测量其酒精度、总糖和总酸含量。
1.2.6.6冰酒品质分析方法酒精度:采用酒精计直接测定[21];总糖:采用手持糖度仪测定[21];总酸:采用酸碱滴定法[22]。
1.3 数据处理
实验数据采用Excel进行数据统计和分析,采用SPSS 20.0进行显著性分析、Origin 9.0作图。
2 结果与分析
2.1 单因素实验结果
2.1.1甘油添加量对菌剂活菌率的影响甘油又称丙三醇,常用作防冻剂、保湿剂以及溶剂等[23],从图1可知,在真空冷冻喷雾干燥时,甘油在酿酒酵母微胶囊化中保护作用明显,随着添加量的增加,菌剂的活菌率逐渐升高,当添加量超过4%时,随着添加量的增加活菌率反而下降。主要原因可能在于:当甘油添加量小于4%时,随添加量的增加,菌悬液的黏性增强,酵母菌细胞内外的渗透压相近,在升华干燥时,减缓细胞失水的速度,从而起到保护作用,增加酵母存活率[24]。当甘油添加量超过4%时,菌悬液水分含量较高,黏度较大,难以干燥为粉末状的微胶囊,而是黏稠状,影响细胞的存活。因此,甘油添加量4%时,微胶囊菌剂的活菌率为34.98%,达到最大值。
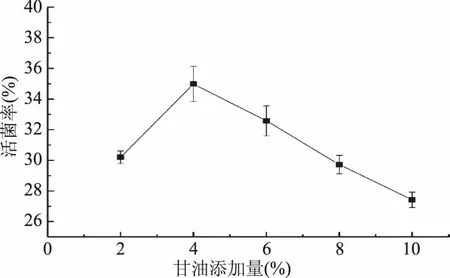
图1 不同甘油添加量对菌剂活菌率的影响Fig.1 Effect of glycerol content on survival rate of yeast agents
2.1.2蔗糖添加量对菌剂活菌率的影响蔗糖除了作为甜味剂,还是一种冷冻结晶改良剂以及膨松剂,其玻璃化温度较高,只能透过细胞壁,不能透过细胞膜,在微生物菌剂升华干燥过程中可保护细胞免受损伤,提高产品活菌数。如图2,当蔗糖添加量为6%时,酵母菌剂活菌率显著(p<0.05)高于其余各实验组;当添加量小于6%时,随着蔗糖浓度增加,菌剂产品活菌率不断增加;当添加量大于6%时,菌剂产品的活菌数随着浓度增加反而下降。这可能由于:添加量增加,蔗糖融化后,菌悬液黏度增加,影响细胞壁的通透性,经真空冷冻喷雾干燥后,不能使菌悬液完全干燥成粉末状,所以发酵菌剂的活菌率反而下降[25]。
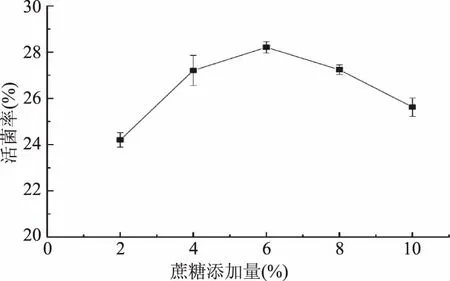
图2 不同蔗糖添加量对菌剂活菌率的影响Fig.2 Effect of sucrose content on survival rate of yeast agents
2.1.3脱脂乳粉添加量对菌剂活菌率的影响脱脂乳粉是将鲜牛奶脱去脂肪后再干燥而成的粉末状产品,蛋白质是其主要成分,将其作为菌剂真空冷冻喷雾干燥时的保护剂,能使菌剂产品具有较优的呈粉性和复水性[26],在酿酒酵母菌体周围形成一层外壁,具有保护作用。从图3可知,当脱脂乳粉添加量小于10%时,随着其浓度增加,微胶囊产品中酿酒酵母的活菌率不断上升;当添加量超过10%后,菌剂产品的活菌率反而下降。因为,在脱脂乳粉添加量为10%时,其对酵母菌的保护效果已经达到最大值,菌剂活菌率显著(p<0.05)高于其余各添加量,若继续提高浓度,则干燥产品中脱脂乳粉所占比例将会增加,活菌率反而下降。所以从节约成本角度出发,选择10%为脱脂乳粉较优添加量。
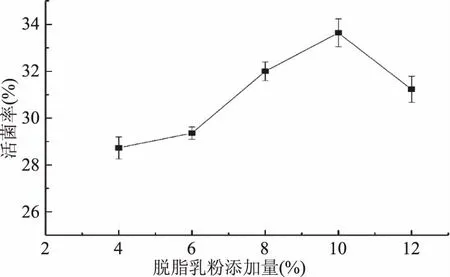
图3 不同脱脂乳粉添加量对菌剂活菌率的影响Fig.3 Effect of skimmed milk powder content on survival rate of yeast agents
2.1.4麦芽糊精添加量对菌剂活菌率的影响麦芽糊精是以各类淀粉为原料经酶解、提纯和干燥制成,具有良好的溶解性,不易潮解,是微胶囊制备中的较好载体。从图4可知,在麦芽糊精添加量低于14%时,随着其浓度增加,微胶囊产品中酿酒酵母的活菌率不断上升;当添加量超过14%后,菌剂产品的活菌率反呈下降趋势。在麦芽糊精添加量为14%时,其对酵母菌的保护效果差异显著(p<0.05),活菌率达到最大值,所以,选取14%为麦芽糊精的较优添加量。

图4 不同麦芽糊精添加量对菌剂活菌率的影响Fig.4 Effect of maltodextrin content on survival rate of yeast agents
2.2 正交实验结果
根据单因素实验结果,按表1的实验因素和水平进行了L9(34)正交实验,实验结果如表2、表3所示。
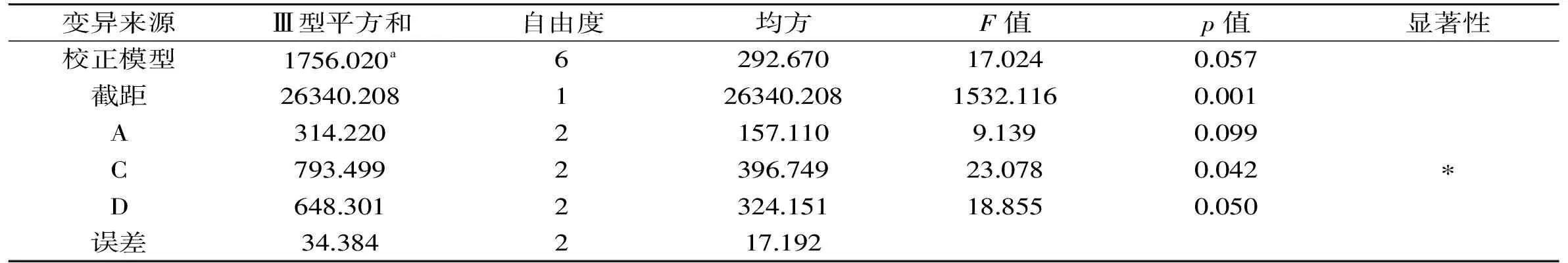
表3 方差分析Table 3 Variance analysis of orthogonal experiment results
注:“*”表示对菌剂产品活菌率影响显著,p<0.05。

表2 发酵菌剂保护剂配方优化正交实验设计及结果Table 2 Orthogonal array design and results for formula optimization of wall material
从表2和表3可知,4个因素对菌剂产品活菌率影响的主要顺序为:脱脂乳粉>麦芽糊精>甘油>蔗糖,其中脱脂乳粉对产品活菌率的影响显著(p<0.05)。从直观分析来看,菌剂产品最佳保护剂组合为A3B1C3D2,极差分析而言,菌剂产品最佳保护剂组合为A3B3C3D3,通过多次验证实验,组合A3B3C3D3的活菌率为78.25%,活菌数为10.34 CFU/g,高于组合A3B1C3D2。所以冰酒发酵菌剂复合保护剂的最优配方为A3B3C3D3,即甘油5%,蔗糖7%,脱脂乳粉11%,麦芽糊精15%。
2.3 性能分析
2.3.1微观形态分析图5为冰酒发酵菌剂在电子显微镜下的微观形态。由图可知,菌剂呈细小颗粒状,无结块现象发生;颗粒表面光滑且平整,保护效果较好,没有高温干燥而形成的微孔、褶皱。由此可见,添加最佳配方的复合保护剂后,对菌剂的微观形态起到了较好的保护作用。

图5 菌剂的微观结构Fig.5 Microstructure of yeast agents注:A:100倍;B:1000倍。
2.3.2热失重分析冰酒发酵菌剂的失重曲线如图6所示。菌剂的热失重分为三个阶段:第一,菌剂预热阶段,质量变化较平缓,温度范围为37~200 ℃,此时菌粉质量损失较少,所供热量主要用于菌粉的加热;第二,菌剂中蔗糖、蛋白质等物质分解,大量挥发阶段,质量随温度和时间呈直线下降,温度范围为200~340 ℃,质量分数从89.14%下降到40.54%;第三,菌剂质量稳定阶段,此时加热温度为350 ℃。整体看来,菌剂在240 ℃时质量分数仍然大于70%,说明制备的菌剂在240 ℃下是较稳定的,质量损失较少。
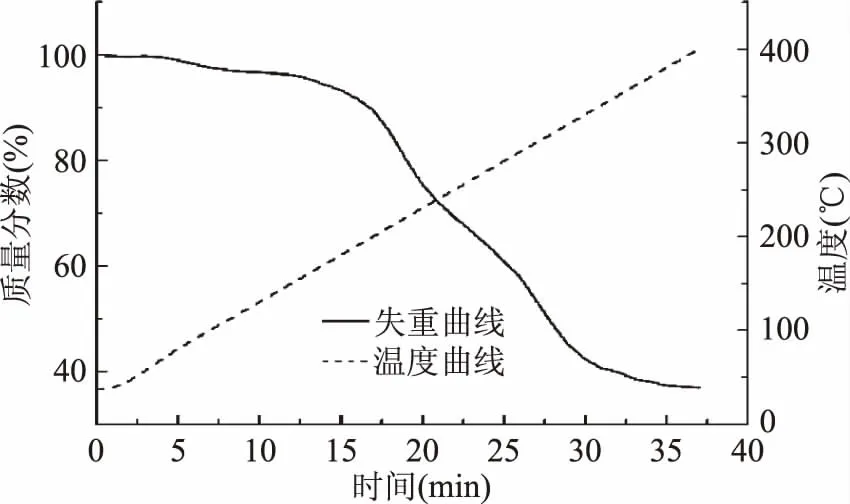
图6 菌剂的TG曲线Fig.6 TG curve of yeast agents in optimum protective agents
2.3.3热稳定性分析菌剂周围环境温度过高可能会导致其含有的菌种失活,选择适宜的保护剂可提高其对热的抵抗能力,保持菌种活性。不同热处理温度下对菌剂活菌数的影响如图7所示,在40、50、60 ℃下分别处理20 min后,菌剂中的活菌数从初始的10.51 CFU/g分别下降到了10.26、7.21、5.81 CFU/g。在40 ℃下,菌剂中活菌数下降了0.25 CFU/g,致死率仅为2.38%;50 ℃下,菌剂活菌数下降了3.30 CFU/g,致死率为31.39%。由此可见,该菌剂产品在40~50 ℃的高温下,其活菌数仍保持较高,致死率较低,对高温环境的抵抗性较强。
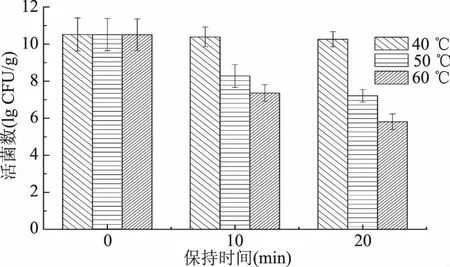
图7 不同热处理温度对菌剂活菌数的影响Fig.7 Effect of heat treatments on viable counts of yeast agents
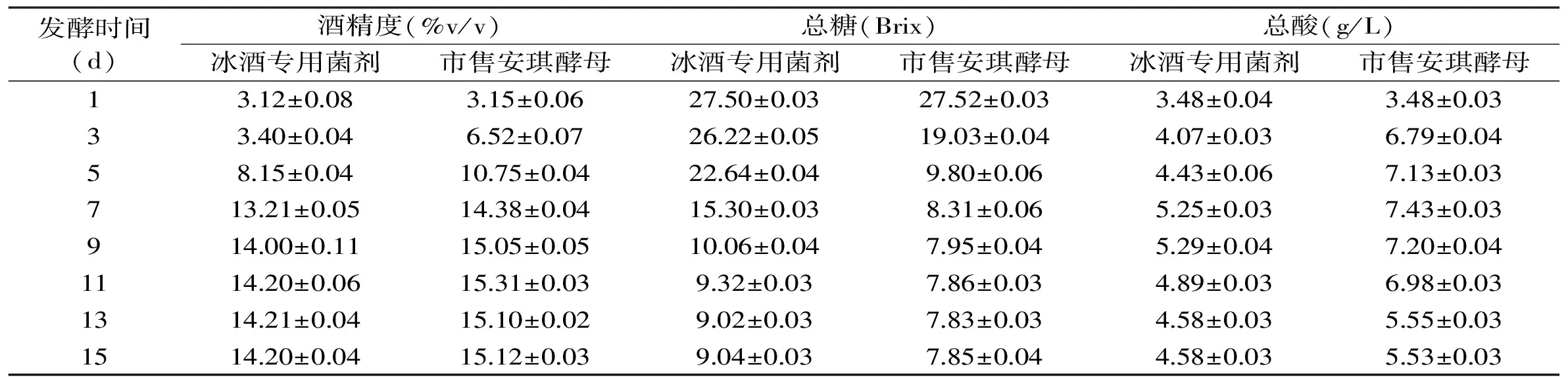
表5 冰酒发酵菌剂与市售酿酒酵母发酵性能对比Table 5 Comparison of fermentation performance between ice wine fermentation agents and commercially available Saccharomyces cerevisiae
2.3.4低温稳定性分析冰酒是在10~15 ℃低温发酵而来的,冰酒发酵菌剂应能耐低温,在低温下仍能发酵,所以考察冰酒发酵菌剂的低温稳定是必要的。如图8所示,在4 ℃和10 ℃下分别放置12周后,菌剂产品中的活菌数从初始的10.46 CFU/g分别下降到了6.99、8.92 CFU/g,致死率分别为33.17%和14.72%。从表4可知,菌剂中的酿酒酵母在10 ℃培养温度下,第5 d时能开始发酵;第7 d开始大量发酵,所产生气泡大于半管;第9 d时,所产生的气泡充满整个杜氏小管。由此可见,该发酵菌剂在10 ℃低温下活菌数保持较高,且仍能发酵产气,适用于酿造冰酒。
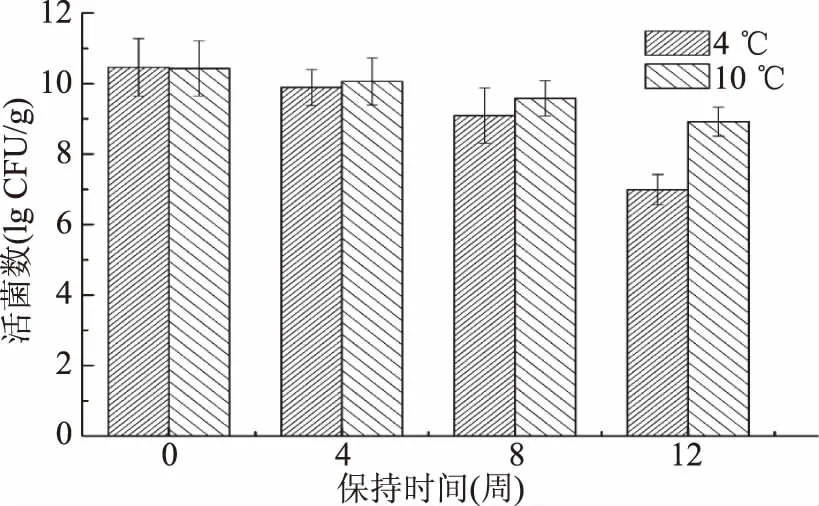
图8 不同低温处理对菌剂活菌数的影响Fig.8 Effect of low temperature on viable counts of yeast agents

表4 菌剂低温稳定性Table 4 Low temperature stability of yeast agents
注:“-”表示管内无气泡;“+”表示气泡量小于半管;“++”表示气泡量大于半管;“+++”表示气泡满管。
2.3.5发酵性能采用冰酒发酵菌剂酿造的冰酒与市售安琪酵母酿造而成的冰酒性能对比如表5所示,分别记录冰酒在发酵过程中的酒精度、总糖和总酸。
酒精度、总糖和总酸是衡量果酒品质的重要因素,酒精能抑制微生物生长,防止杂菌破坏酒的品质,酸度能赋予冰酒清新的品尝感,给上颚一种焕然一新的感觉。从酒精度来看,发酵到第9 d时,两种酵母发酵的冰酒酒精度趋于稳定,发酵结束时,冰酒专用菌剂酿造的冰酒酒精度为(14.20±0.04)%v/v,与市售冰酒酒精度接近,而市售安琪酵母所酿造的冰酒酒精度为(15.12±0.03)%v/v,远高于市售冰酒酒精度,酒味过于浓烈;从总糖和总酸含量来看,接种冰酒发酵菌剂后,冰酒在酿造过程中总糖下降趋势平缓,总酸含量上升和下降幅度较小,酸甜比例适宜,口感细腻,而接种安琪酵母后的冰酒总糖含量下降迅速,总酸含量变化较大,酸甜比略微失调。由此可见,冰酒专用菌剂在酿造冰酒过程中其发酵效果优于市售安琪酵母。
3 结论
以冰葡萄渣中分离的酿酒酵母为菌种,以甘油、蔗糖、脱脂乳粉和麦芽糊精为保护剂,运用真空冷冻喷雾干燥法制备冰酒专用发酵菌剂。通过单因素和正交实验,得到菌剂复合保护剂的最优配方为:甘油5%,蔗糖7%,脱脂乳粉11%,麦芽糊精15%,在此工艺条件下,制得的冰酒发酵菌剂活菌数为10.34 CFU/g,活菌率达到78.25%。再将此工艺条件下的冰酒发酵菌剂从微观形态、热失重、热稳定性、低温稳定性和发酵性能五方面进行性能分析,结果表明,该菌剂呈粉末状,颗粒表面光滑平整,无褶皱、微孔出现,保护效果较好;其热失重也较稳定,在240 ℃的高温下,质量损失小于30%;热稳定性和低温稳定性均较优,40 ℃下致死率仅为2.38%,在10 ℃的低温下能进行发酵产气,活菌数为8.92 CFU/g;在酿造冰酒的过程中,其发酵性能优于市售安琪酵母。由此看来,添加最优配方的复合保护剂后,经真空冷冻喷雾干燥法制备出的冰酒专用发酵菌剂性能较优,适用于冰酒的酿造。
[1]蒋丽. 川藏高原冰酒专用酵母菌株的筛选、菌剂制备与发酵工艺优化研究[D]. 成都:西华大学,2016:1-5.
[2]Cliff,Yuksel,Girard,et al. Characterization of Canadian ice wines by sensory and compositional analyses[J]. American Journal of Enology & Viticulture,2001,53(1):46-53.
[3]许青莲,芮光伟,邢亚阁,等. 氢化物原子荧光法测定川藏高原冰酒中的总砷[J]. 食品工业,2016(7):203-207.
[4]程雷. 葡萄自然发酵过程中酵母的分离鉴定及优良葡萄酒酵母筛选[D]. 哈尔滨:东北林业大学,2010:1-7.
[5]张丽珠,邢亚阁,许青莲,等. 川藏高原威代尔冰葡萄中酵母菌的分离、筛选及其耐受性研究[J]. 中国酿造,2013,32(10):94-97.
[6]Fritzenfreire C B,Prudêncio E S,Rdmc A,et al. Microencapsulation of bifidobacteria by spray drying in the presence of prebiotics[J]. Food Research International,2012,45(1):306-312.
[7]Ding W K,Shah N P. Effect of various encapsulating materials on the stability of probiotic bacteria.[J]. Journal of Food Science,2009,74(2):M100.
[8]Liao W C,Hsiao H C,Chou C C. Survival of bifidobacteria after spray-drying[J]. International Journal of Food Microbiology,2002,74(1-2):79-86.
[9]Fritzen-Freire C B,Prudencio E S,Amboni R D M C,et al. Microencapsulation of bifidobacteria by spray drying in the presence of prebiotics[J]. Food Research International,2012,45
(1):306-312.
[10]张慧娟,郝一铭,王静,等. 微生物包埋技术的研究进展[J]. 食品工业科技,2016,37(1):381-389.
[11]蒋丽,邢亚阁,车振明,等. 川藏高原冰葡萄中五种酵母菌的鉴定及耐受性研究[J]. 中国酿造,2014,33(10):36-39.
[12]方晨. 布拉迪酵母微囊化包埋技术的研究[D]. 武汉:武汉轻工大学,2015:9-12.
[13]Silva C M,Ribeiroa J,Ferreira D,et al. Insulin encapsulation in reinforced alginate microspheres prepared by internal gelation[J]. European Journal of Pharmaceutical Sciences,2006,29(2):148-159.
[14]罗佳琦. 嗜酸乳杆菌微胶囊化制备方法的研究[D]. 大连:大连理工大学,2009:23-30.
[15]孟宪军,赵婧,李斌. 正交实验优化树莓花色苷的微胶囊化工艺[J]. 食品科学,2013,34(14):173-177.
[16]张帆,赵敏,李来酉,等.双歧杆菌冻干菌粉制备工艺的研究[J].食品科学,2010,31(15):221-224.
[17]全国文献工作标准化技术委员会第七分委员会 GB 4789.15-2010 中国标准书号[S]. 北京:中国标准出版社,2010.
[18]熊涛,廖良坤,黄涛,等. 植物乳杆菌NCU116菌剂的喷雾干燥制备[J]. 食品与发酵工业,2015,41(8):23-29.
[19]韩丹. 微藻油微胶囊制备及贮藏稳定性研究[D]. 南昌:南昌大学,2010:25-35.
[20]Xing Y,Xu Q,Jiang L,et al. Effect of different coating materials on the biological characteristics and stability of microencapsulatedLactobacillusacidophilus[J]. Rsc Advances,2015,5(29):22825-22837.
[21]海金萍,刘钰娜,邱松山. 三华李果酒发酵工艺的优化及香气成分分析[J]. 食品科学,2016,37(23):222-229.
[22]于立梅,刘俊梅,冯卫华,等. 催陈方式对山竹果酒理化特性和香气成分的影响[J]. 现代食品科技,2013,29(10):2442-2446.
[23]杨文娟,朱敏莉,齐智涛,等. 壳聚糖/海藻酸盐微胶囊固定化酿酒酵母生产乙醇[J]. 食品与发酵工业,2009(8):25-29.
[24]郭立华. 玉米醇溶蛋白微胶囊的制备及性质研究[D]. 天津:天津科技大学,2012:16-25.
[25]谭龙飞,文毓,黄永杰,等. 以壳聚糖、麦芽糊精和蔗糖为壁材制备肉桂醛微胶囊[J]. 食品科学,2006,27(1):115-118.
[26]刘会平,马丽,戴广丽,等. 利用响应面法优化鼠李糖乳杆菌TUST006冷冻干燥保护剂[J]. 现代食品科技,2010,26(9):975-978.

