大鼠缺血性脑卒中脑皮层蛋白质组学分析
张笑笑 徐 威 金 巍 陈 静 刘明丽 任传成
(复旦大学附属上海市第五人民医院神经内科 上海 200240)
缺血性脑卒中(ischemic cerebral stroke,ICS)是一种常见的脑血管疾病,具有发病率高、致死率高及致残率高的特点。我国每年新增约250万脑卒中患者,其中ICS患者接近70%[1]。重组组织型纤溶酶原激活物(rt-PA)是急性ICS最有效的治疗药物[2]。然而,这种溶栓药物存在严格的治疗时间窗限制,仅有少数ICS患者能得到有效的治疗[3]。ICS的临床诊断主要借助CT和MRI,但影像学诊断并非绝对可靠,所以有必要寻找ICS生物标志物协助早期诊断。
蛋白质组学作为一种高通量筛选鉴定蛋白质的技术,为寻找ICS生物标志物提供了新的可能。虽然,脑卒中领域蛋白质组学的研究已经有多篇文献报道,但是脑缺血后脑皮层蛋白质组的表达变化研究甚少。本研究首次采用串联质谱标签(tandem mass tag,TMT)标记技术结合液相色谱串联质谱,探讨大鼠ICS后脑皮层蛋白质的动态表达变化,旨在通过定量蛋白质组学方法深入揭示脑缺血对皮层蛋白质表达变化的影响,为寻找ICS生物标志物及进一步阐明ICS的病理生理机制提供理论基础。
材 料 和 方 法
实验动物及分组42只清洁级成年雄性SD大鼠,体重280~330 g,由上海兽医研究所提供及饲养。分为假手术组(sham组,n=12)和脑缺血组(ICS组,n=30),ICS组按照缺血时间不同进一步分为缺血1、6、24、48 h (表1)。动物饲养及手术按照复旦大学动物伦理委员会实验动物规范执行。
模型构建及取材采用异氟烷麻醉,大鼠置于操作台上,行颈部正中切口并分离双侧颈总动脉,穿线待用。切开左侧颞部肌肉并磨去部分颞骨,在体视显微镜下用注射器针头挑开脑膜并暴露大脑中动脉。使用动脉夹夹闭双侧颈总动脉,电凝左侧大脑中动脉,双侧颈总动脉夹闭30 min后松开动脉夹。缝合手术切口,并于缺血后1、6、24、48 h处死大鼠,取左侧脑皮层组织。Sham组的大鼠进行双侧颈总动脉及大脑中动脉的分离,但不进行夹闭和电凝栓塞,并于术后48 h取脑皮层组织。将以上脑组织样品保存于-80 ℃,用于后续实验。
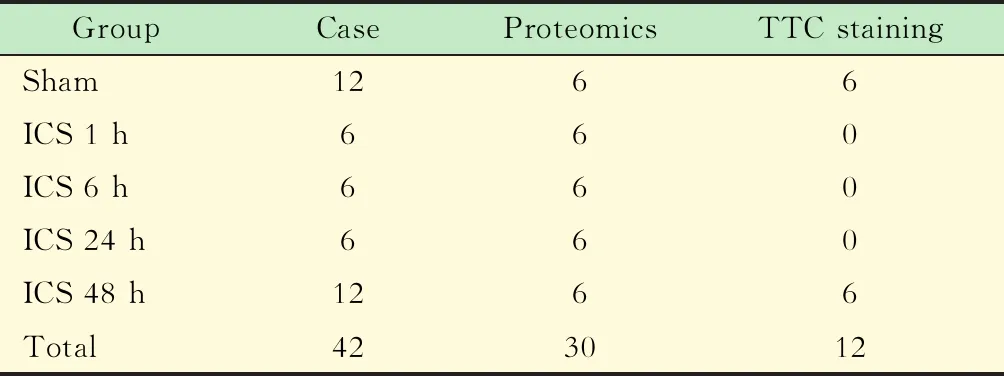
表1 实验动物分组情况Tab 1 Grouping of experimental animals (n)
TTC染色取sham组和ICS 48 h组的大鼠,水合氯醛腹腔注射麻醉,于左心室灌入500 mL生理盐水,断头取脑,于脑片槽中制成2 mm冠状切片。将脑冠状快速切片置于1% TTC 染液中,避光孵育30 min,置于多聚甲醛中固定20 min,用扫描仪对固定后的切片进行扫描。
Westernblot实验取等量脑组织加入含有蛋白酶抑制剂和磷酸酯酶抑制剂的RIPA裂解液中裂解,匀浆提取蛋白质,BCA法测定蛋白质浓度,SDS-聚丙烯酰胺凝胶电泳后将蛋白质转移到PVDF膜上,用5% 脱脂牛奶封闭2 h,加入兔抗-热休克蛋白27 (heat shock protein 27,HSP27)的抗体(1∶1 000,英国Abcam公司),4 ℃孵育过夜,加入HRP标记的山羊抗兔IgG (1∶4 000,美国Santa Cruz Biotechnology公司),4 ℃孵育2 h,加入发光液显影,在Bio-Rad自动凝胶成像系统中拍照,以β-actin为内参。
蛋白质组学分析每组脑组织样品取100μg进行还原,烷基化,胰蛋白酶酶解,TMT试剂标记,采用液相色谱串联质谱分析进行蛋白质的分离鉴定。原始文件采用MaxQuant 1.5.2.8软件在Uniprot rat蛋白质数据库进行搜索,用MaxQuant软件自带算法鉴定多肽及蛋白质,并给出TMT定量信息。肽和蛋白质误差设置为0.1。采用DAVID(https://david.ncifcrf.gov/)对蛋白质进行生物信息学分析。

结 果
脑组织TTC染色选择ICS 48 h组的原因是脑缺血48 h后脑TTC染色最稳定。TTC染色结果显示大鼠ICS模型建造成功(图1)。
质谱结果分析将4个时间点的ICS组分别与sham组比较,共获得25个差异表达的蛋白质。这25个蛋白质满足以下条件:所有时间点ICS组与sham差异均有统计学意义(P<0.05),且至少1个时间点的表达倍数大于5 (表2)。

A:Sham group;B:ICS 48 h group.White indicates infarction zone;red indicates normal tissue.No ischemic lesion was observed in the sham group.Arrowhead showed left cerebral cortex tissue.
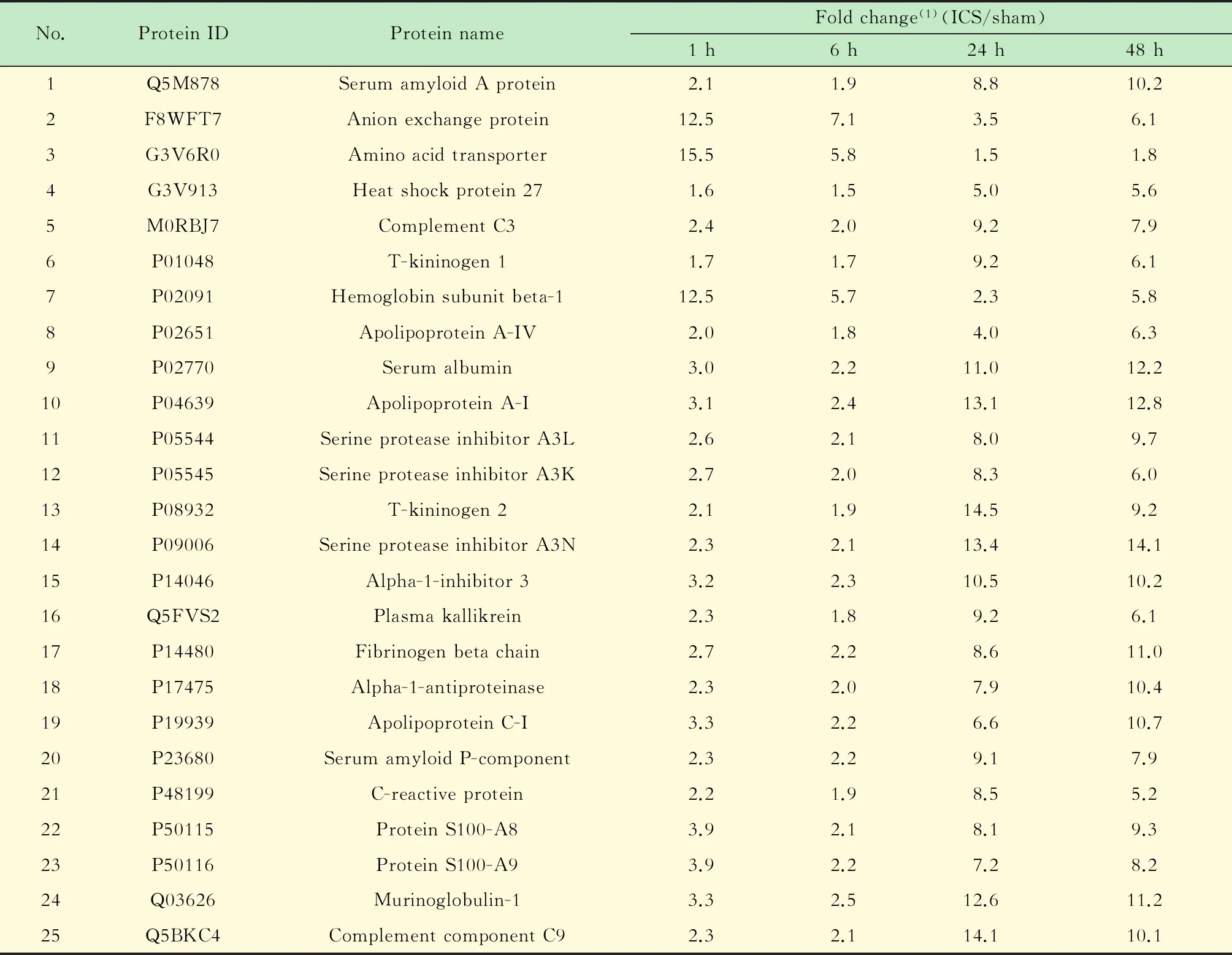
图1 大鼠脑皮层组织TTC染色图Fig 1 TTC staining image of brain cortex tissues in rats
Two-group comparison was analyzed byttest.(1)ICS groupvs.sham group,P<0.05.
色谱图和质谱图分析HSP27和补体C3的色谱图显示基峰窄、时间短,提示色谱分离蛋白质的效果较好(图2A、B)。HSP27和补体C3的质谱图显示肽段b离子和y离子信息丰富,提示质谱鉴定蛋白质的效果较好(图2C、D)。
生物信息学分析对25个差异表达的蛋白质进行Gene Ontology富集分析,按照蛋白质参与的生物学过程分类(图3A),差异表达的蛋白质主要富集在急性期反应(P<0.001)、炎症反应(P<0.001)、脂蛋白代谢过程(P<0.001)、补体激活经典途径(P=0.001)和固有免疫反应(P=0.005);按照蛋白质所属的细胞组分分类(图3B),差异表达的蛋白质主要富集在细胞外隙(P<0.001)、细胞外泌体(P<0.001)、胞外区(P<0.001)、细胞表面(P=0.007)和细胞外基质(P=0.042)。

A:Base peak of HSP27;B:Base peak of complement C3;C:MS/MS of HSP27;D:MS/MS of complement C3.
图2HSP27和补体C3的基峰及质谱分析
Fig2BasepeakandMS/MSofHSP27andcomplementC3

图3 25个差异表达蛋白质的生物信息学分析Fig 3 Bioinformatics analysis of 25 differentially expressed proteins
急性期反应相关的蛋白质包括C反应蛋白(C-reactive protein,CRP)、T-kininogen 1、T-kininogen 2、血清淀粉样蛋白A (serum amyloid A protein,SAA)、α-1抗蛋白酶(α-1-antiproteinase)和murinoglobulin-1;炎症反应相关的蛋白质包括S100-A8、激肽释放酶、α-1抗蛋白酶、T-kininogen 1、murinoglobulin-1、α-1抑制因子3、丝氨酸蛋白酶抑制剂A3N和补体C3;脂蛋白代谢相关的蛋白质包括载脂蛋白C-Ⅰ (apolipoprotein C-Ⅰ,Apo C-Ⅰ)、Apo A-Ⅳ和Apo A-Ⅰ;补体激活经典途径相关的蛋白质包括CRP、补体C3及补体C9;固有免疫反应相关的蛋白质包括S100-A8、S100-A9、血清淀粉样P物质和纤维蛋白原β链。
Westernblot检测为了验证定量蛋白质组学的结果,我们挑选HSP27进行Western blot实验。根据文献报道,生理状态下HSP27在脑组织中低表达,但在缺血条件下HSP27可迅速诱导表达,具有较高的灵敏性[4]。Western blot结果显示,与sham组比较,脑缺血后1、6、24和48 h,HSP27的表达均显著升高,分别是sham组的1.7、1.5、2.1和3.3倍(P<0.05,图4)。HSP27的表达变化与定量蛋白质组学的结果基本一致。
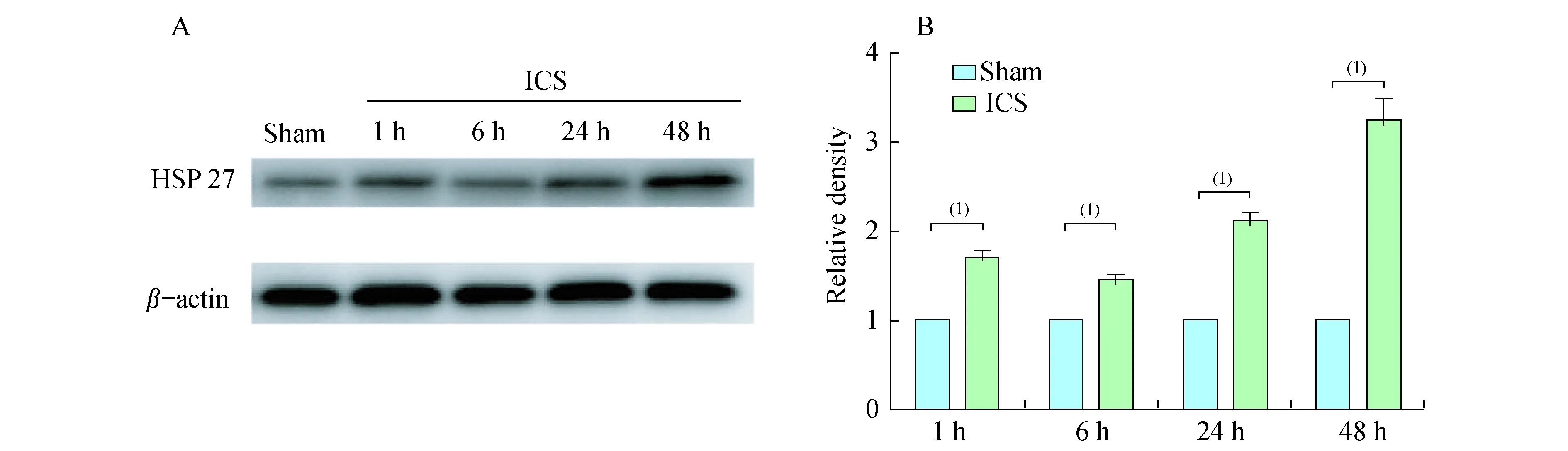
A:Expression change of HSP27 after cerebral ischemia;B:Relative density of HSP27 normalized to β-actin.(1)vs.sham group,P<0.05.
图4Westernblot验证定量蛋白组学的结果
Fig4ValidationofquantitativeproteomicsresultsbyWesternblot
讨 论
通过对脑皮层蛋白质组的研究,我们鉴定到25个脑缺血后显著变化的蛋白质,利用生物信息学分析将其分为5类。第1类为急性期反应相关的蛋白质。CRP作为急性期反应的特征,也是炎症反应的血液标志物。Zhang等[5]研究发现大鼠脑缺血后血浆CRP的水平显著升高。一项临床试验表明急性ICS患者预后与血浆CRP水平呈正相关[6]。T-kininogen 1和T-kininogen 2是血清糖蛋白,为缓激肽的前体,缓激肽通过与其受体结合,激活缓激肽-激肽系统,参与脑缺血后神经组织损伤[7]。SAA是一种多功能的急性期蛋白质,参与血小板聚集和黏附,促进血栓形成[8]。SAA被报道可能作为动脉粥样硬化性ICS的诊断依据[9]。Sezer等[10]发现急性ICS患者的血清SAA水平与疾病的严重程度相关。本研究也发现脑缺血后上述蛋白质的表达发生了显著变化,由此推测这些蛋白质在脑缺血损伤中发挥重要作用。murinoglobulin-1具有肽酶抑制活性,在脑缺血领域尚无文献报道,值得进一步探讨。
第2类为炎症反应相关的蛋白质。S100-A8又称骨髓相关蛋白8 (Mrp8),参与调节炎症反应。动物实验表明,Mrp8可能通过与Toll样受体结合,介导神经炎症,参与脑缺血再灌注损伤[11]。α-1抗蛋白酶又称 α-1抗胰蛋白酶,是一种保守的丝氨酸蛋白酶抑制剂。基础研究发现,α-1抗蛋白酶在肾缺血再灌注损伤中发挥抗炎和抗凋亡的作用[12]。激肽释放酶是激肽释放酶-激肽系统的主要限速酶,该系统对于调节脑缺血及创伤性脑损伤后炎症反应和水肿形成具有十分重要的意义[13]。本研究同样发现上述蛋白质在脑缺血后发生了明显变化,提示这些炎症反应相关的蛋白质与脑缺血损伤密切相关。α-1抑制因子3和丝氨酸蛋白酶抑制剂A3N在脑缺血中的作用尚不明确,有待进一步研究。
第3类为脂蛋白代谢过程相关的蛋白质。本研究共发现3种Apo在脑缺血后发生了变化。Apo A-Ⅰ参与胆固醇的反向转运,可能成为临床ICS诊断的血液标志物[14]。Apo C-Ⅰ可能作为区分ICS和出血性脑卒中的血浆指标[15]。Apo A-Ⅳ在脑卒中领域尚无相关研究。由此提示脂蛋白代谢可能参与脑缺血损伤过程。
第4类为补体激活经典途径相关的蛋白质。本研究发现补体 C3和C9的表达都发生了显著变化,提示脑缺血过程中发生了补体系统的激活。补体激活有3种途径:经典途径、替代途径和甘露糖结合凝集素途径。补体C3作为这3种途径的交集,参与小鼠脑缺血再灌注损伤[16]。一项新生儿缺血缺氧性脑病(hypoxic-ischemic encephalopathy,HIE)的研究发现,补体C9在神经元大量沉积,提示补体激活经典途径参与HIE的发病[17]。综上所述,补体激活经典途径的激活与脑缺血损伤密切相关。
第5类为固有免疫反应相关的蛋白质。S100-A8和S100-A9是钙离子结合蛋白,除介导炎症反应外,在固有免疫反应的调节中也具有十分重要的意义。动物实验研究表明,S100-A8和S100-A9通过调节巨噬细胞的免疫学功能来维持胃肠道的稳态[18]。血清淀粉样P物质广泛存在于脊椎动物,与机体淀粉样病变有关。纤维蛋白原β链的具体功能尚不明确。
除了上述提及的蛋白质,本研究还发现HSP27、血清白蛋白,阴离子交换蛋白、氨基酸转运体、丝氨酸蛋白酶抑制剂A3L和丝氨酸蛋白酶抑制剂3K的表达发生了明显变化。白蛋白是血浆中最主要的蛋白质,参与维持血浆胶体渗透压。临床试验表明,白蛋白可能作为急性ICS患者神经功能持续恶化的危险因素[19]。HSP27是一种高度保守的分子伴侣蛋白,参与脑缺血后的神经保护,包括缓解皮层损伤[20]及抑制血脑屏障崩解[21],被认为是一个新的脑缺血治疗靶点。本研究发现HSP27在脑缺血后显著升高,提示HSP27在脑缺血损伤中发挥重要的作用。阴离子交换蛋白参与哺乳动物细胞Cl-/HCO3-的跨膜交换,但是其在脑缺血损伤中的作用尚无报道。氨基酸转运体和丝氨酸蛋白酶抑制剂A3L/3K在脑缺血中的重要性也尚不清楚。这些蛋白质在脑缺血中的意义还需进一步研究。
我们借助蛋白质组学方法获得25个潜在的ICS生物标志物,为ICS的早期诊断及进一步阐明ICS的病理生理机制提供了理论基础,但是未来还需要大量临床研究进一步验证。
[1]LIU L,WANG D,WONG KS,etal.Stroke and stroke care in China:huge burden,significant workload,and a national priority[J].Stroke,2011,42(12):3651-3654.
[2]JAUCH EC,SAVER JL,ADAMS HJ,etal.Guidelines for the early management of patients with acute ischemic stroke:a guideline for healthcare professionals from the American Heart Association/American Stroke Association[J].Stroke,2013,44(3):870-947.
[3]XU AD,WANG YJ,WANG DZ.Consensus statement on the use of intravenous recombinant tissue plasminogen activator to treat acute ischemic stroke by the Chinese Stroke Therapy Expert Panel[J].CNSNeurosciTher,2013,19(8):543-548.
[4]STETLER RA,GAN Y,ZHANG W,etal.Heat shock proteins:cellular and molecular mechanisms in the central nervous system[J].ProgNeurobiol,2010,92(2):184-211.
[5]ZHANG J,RUI YC,YANG PY,etal.C-reactive protein induced expression of adhesion molecules in cultured cerebral microvascular endothelial cells[J].LifeSci,2006,78(26):2983-2988.
[6]SAHAN M,SEBE A,ACIKALIN A,etal.Acute-phase reactants and cytokines in ischemic stroke:do they have any relationship with short-term mortality?[J].EurRevMedPharmacolSci,2013,17(20):2773-2777.
[7]GROGER M,LEBESGUE D,PRUNEAU D,etal.Release of bradykinin and expression of kinin B2 receptors in the brain:role for cell death and brain edema formation after focal cerebral ischemia in mice[J].JCerebBloodFlowMetab,2005,25(8):978-989.
[8]MEEK RL,URIELI-SHOVAL S,BENDITT EP.Expression of apolipoprotein serum amyloid A mRNA in human atherosclerotic lesions and cultured vascular cells:implications for serum amyloid A function[J].ProcNatlAcadSciUSA,1994,91(8):3186-3190.
[9]BREA D,SOBRINO T,BLANCO M,etal.Usefulness of haptoglobin and serum amyloid A proteins as biomarkers for atherothrombotic ischemic stroke diagnosis confirmation[J].Atherosclerosis,2009,205(2):561-567.
[10]SEZER S,UCAR F,ULUSOY EK,etal.Serum amyloid A,fetuin-A,and pentraxin-3 levels in patients with ischemic stroke:novel prognostic biomarkers?[J].TurkJMedSci,2014,44(1):16-23.
[11]ZIEGLER G,PRINZ V,ALBRECHT MW,etal.Mrp-8 and -14 mediate CNS injury in focal cerebral ischemia[J].BiochimBiophysActa,2009,1792(12):1198-1204.
[12]DAEMEN MA,HEEMSKERK VH,VAN′T VC,etal.Functional protection by acute phase proteins alpha(1)-acid glycoprotein and alpha(1)-antitrypsin against ischemia/reperfusion injury by preventing apoptosis and inflammation[J].Circulation,2000,102(12):1420-1426.
[13]ALBERT-WEISSENBERGER C,SIREN AL,KLEIN-SCHNITZ C.Ischemic stroke and traumatic brain injury:the role of the kallikrein-kinin system[J].ProgNeurobiol,2013,101-102:65-82.
[14]WALSH KB,HART K,ROLL S,etal.Apolipoprotein A-I and paraoxonase-1 are potential blood biomarkers for ischemic stroke diagnosis[J].JStrokeCerebrovascDis,2016,25(6):1360-1365.
[15]ALLARD L,LESCUYER P,BURGESS J,etal.Apo C-Ⅰ and Apo C-Ⅲ as potential plasmatic markers to distinguish between ischemic and hemorrhagic stroke[J].Proteomics,2004,4(8):2242-2251.
[16]YANG J,AHN HN,CHANG M,etal.Complement component 3 inhibition by an antioxidant is neuroprotective after cerebral ischemia and reperfusion in mice[J].JNeurochem,2013,124(4):523-535.
[17]SCHULTZ SJ,ALY H,HASANEN BM,etal.Complement component 9 activation,consumption,and neuronal deposition in the post-hypoxic-ischemic central nervous system of human newborn infants[J].NeurosciLett,2005,378(1):1-6.
[18]OKADA K,ARAI S,NAKASE H,etal.Autocrine pathways involving S100A8 and/or S100A9 that are postulated to regulate the immunological functions of macrophages in rats[J].BiochemBiophysResCommun,2015,456(1):415-420.
[19]LIN LC,LEE TH,CHANG CH,etal.Predictors of clinical deterioration during hospitalization following acute ischemic stroke[J].EurNeurol,2012,67(3):186-192.
[20]VAN DER WEERD L,TARIQ AM,ARON BR,etal.Overexpression of heat shock protein 27 reduces cortical damage after cerebral ischemia[J].JCerebBloodFlowMetab,2010,30(4):849-856.
[21]SHI Y,JIANG X,ZHANG L,etal.Endothelium-targeted overexpression of heat shock protein 27 ameliorates blood-brain barrier disruption after ischemic brain injury[J].ProcNatlAcadSciUSA,2017,114(7):E1243-E1252.

