低强度脉冲超声对兔桡骨骨折愈合及小窝蛋白-1基因表达的影响
李 蕴 刘邦忠 刘光华 顾文钦 肖 峰 吴一鸣 高正东 钟宗烨
(1复旦大学附属中山医院康复医学科 上海 200032;2上海市第七人民医院病理科 上海 200137;3 上海市徐汇区枫林街道社区卫生服务中心放射科 上海 200030)
骨科康复研究的热点和难点在于促进骨折修复,缩短愈合时间,促使已经发生的延迟愈合和不愈合重新愈合。物理因子治疗被视为重要的干预手段之一。大量体内外实验证实了低强度脉冲超声(low-intensity pulsed ultrasound,LIPUS)治疗骨折的有效性。LIPUS治疗骨折的最佳参数为:超声频率1.5 MHz,强度30 mW/cm2,占空比20%,脉冲频率1 kHz,每日1次,每次20 min。美国FDA分别于1994年及2000年批准将其用于治疗新鲜骨折、骨折延迟愈合及骨不连[1]。
LIPUS促进骨折愈合的作用机制尚不清楚。 骨折愈合是一个复杂的生物学过程,涉及到多种细胞及信号分子的改变。小窝蛋白-1(caveolin-1)是细胞膜表面特殊膜结构小窝(caveolae)的重要结构蛋白质之一,它可通过与信号分子的结合调节相应的信号转导过程[2]。骨折后早期小窝蛋白-1的表达增高[3],但其在LIPUS治疗骨折过程中的表达规律还未被证实。本研究旨在通过影像学和组织学检测明确LIPUS对长管状骨骨折愈合的影响,并检测经LIPUS干预后骨折部位小窝蛋白-1的定位、表达及软骨和骨特异基因的表达,探讨小窝蛋白-1在LIPUS治疗骨折过程中的作用,从而为阐明LIPUS促进骨折愈合的作用机制提供依据。
材 料 和 方 法
实验动物健康雄性新西兰白兔24只,3月龄,体重2.0~2.5 kg,普通级,购自上海生旺实验动物养殖有限公司。实验动物分笼饲养于复旦大学实验动物科学部,全价营养颗粒饲料喂养,自由饮水,室温控制在(20±2)℃,湿度60%,12 h/12 h间隔照明。
仪器设备低能量骨折愈合仪(日本伊藤超短波株式会社),数字化拍片系统(日本岛津制作所),组织切片机(德国Leica公司),全自动免疫组化预处理系统和全自动免疫组化染色系统(丹麦Dako公司),光学显微镜(日本奥林巴斯株式会社),实时荧光定量PCR仪(德国Eppendorf公司)。
主要试剂4%多聚甲醛溶液(武汉谷歌生物科技有限公司),小窝蛋白-1小鼠单克隆抗体(美国 BD公司),二抗检测系统(丹麦Dako公司),Trizol试剂(美国Sigma公司),逆转录试剂盒和qPCR试剂盒(日本TAKARA公司)。
动物模型的建立选取体重相近的健康雄性新西兰白兔24只,适应性饲养1周后,采用3%戊巴比妥钠(1 mL/kg)经耳缘静脉麻醉,双侧术野处剪毛,75%酒精、活力碘消毒,取双前肢外侧切口,分离周围肌肉及血管,暴露桡骨中段,注意保护桡动、静脉,切开并剥离骨膜,使用骨锯造成桡骨中下1/3处宽为3 mm的横行骨缺损,深达髓腔的2/3。止血、清创,不予固定,逐层缝合切口。在无菌条件下进行手术,双侧实验方法相同。术后连续3天肌肉注射40万单位青霉素钠,每日1次。术后所有实验动物分笼饲养,自由活动、进食。
LIPUS干预造模后第2天开始,对实验动物右侧骨折处备皮并行LIPUS刺激。于超声探头表面均匀涂抹专用耦合剂,弹性绑带固定在右前肢骨折处后开启开关,强度为30 mW/cm2,频率为1.5 MHz,占空比为20%,重复频率为1 KHz,每天1次,每次治疗20 min。左侧作为对照,同时行切断电源的假刺激。
动物处理每组动物分别在超声干预的第7、14、21、28天于治疗结束后耳缘静脉给予3%戊巴比妥钠(0.6 mL/kg)镇定,进行X线摄片,随即心内注射空气处死,在无菌状态下截取双侧桡骨骨痂组织,用DEPC水处理过的生理盐水彻底冲洗后纵行劈开平均分成两部分:一半组织迅速置于无酶冻存管内用液氮速冻,随后转入-80 ℃冰箱保存;另一半组织置入4%多聚甲醛溶液(pH=7.4)中。
X线摄片将麻醉镇静的新西兰白兔侧卧位摆放于数字化拍片系统检查床上,拍摄双前肢正位片。摄片工作由指定放射科技师完成,摄片条件:管电压56 kV,管电流400 mA,曝光时间110 ms,球管距动物的距离110 cm。所有入组动物摄片结束后,由3位对分组情况不知情的实验人员统一阅片,并行X线评分。X线评分标准依据文献报道[4]:骨折未愈合记为0分,有明显的骨痂形成但骨缺损尚未形成桥接记为1分,有明显的骨痂形成且骨缺损部位形成可能桥接记为2分,骨折愈合记为3分。所得图像在万达区域PACS影像工作站进行刻度校准,使得实物与图像为1∶1的比例关系,应用Image-Pro Plus 6.0软件进行矿化骨痂的圈定,得到像素面积,随后根据其与整幅图像像素面积之比计算出实际骨痂面积。
HE染色将固定好的骨痂组织转入质量分数为30%的盐酸-多聚甲醛溶液脱钙3~6天,每24 h更换脱钙液。脱钙成功后,梯度乙醇脱水,二甲苯透明,组织浸蜡,纵向石蜡包埋,切片,厚度为3μm。对切片行常规脱蜡,分别移至无水乙醇和95%乙醇中各1 min,自来水冲洗后,将切片移至苏木精染液内静置7~10 min。自来水冲洗后在盐酸乙醇内分化数秒,水洗反蓝,移到l%伊红-乙醇溶液内,对比染色1 min。在95%乙醇Ⅰ、Ⅱ及无水乙醇Ⅰ、Ⅱ中分别脱水30 s,再经二甲苯Ⅰ、Ⅱ、Ⅲ完全透明各30 s,最后在盖玻片下以光学树脂胶封片。光学显微镜下观察骨折愈合的组织病理学变化。
免疫组化染色取石蜡切片用过二甲苯脱蜡3次,每次10 min;100%、90%、80%乙醇梯度水化,每次1 min,蒸馏水漂洗,置于TBST缓冲液中。将切片浸入Tris-EDTA缓冲液(pH=9.0),用全自动免疫组化预处理系统进行抗原修复(95 ℃、17 min),TBST缓冲液中自然冷却10 min。滴加工作浓度为1∶100的小窝蛋白-1一抗于切片上,室温45 min孵育;TBST冲洗,滴加10% H2O2溶液,室温下孵育5 min;TBST冲洗,滴加二抗,室温下孵育20~30 min;TBST冲洗,滴加DAB溶液,镜下观察显色结果,阳性为棕褐色,待阳性部位出现特异性显色而背景无着色时,用自来水冲洗终止显色,苏木精复染,脱水,封片。每张免疫组化切片随机选取3个不重叠视野(×400),在光学显微镜下拍照,使用Image-Pro Plus 6.0软件测量积分吸光度(D),并计算平均值。
实时荧光定量PCR检测称取200 mg于-80 ℃冰箱保存的骨痂组织,置入研钵使用液氮均匀研磨,将组织粉末转入预冷的无酶1.5 mL EP管内,加入1 mL Trizol,使用多样品组织研磨机匀浆,室温放置5 min,充分裂解。加入200μL氯仿,混匀,室温放置3 min。4 ℃、12 000×g离心15 min。尽可能完全吸取上层水相,置于另一1.5 mL EP管中。加入0.5 mL异丙醇,颠倒,室温静置10 min。4 ℃、12 000×g离心10 min,弃上清,RNA沉于管底,室温晾干5~10 min。加入50μL DEPC水溶解RNA样品,使用超微量微孔板分光光度计测定RNA浓度,按照逆转录试剂盒的操作指导将RNA逆转录为cDNA,随后以SYBR Green为荧光染料,进行qPCR检测,每个样品的每个基因设置3个复孔。所用引物由上海启因生物科技有限公司根据NCBI的mRNA序列设计并合成(表 1),数据采用2-ΔΔCt法分析。

结 果
X线表现LIPUS干预7天后,双侧骨折线较清晰,无明显骨痂形成。第14天时,双侧骨折线开始模糊,实验侧骨膜反应较强,形成的骨痂较对照侧明显,且骨缺损部位大部分被新生骨痂充填。第21天时,对照侧骨缺损部位有明显的骨痂形成,但实验侧骨痂含量仍显著多于对照侧,骨缺损部位完全被新生骨痂充填并可能形成桥接。治疗28天后,实验侧骨痂面积显著大于对照侧,骨皮质连续性也基本恢复,对照侧尚未形成完全的骨性桥接(图 1A)。

表 1 目的基因引物序列Tab 1 The primer sequence of target genes

A:Radiographs;B:Radiographic score;C:Mineralized callus area.vs.Control,(1)P<0.05,(2)P<0.01,(3)P<0.001.
图1术后各时间点兔桡骨的影像学改变
Fig1Radiologicalchangesintheradiusofrabbitsatdifferenttimepointsafterthesurgery
X线评分LIPUS干预7天后,双侧桡骨均无明显骨折愈合证据。第14天,实验侧X线评分显著高于对照侧(P=0.017),第21、28天实验侧X线评分显著高于对照侧(P均为0.005)。双侧桡骨X线评分均随治疗时间延长而升高,各时间点间差异有统计学意义(P均<0.001,图 1B)。
矿化骨痂面积术后第7天,双侧桡骨均无明显矿化骨痂生成,自第14天起,矿化骨痂面积迅速增加,实验侧显著大于对照侧(14天:P=0.003;21天:P<0.001;28天:P=0.004)。 双侧桡骨矿化骨痂面积总体呈逐渐增加的趋势,不同时间点间矿化骨痂面积差异有统计学意义(P均<0.001,图 1C)。
组织学观察造模后第7天,对照侧仍存在一定量的纤维肉芽组织,并可见由骨折断端间充质细胞分化而来的幼稚的软骨细胞大量增殖;实验侧软骨细胞持续增殖并逐渐向肥大软骨细胞分化,出现大片软骨岛。治疗14天后,对照侧软骨细胞持续大量增殖、分化,形成软骨基质,少数软骨细胞凋亡,来自骨外膜的破骨细胞侵入并溶解吸收钙化的软骨基质,间充质细胞分化为成骨细胞,在残存的软骨基质表面成骨,开始形成原始骨小梁;实验侧软骨细胞肥大、退变,软骨基质钙化,骨小梁粗而长,可见成骨细胞、破骨细胞沿骨小梁排布。第21天,对照侧软骨细胞开始退化、凋亡,软骨内成骨普遍,骨小梁相互连接成网;实验侧大量软骨细胞退化、死亡,破骨细胞多见,骨小梁呈编织样。治疗28天后,对照侧软骨细胞逐渐退化,软骨基质钙化明显,骨小梁接连成片;实验侧编织骨逐渐向板层骨过渡,骨小梁内可见较多成熟的骨细胞(图 2)。
小窝蛋白-1免疫组化染色造模后第7天,骨折部位小窝蛋白-1多定位于软骨细胞核,实验侧骨折部位软骨细胞小窝蛋白-1水平明显高于对照侧(P=0.002)。14天后,双侧桡骨骨折部位小窝蛋白-1水平均有明显增高,主要定位于肥大软骨细胞膜及间充质细胞,实验侧小窝蛋白-1水平显著高于对照侧(P<0.001)。第21天,伴随软骨细胞的退变、凋亡,软骨细胞的小窝蛋白-1水平降低;间充质细胞迁移至软骨基质表面并逐渐向成骨细胞分化,小窝蛋白-1水平随之降低,且实验侧显著低于对照侧(P=0.001)。治疗28天后,软骨细胞逐渐退化、凋亡,小窝蛋白-1水平很低;大量间充质细胞分化为成骨细胞成骨,小窝蛋白-1水平下降,实验侧显著低于对照侧(P=0.017,图 3)。在骨折愈合过程中,小窝蛋白-1水平呈现先上升后下降的规律,不同时间点小窝蛋白-1水平差异有统计学意义(对照侧:P<0.001,实验侧:P<0.001,图 4)。
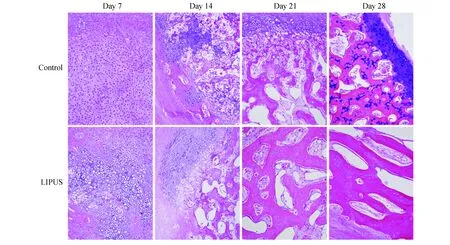
图 2 术后各时间点兔桡骨骨折部位组织学改变(HE染色,×100)Fig 2 Histological changes in radius fracture sites of rabbits at different time points after the surgery (HE staining,×100)
实时荧光定量PCR结果显示(图5):术后7、14天,小窝蛋白-1基因表达增加,且第7天时实验侧显著高于对照侧(P=0.028);术后21、28天,小窝蛋白-1基因表达降低,实验侧表达水平反而低于对照侧,与21天时相比差异有统计学意义(P<0.001)。在骨折愈合过程中随时间的延长Col2a1基
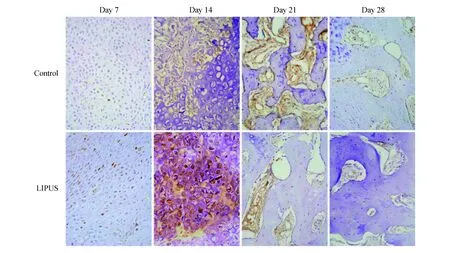
图3 术后各时间点兔桡骨骨折部位小窝蛋白-1的免疫组化染色(HE染色,×200)Fig 3 Immunohistochemistry of caveolin-1 in radius fracture sites of rabbits at different time points after the surgery (HE staining,×200)

vs.Control,(1)P<0.05,(2)P<0.01,(3)P<0.001.
图4术后各时间点兔桡骨骨折部位小窝蛋白-1水平
Fig4Caveolin-1levelsinradiusfracturesitesofrabbitsatdifferenttimepointsafterthesurgery
因相对表达量下降,术后7、14天实验侧表达均显著高于对照侧(P=0.002,P=0.03);术后21、28天,实验侧表达显著低于对照侧(P=0.025,P=0.006)。术后7、14天,Col10a1表达增加,实验侧显著高于对照侧(P均为0.01);此后表达下降,21天时实验侧显著低于对照侧(P=0.031)。术后7、14天,骨钙蛋白基因表达增加,实验侧显著高于对照侧(P=0.001,P=0.012),第21、28天时表达下降,实验侧显著低于对照侧(P均为0.003)。
讨 论
促进软骨内成骨是LIPUS加速长管状骨骨折愈合的重要机制研究证实LIPUS加速骨痂的形成,骨痂面积显著增加[5]。长管状骨骨折后软骨痂以软骨成分为主,软骨内成骨在其骨折修复中扮演重要角色[6]。组织学观察发现LIPUS干预使软骨内成骨、硬骨痂桥接等提前出现[7];体外实验也证实LIPUS可以促进间充质细胞向软骨细胞分化,促进软骨细胞的增殖、分化,影响软骨基质的形成[8-9]。本研究发现:实验侧矿化骨痂、骨性桥接出现的时间较对照侧早,自第14天开始,实验侧X线评分、矿化骨痂面积均显著高于对照侧;组织学结果也表明,实验侧骨痂组织软骨细胞在前14天更多、更成熟,软骨基质钙化、软骨细胞凋亡以及原始骨小梁出现的时间点较早,这与既往研究结果一致。
软骨及骨特异基因的表达情况同样验证了LIPUS的促成骨效应。软骨细胞的程序性分化是软骨内成骨的重要环节之一,是幼稚的增殖性软骨细胞向成熟的肥大软骨细胞的转变过程。软骨细胞在早期分化增殖过程中会产生包括Ⅱ型胶原在内的大量基质蛋白,而在肥大化的过程中可以分泌Ⅹ型胶原,因此Col2a1及Col10a1分别被认为是软骨细胞增殖及肥大的标志基因[10]。本实验中软骨特异基因的表达规律说明:造模后形成的骨痂内,增殖性软骨细胞数量在各时间点呈现逐渐下降的趋势,软骨细胞经历逐渐肥大化随后凋亡的过程。术后第7、14天,超声治疗侧骨痂内上述两基因的表达明显高于对照侧,说明超声刺激促进了骨痂内部软骨细胞的增殖分化进程。第21天开始,上述两基因在实验侧的表达低于对照侧,这可能与软骨细胞提前分化进入终末期并发生凋亡有关。骨钙蛋白是由成骨细胞合成并分泌的一种非胶原骨蛋白,可以反映成骨细胞的活性,其表达随成骨细胞的分化而增加,并随其转变为骨细胞而下降[11]。本研究发现:术后第7、14天,在LIPUS刺激下成骨细胞分化程度增高;随后,成骨细胞分泌类骨质并逐渐向骨细胞转变,实验侧的成熟骨细胞较对照侧多,因此可以解释第21、28天实验侧骨钙蛋白表达水平低于对照侧。已知膜内成骨稍快于软骨内成骨并共同参与骨折部位原始骨痂的形成,本研究中qPCR实验测得的骨钙蛋白来自参与上述两过程的成骨细胞,这也是前2周骨钙蛋白表达先增加后下降的原因之一。结合组织学观察结果,可以认为LIPUS能够促进骨折愈合过程中成骨细胞的活性及其分化成熟。

vs.Control,(1)P<0.05,(2)P<0.01,(3)P<0.001.The data represents at least 3 independent experiments.
图5术后各时间点小窝蛋白-1(A),Col2a1(B),Col10a1(C)及骨钙蛋白(D)的mRNA相对水平
Fig5TherelativemRNAlevelofcaveolin-1(A),Col2a1(B),Col10a1(C)andosteocalcin(D)atdifferenttimepointsafterthesurgery
LIPUS通过改变小窝蛋白-1的表达促进骨折愈合LIPUS作为一种高频低张的机械波,可以通过机械效应、热效应等改变细胞的物理微环境。目前认为LIPUS可以传播至骨痂软组织及矿化组织形成的多孔网络内部,并在这些孔隙内产生流体微动,从而调节细胞外基质的产生,施加剪应力激活细胞膜表面的机械性刺激感受器[1]。因此,LIPUS促进骨折愈合与机械信号的呈递密切相关。
小窝是呈烧瓶状的特异细胞膜内陷微区,对机械刺激敏感[12],参与包括信号转导在内的众多生物学过程。小窝蛋白是组成小窝的重要结构蛋白,有3个亚型:小窝蛋白-1、2、3。小窝主要通过小窝蛋白-1的“脚手架”结构域与各信号分子的催化亚基结合,参与信号转导的调节。小窝蛋白不仅定位于细胞质膜,还存在于细胞核及多种细胞器中。
小窝蛋白-1可能参与骨折愈合的信号转导。Rubin等[13]发现小窝蛋白-1基因敲除小鼠的骨体积及强度显著增加。Tang等[3]发现骨折后外周血单个核细胞中小窝蛋白-1基因表达水平升高,并在骨折后第9~12天达到高峰。Baker等[14]指出间充质细胞向成骨细胞分化的过程中,小窝蛋白-1基因表达增加,阻止其进一步分化,被视为一种负反馈机制。Hollins等[15]通过检测小窝蛋白-1在鸡胚胎软骨形成中的表达,发现其在软骨发育过程中表达增加,推测其可能参与软骨细胞分化的调控。我们在前期研究中也发现,大鼠骨折愈合早期骨痂中软骨细胞分布区可见小窝蛋白-1表达显著,随着软骨细胞消失其水平下降[16]。
本研究发现,术后第7、14天,实验侧软骨细胞增殖分化程度均高于对照侧。造模后7天可见软骨细胞小窝蛋白-1主要定位在细胞核,实验侧表达量明显高于对照侧。已知小窝蛋白-1可通过与共定位于小窝内的信号分子的核转位控制细胞增殖相关基因的启动[2]。Sedding等[17]在体外培养血管平滑肌细胞的研究中发现:在机械应力增加的情况下,小窝蛋白-1可以促进其细胞周期进程。以上结果提示LIPUS可能通过小窝蛋白-1的核转位促进软骨细胞的增殖。术后第14天,双侧骨痂小窝蛋白-1表达均有明显增加,主要定位于肥大软骨细胞膜,实验侧表达量显著高于对照侧。目前已知小窝蛋白-1参与调控软骨细胞的分化[15],说明LIPUS可通过上调小窝蛋白-1的表达促进软骨细胞的肥大化。第21、28天,软骨细胞退变、凋亡,间充质细胞小窝蛋白-1蛋白质水平在向成骨细胞分化过程中降低,实验侧明显低于对照侧。研究发现敲除小窝蛋白-1基因后促进间充质细胞分化为成骨细胞[14],提示LIPUS可能通过下调小窝蛋白-1的表达促进间充质细胞向成骨细胞分化。小窝蛋白-1 mRNA水平也呈现类似的规律,但第7、28天双侧骨痂表达差异无统计学意义,这可能与骨折愈合过程相互交织的特性有关,即骨痂组织内部不仅含有增殖分化的软骨细胞,还含有向成骨细胞分化的间充质细胞。
综上所述,促进软骨内成骨是LIPUS加速长管状骨骨折愈合的重要机制,在这个过程中小窝蛋白-1可能发挥了重要的作用:在软骨痂形成期,LIPUS可能通过上调小窝蛋白-1的表达促进软骨细胞的增殖、分化;在硬骨痂形成期,在LIPUS的作用下,小窝蛋白-1基因表达降低,间充质细胞逐渐向成骨细胞分化并成骨。我们的后续研究将对产生上述效应的具体信号转导通路和靶基因进行进一步探索。
[1]PADILLA F,PUTS R,VICO L,etal.Stimulation of bone repair with ultrasound[J].AdvExpMedBiol,2016,880:385-427.
[2]FRIDOLFSSON HN,ROTH DM,INSEL PA,etal.Regulation of intracellular signaling and function by caveolin[J].FasebJ,2014,28(9):3823-3831.
[3]TANG PF,BURKE GA,LI G,etal.Patients with long bone fracture have altered caveolin-1 expression in their peripheral blood mononuclear cells[J].ArchOrthopTraumaSurg,2009,129(9):1287-1292.
[4]WARDEN SJ,BENNELL KL,MCMEEKEN JM,etal.Acceleration of fresh fracture repair using the sonic accelerated fracture healing system (SAFHS):a review[J].CalcifTissueInt,2000,66(2):157-163.
[5]AKIYAMA H,HACHIYA Y,OTSUKA H,etal.Low-intensity pulsed ultrasound therapy stimulates callus formation between host femur and cortical onlay strut allograft[J].UltrasoundMedBiol,2014,40(6):1197-1203.
[6]THOMPSON EM,MATSIKO A,FARRELL E,etal.Recapitulating endochondral ossification:a promising route toinvivobone regeneration[J].JTissueEngRegenMed,2015,9(8):889-902.
[7]KATANO M,NARUSE K,UCHIDA K,etal.Low intensity pulsed ultrasound accelerates delayed healing process by reducing the time required for the completion of endochondral ossification in the aged mouse femur fracture model[J].ExpAnim,2011,60(4):385-395.
[8]UDDIN SM,RICHBOURGH B,DING Y,etal.Chondro-protective effects of low intensity pulsed ultrasound[J].OsteoarthritisCartilage,2016,24(11):1989-1998.
[9]XIA P,REN S,LIN Q,etal.Low-intensity pulsed ultrasound affects chondrocyte extracellular matrix production via an integrin-mediated p38 MAPK signaling pathway[J].UltrasoundMedBiol,2015,41(6):1690-1700.
[10]MACKIE EJ,AHMED YA,TATARCZUCH L,etal.Endochondral ossification:how cartilage is converted into bone in the developing skeleton[J].IntJBiochemCellBiol,2008,40(1):46-62.
[11]NEVE A,CORRADO A,CANTATORE FP.Osteocalcin:skeletal and extra-skeletal effects[J].JCellPhysiol,2013,228(6):1149-1153.
[12]SHIHATA WA,MICHELL DL,ANDREWS KL,etal.Caveolae:a role in endothelial inflammation and mechanotransduction?[J].FrontPhysiol,2016,7:628.
[13]RUBIN J,SCHWARTZ Z,BOYAN BD,etal.Caveolin-1 knockout mice have increased bone size and stiffness[J].JBoneMinerRes,2007,22(9):1408-1418.
[14]BAKER N,ZHANG G,YOU Y,etal.Caveolin-1 regulates proliferation and osteogenic differentiation of human mesenchymal stem cells[J].JCellBiochem,2012,113(12):3773-3787.
[15]HOLLINS AJ,CAMPBELL L,GUMBLETON M,etal.Caveolin expression during chondrogenesis in the avian limb[J].DevDyn,2002,225(2):205-211.
[16]肖峰,刘光华,刘邦忠,等.caveolin-1蛋白在骨折愈合过程中表达的实验研究[J].医学研究杂志,2015(09):90-93.
[17]SEDDING DG,BRAUN-DULLAEUS RC.Caveolin-1:dual role for proliferation of vascular smooth muscle cells[J].TrendsCardiovascMed,2006,16(2):50-55.

