水通道蛋白3、8和9的异常亚细胞分布参与大鼠酒精性肝病的发病
李 静 赵广西 孙剑勇
(复旦大学附属中山医院消化内科 上海 200032)
酒精性肝病(alcoholic liver disease,ALD)是由于长期大量饮酒而导致的肝脏急性或者慢性疾病。根据发病的轻重可将其分为酒精性脂肪肝、酒精性肝炎、酒精性肝硬化和酒精引起的肝癌。在2010年,由酒精性肝硬化导致的死亡人数占全球总死亡人数的0.9%[1]。
水通道蛋白(aquaporin,AQP)是一种跨细胞膜蛋白,广泛分布于哺乳动物的各器官组织。目前发现哺乳动物有13种AQP表达,分别命名为AQP0~12。在亚细胞水平,AQP可以被检测分布于细胞内囊泡(intracellular vesicles,IV)、细胞膜和核膜。AQP也分布于细胞外囊泡,如外泌体等,并且被认为具有作为诊断疾病的肿瘤标志物的潜在价值[2]。
AQP3、8和9广泛分布于消化系统。AQP3属于水-甘油AQP,大量分布于消化道上皮,可以使水、甘油和其他小分子物质通过细胞膜。最新研究表明AQP3与细胞增殖和迁移有关,并且参与维持肠道屏障完整性等生理病理过程[3]。AQP8、AQP9分布于包括肝脏、肠道在内的许多消化系统器官组织。AQP8可促进水、H2O2通过细胞膜[4],参与维持线粒体的正常功能及胆汁分泌[5-6]。AQP9可以使水、甘油和尿素穿过细胞膜,参与肝细胞糖异生,也有报道AQP9与毛细胆管的胆汁分泌有关[7]。然而,AQP在ALD中的表达和分布情况目前鲜有报道。
本研究主要通过Western blot、组织免疫组化染色及免疫电镜等实验方法,探索在ALD大鼠模型中AQP3、8和9的表达及亚分布情况。
材 料 和 方 法
实验动物及设备18只雄性SD大鼠[(250±10) g,上海斯莱克实验动物公司];Lieber-DeCarli配对ALD液体造模饲料(江苏南通特洛菲动物饲料公司);real-time PCR检测仪(型号:ABI7500,美国ABI公司);Trizol (美国Invitrogen公司);含DNA酶的RNA逆转录试剂盒,SYBR Green PCR试剂盒(日本Takara公司);AQP3/8/9兔抗大鼠一抗(美国Alomone Laboratories公司);10 nm胶体金标记的山羊抗兔的二抗(美国Abcam公司);膜浆蛋白提取试剂盒(上海碧云天公司)。
动物分组经过1周的环境适应后,18只雄性SD大鼠被随机等分为3组,即:正常对照(normal control,NC)组,造模对照(Pair-fed,PF)组和酒精造模(Ethanol,EtOH)组。将各组大鼠饲养于标准的SPF级环境中。
SD大鼠ALD模型建立NC组大鼠给予正常啮齿固体饲料。PF组和EtOH组配对喂养含有相当于18%的蛋白、11%的碳水化合物、35%的脂肪和36%乙醇或者等麦芽糖-糊精混合物(均为热量配比)的造模用液体饲料。EtOH组自由喂食含酒精的Lieber-DeCarli液体饲料,使饲料中的酒精提供的热量每两天增加2%,直至酒精热量占进食液体饲料总热量的36%。造模时间共6周。
病理学检测4%甲醛固定肝脏、回肠和结肠组织,石蜡包埋,组织蜡块切片(约5 μm),用于HE染色和免疫组化染色。为了检测肝脏的脂肪含量,肝脏冰冻切片按照文献所述方法用油红O染色[8]。
免疫组化染色将石蜡切片用柠檬酸修复液加热修复,3% BSA封闭1 h,AQP3/8/9一抗(1∶100稀释) 4 ℃孵育过夜。二抗(1∶1 000稀释)室温孵育1 h,辣根过氧化物酶底物用于信号检测,最后将切片用苏木精复染。
免疫电镜检测新鲜的肝脏组织用2.5%的戊二醛固定后按照之前的文献方法处理切片。超薄的肝脏切片分别用兔抗大鼠的AQP8或者AQP9一抗于4 ℃ 孵育 36 h,然后用胶体金标记的二抗(1∶50稀释)。用电子显微镜(JEOL-1230)拍照记录。
实时荧光定量PCR使用Trizol提取肝脏、回肠和结肠组织中的总RNA并逆转录为cDNA。将等量cDNA 作为模板用于PCR反应。目的基因mRNA相对表达情况用该基因与β-actin的2-ΔΔCt比值来计算。qRT-PCR 的引物序列见表 1。
Westernblot分别提取新鲜的肝脏、回肠和结肠组织膜蛋白和浆蛋白。将30 μg蛋白用于SDS/PAGE电泳,恒流310 mA,1.5 h转膜。3%脱脂牛奶室温封闭1 h,AQP3、AQP8、AQP9和β-actin一抗(1∶1 000稀释) 4 ℃过夜孵育,二抗 (1∶5 000稀释)室温孵育1 h,ECL曝光液检测免疫反应。
统计学分析所有数据使用 SPSS 21.0进行统计,采用One-way ANOVA分析检验,P<0.05为差异有统计学意义。
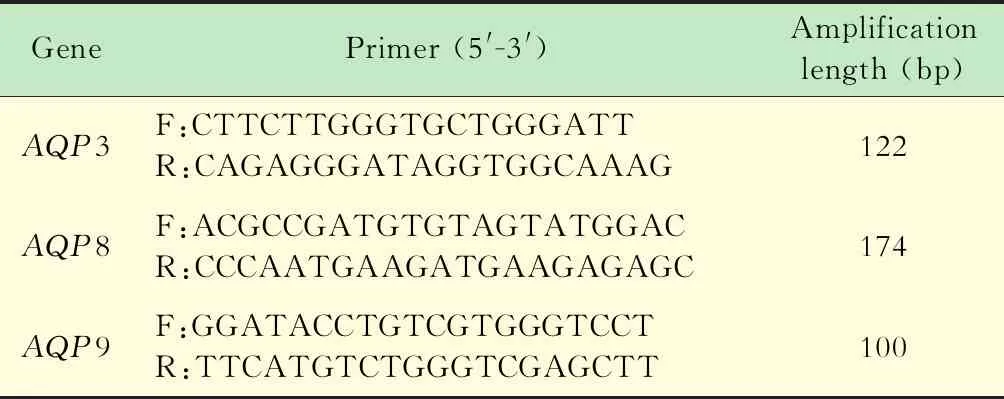
表1 qRT-PCR引物Tab 1 Primers of qRT-PCR
结 果
慢性饮酒可以导致大鼠肝脏轻微损伤EtOH组的大鼠肝脏细胞有明显损伤,电镜下表现为线粒体水肿,线粒体嵴减少和紊乱,内质网空泡化,以及毛细胆管形态异常等 (图 1、2)。HE染色结果表明,EtOH组大鼠的肝脏有明显的脂肪变性但并未出现明显的纤维化或炎症 (图1A~C) 。

A,B and C (bar=10μm):Light microscopic images of HE stained liver tissues.After chronic alcohol intake,significant vacuolization which represented macrovesicular steatosis was observed in the hepatocytes distributed in acinar zone 1 and 2,close to the portal tracts in EtOH group.D,E and F (bar=10μm):Light microscopic images of oil red O staining of liver tissues.G,H and I (bar=1μm):The general images of single hepatocyte under transmission electron microscopy (TEM).CV:Central vein;PT:Portal triad;N:Nucleus.
图1饮酒刺激后大鼠肝细胞的病理学表现
Fig1Histologicalchangesinrathepatocytesafteralcoholconsumption

A,B and C (bar=0.5μm):Swelling mitochondria,reduced and derangement of mitochondrial cristae under TEM,also ER vesiculation could be seen in EtOH hepatocytes (single white color arrow marked).D,E and F (bar=1μm):Changes in hepatic bile canaliculus structure in NC,PF and EtOH groups.The boundary of hepatic bile canaliculus was blurred in EtOH group (marked by 3 white arrows).M:Mitochondria;N:Nucleus;B:Bile canaliculus;F:Fatty drops;TJ:Tight junction;ER:Endoplasmic reticulum.
图2透射电镜下的大鼠肝细胞线粒体和毛细胆管
Fig2Hepatocellularmitochondriaandbilecanaliculusundertransmissionelectronmicroscopyinrats
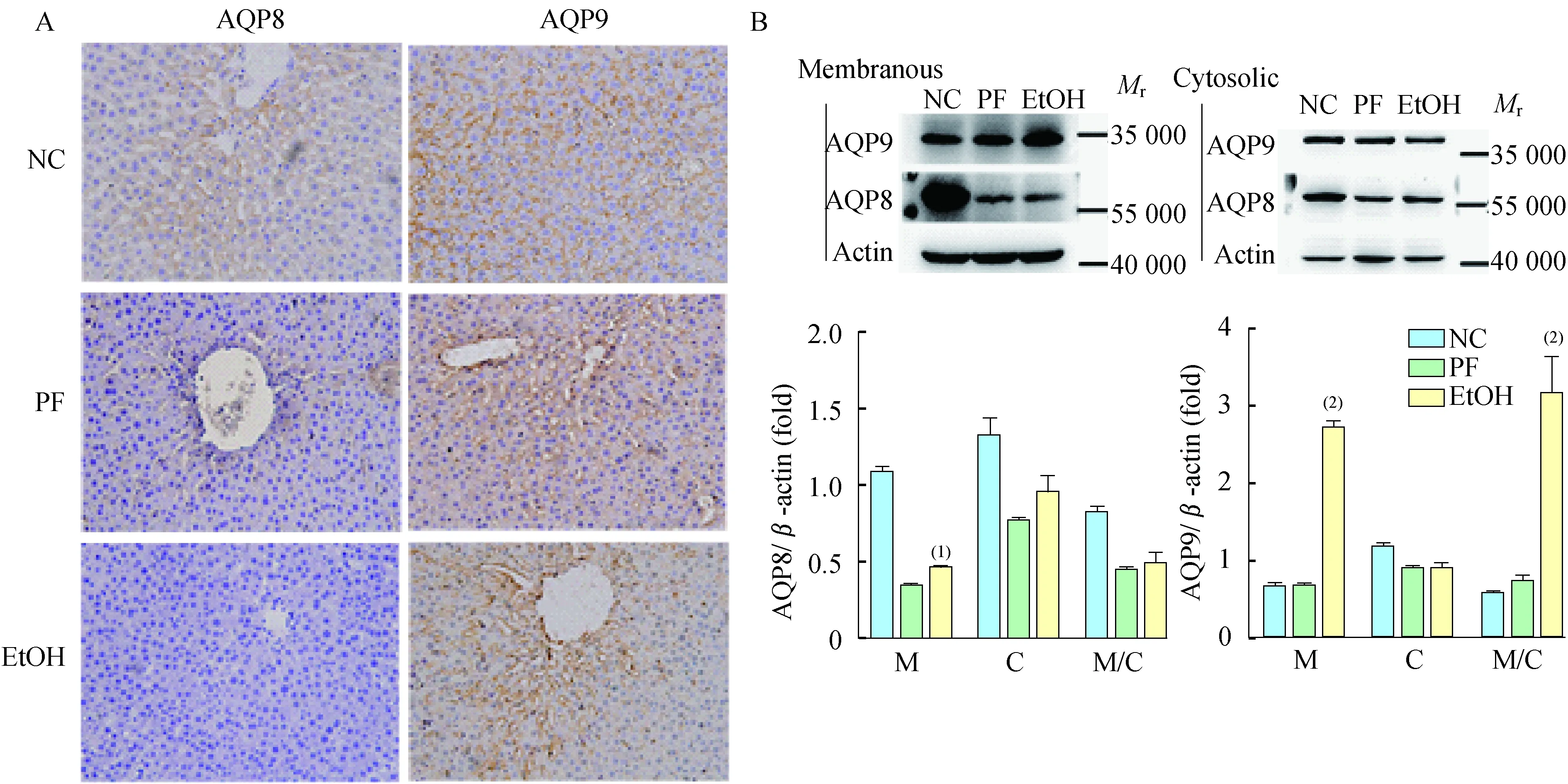
A:The immunohistochemistry staining of AQP8 and AQP9 in liver tissues under light microscopy (×200);B:Cytoplasmic and membranous expression of AQP8 and 9 in rat liver after different treatments through immunoblot assay (NC:Normal control;PF:Pair-fed;EtOH:Ethanol-fed).β-actin was used as a loading control.M:Membranous;C:Cytoplasmic;M/C:Membranous/Cytoplasmic ratio.EtOHvs. PF,(1)P<0.05,(2)P<0.01.
图3酒精刺激后大鼠肝脏AQP的表达和分布
Fig3ExpressionanddistributionofAQPsinlivertissuesinratsafteralcoholintake
慢性饮酒导致大鼠肝脏AQP表达失调AQP8和AQP9在大鼠肝脏均有分布,如图3A所示,较弱的AQP8表达于近中央静脉的肝脏细胞;较强的AQP9分布于近肝血窦的肝细胞膜。由图4可见,AQP8、AQP9分布于线粒体内膜(inner mitochondrial membranes,IMMs)、毛细胆管膜(bile canaliculus membrane,BCM)等亚细胞结构。相较于对照组,酒精摄入可以减少AQP8在BCM和IMMs的分布,而增加AQP9在BCM的分布。
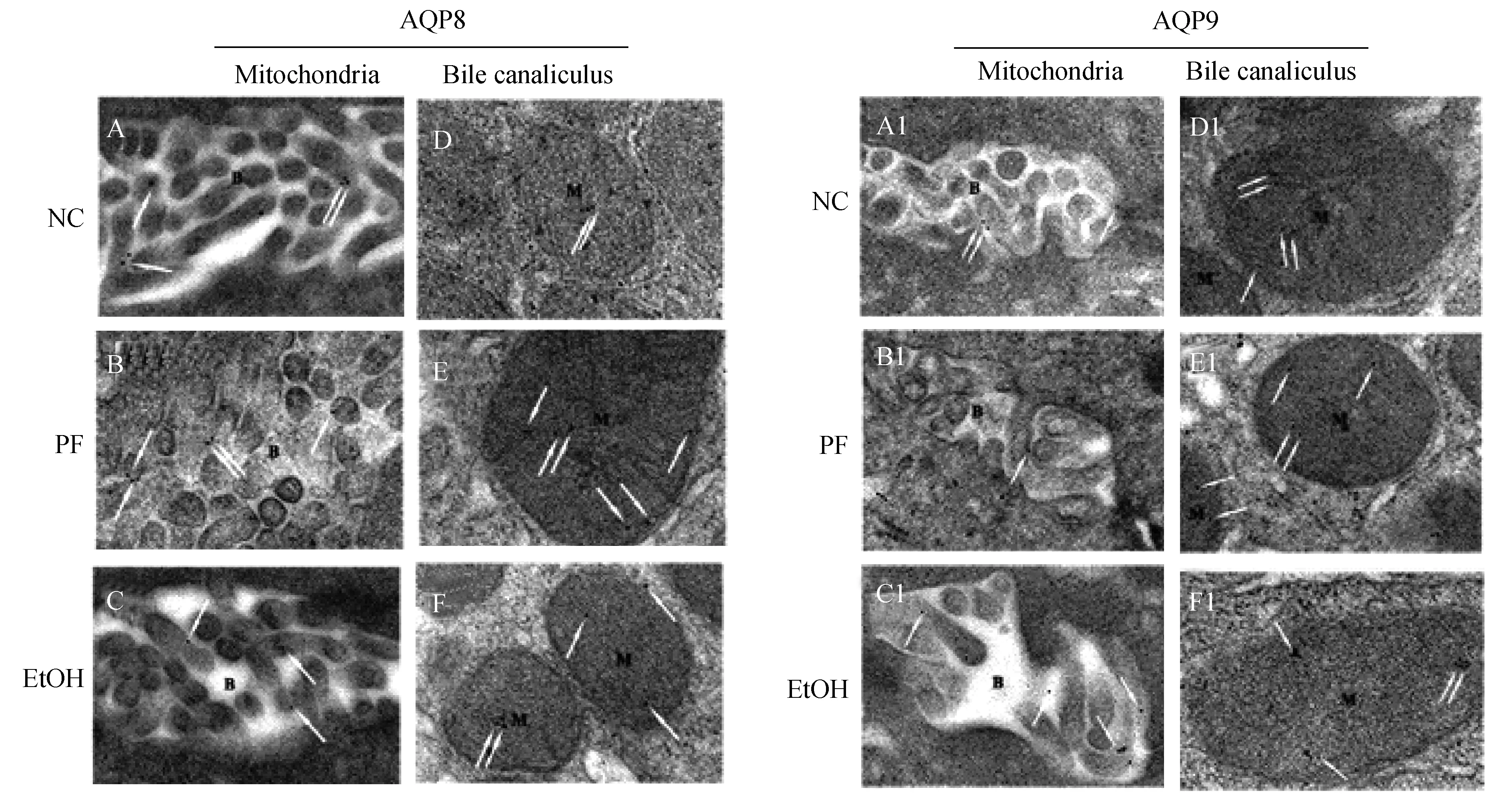
A,B and C:AQP8 localization in hepatocellular bile canaliculus membrane with colloidal gold particles labeling (arrows);D,E and F:AQP8 localization in inner mitochondrial membrane with colloidal gold particles labeling (arrows);A1,B1 and C1:AQP9 localization in hepatocellular bile canaliculus membrane with colloidal gold particles labeling (arrows);D1,E1 and F1:AQP9 distribution in inner mitochondrial membrane with colloidal gold particles labeling (arrows).M:Mitochondria;B:Bile canaliculus.
图4AQP8和AQP9在大鼠肝细胞中的免疫电镜染色结果(×40000)
Fig4ImmunoelectronmicroscopyforAQP8andAQP9inlivertissuesinrats(×40000)
AQP可以储存于IV或细胞膜上,而只有当AQP分布于细胞膜时才能发挥转运功能。因此我们分别检测了细胞膜和细胞质内AQP的表达情况。如图3B显示,慢性酒精摄入后AQP8在大鼠肝细胞膜上的表达水平增加(P<0.05),而细胞质内AQP8表达水平及AQP8膜/质比没有明显变化。EtOH组大鼠肝脏细胞膜上AQP9的表达水平、AQP9膜/浆比均增加(P<0.01)。但是EtOH组AQP8和AQP9的mRNA表达水平均无明显变化。
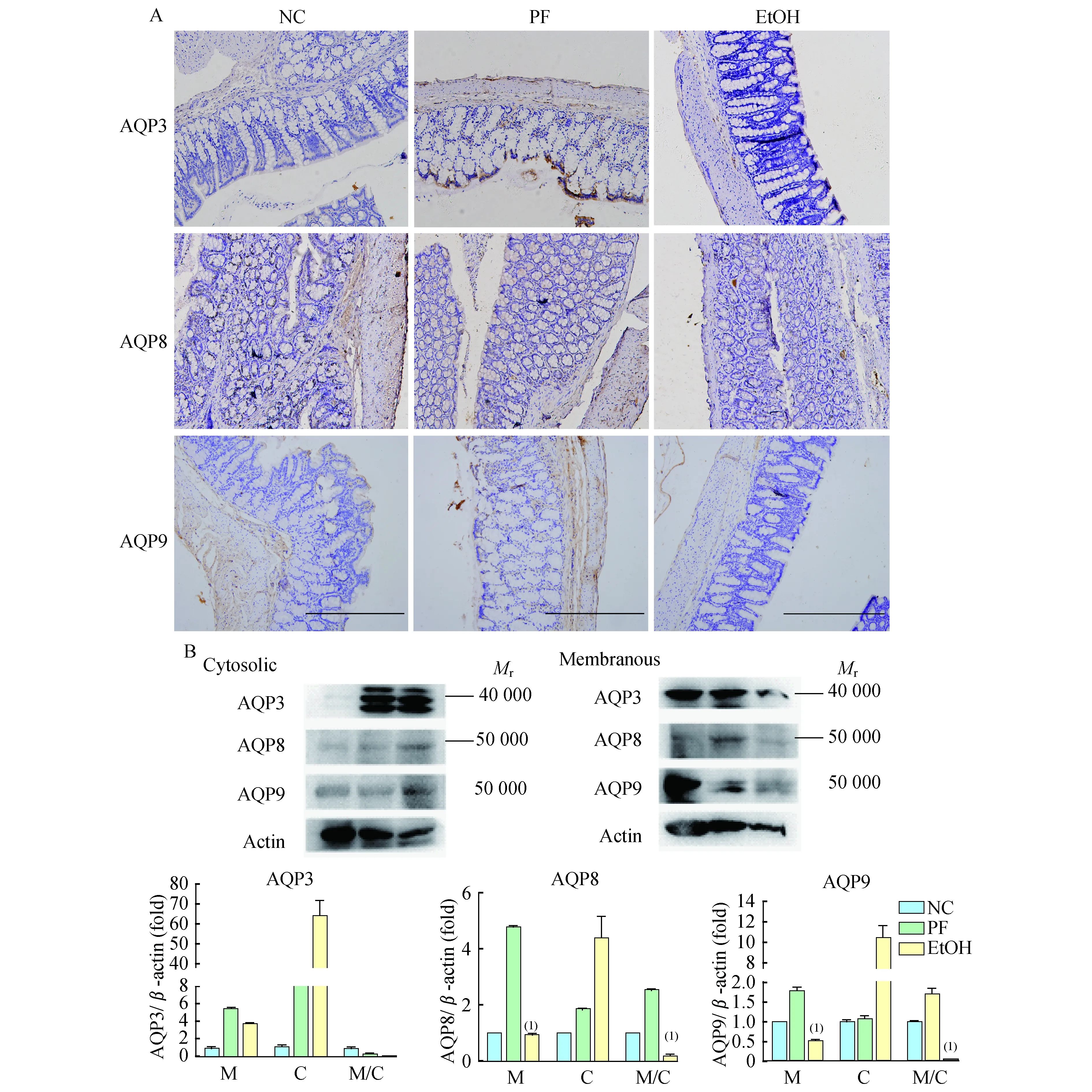
慢性酒精摄入导致回肠AQPs表达异常研究显示小肠屏障功能失调参与ALD的发病过程,而AQP3对维持肠道屏障完整性有重要作用[3]。如图5A 所示,AQP3、8和9主要分布于回肠上皮细胞的顶端膜上。
如图5B所示,慢性酒精摄入后大鼠回肠组织细胞膜和胞质AQP3的表达量均减少(PC<0.01,PM<0.01);AQP3膜/质比上调(P<0.01)。AQP8 细胞膜的表达水平没有明显改变,但AQP8在细胞质明显减少(P<0.05),且AQP8膜/质比明显上调 (P<0.01)。这些说明AQP3、AQP8有可能受到重新分布的调控。AQP9在细胞膜和细胞质的表达量均减少(P<0.01),而AQP9膜/质比也明显降低(P<0.01)。慢性饮酒后回肠组织AQP3、AQP8 和AQP9mRNA的表达水平的差异无明显统计学意义。
慢性饮酒导致大鼠结肠组织AQP表达失调AQP3、8和9主要分布于结肠上皮细胞顶端膜上(图6A)。如图6B所示,饮酒刺激后,AQP8 和 AQP9 在结肠组织细胞膜上的蛋白表达水平下降(P<0.01),AQP8、AQP9的膜/质比下调 (P<0.01) 。但慢性饮酒后结肠组织AQP3、AQP8和AQP9 mRNA 的表达水平变化无统计学意义。
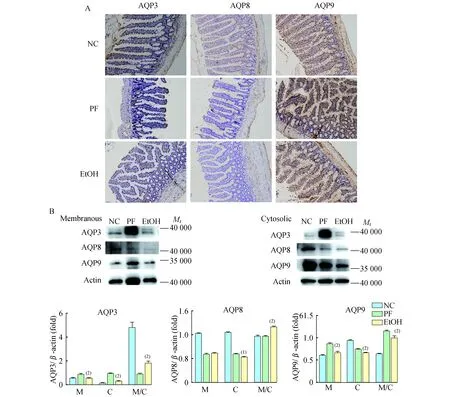
A:The immunohistochemistry staining of AQP3,AQP8 and AQP9 in ileum tissues under light microscopy (×200);B:Cytoplasmic and membranous expression level of AQP3,AQP8 and AQP9 in ileum tissues through immunoblot assay.β-actin was used as a loading control.EtOHvs. PF,(1)P<0.05,(2)P<0.01.
图5大鼠回肠AQP的表达和分布
Fig5ExpressionanddistributionofAQPsinileumtissuesinrats
讨 论
ALD目前已经成为全球慢性肝病的重要病因之一。肠道菌群失调等导致的肠道屏障损伤、肝脏脂质代谢异常参与ALD的发病过程。AQP作为影响小分子运输的跨膜蛋白,对于维持细胞正常生命活动起到至关重要的作用。因此,从表达、分布和调节等方面深入探讨AQP对全面了解ALD有重要意义。
ALD临床上主要表现为肝脏不同程度的损伤。目前在大鼠和人类肝脏中表达的AQP家族中被研究最多的是AQP8和AQP9。本研究通过免疫电镜发现AQP8、AQP9分布于IMMs和BCM等亚细胞结构。我们的研究发现,给予大鼠饮酒刺激并不明显影响肝脏AQP8和AQP9的mRNA表达水平,但是显著增加了AQP8、AQP9蛋白在肝细胞膜上的分布。AQP8膜分布上调可能会增加肝细胞对H2O2的通透性,从而促进肝细胞的过氧化应激损伤。此外,AQP9的膜/质比增加说明可能存在一种机制将肝细胞内的AQP9重新分布于细胞膜,从而增加AQP9的功能活性。AQP9是肝脏中唯一与肝细胞摄取甘油相关的跨膜蛋白,AQP9功能异常与代谢综合征的脂质代谢紊乱有明显关系[9],饮酒增加肝细胞膜AQP9的分布可能与肝脏脂肪变、脂质代谢紊乱有关,肝细胞膜AQP9分布增加也可增加肝细胞对H2O2的敏感性[10]。慢性饮酒后,大鼠肝脏毛细胆管中AQP8的分布减少而AQP9的分布增加,说明在饮酒引起的肝脏脂肪变早期阶段,酒精可能已经通过影响AQP8和AQP9的分布及毛细胆管水分的分泌从而逐步影响胆汁分泌过程。饮酒后大鼠肝脏细胞线粒体受到严重损伤,形态异常,线粒体嵴减少、紊乱,免疫电镜显示线粒体上AQP8的分布减少,而AQP8参与维持线粒体体积、H2O2转运从而保证线粒体正常氧化磷酸化反应[11],因此线粒体AQP8的分布减少可能与肝脏过氧化应激损伤有关。目前研究认为氧化应激反应是酒精诱导的肝脏损伤的重要环节之一,因此可以认为AQP8和AQP9通过介导氧化应激反应参与酒精诱导的肝细胞损伤。
A:The immunohistochemistry staining of AQP3,8 and 9 in colon tissues under light microscopy (bar=10μm);B:Cytoplasmic and membranous expression level of AQP3,AQP8 and AQP9 in colon tissues.EtOHvs. PF,(1)P<0.01.
图6饮酒后大鼠结肠AQP的表达和分布
Fig6ExpressionanddistributionofAQPsincolontissuesofratsafteralcoholintake
肠道上皮再生和完整性对维持肠道屏障有重要影响,而肠道屏障损伤是ALD的重要发病机制之一[12-13]。AQP3、8和9在大鼠肠道广泛分布。近来文献报道AQP3和AQP9分别通过参与肠道上皮的再生、小肠杯状细胞分泌黏液等生理活动从而对维持肠道屏障的完整性有重要作用[3,14]。AQP8表达下降与结肠的炎症反应有关。本研究证明饮酒刺激后,大鼠AQP3和AQP9在回肠细胞膜的表达减少,AQP8和AQP9在结肠细胞膜的表达减少,证明饮酒可能通过影响AQP的细胞膜表达影响肠道修复能力从而损伤肠道屏障功能,从而参与ALD的发病过程。
目前为止,AQP可以通过3种主要机制调节其表达情况:(1)转录或翻译水平的调节;(2)蛋白构象的改变;(3)在某些刺激因素(如激素分泌和信号通路活化)的作用下发生蛋白在细胞膜与细胞质之间分布的转移实现AQP的重新分布,从而影响AQP的蛋白功能并参与许多疾病的发生过程[15-16]。后续的研究将集中于AQP3、8和9在ALD表达和亚细胞分布的调节机制及相关功能的验证,这将为全面了解ALD的发病机制提供新的思路。
[1]REHM J,SAMOKHVALOV AV,SHIELD KD.Global burden of alcoholic liver diseases [J].JHepatol,2013,59(1):160-168.
[2]HACHEZ C,CHAUMONT F.Aquaporins:a family of highly regulated multifunctional channels [J].AdvExpMedBiol,2010,679:1-17.
[3]ZHANG W,XU Y,CHEN Z,etal.Knockdown of aquaporin 3 is involved in intestinal barrier integrity impairment [J].FEBSLett,2011,585(19):3113-3119.
[4]BIENERT GP,MOLLER AL,KRISTIANSEN KA,etal.Specific aquaporins facilitate the diffusion of hydrogen peroxide across membranes [J].JBiolChem,2007,282(2):1183-1192.
[5]IKAGA R,NAMEKATA I,KOTIADIS VN,etal.Knockdown of aquaporin-8 induces mitochondrial dysfunction in 3T3-L1 cells [J].BiochemBiophysRep,2015,4:187-195.
[6]CARRERAS FI,LEHMANN GL,FERRI D,etal.Defective hepatocyte aquaporin-8 expression and reduced canalicular membrane water permeability in estrogen-induced cholestasis [J].AmJPhysiolGastrointestLiverPhysiol,2007,292(3):G905-G912.
[7]JELEN S,WACKER S,APONTE-SANTAMARIA C,etal.Aquaporin-9 protein is the primary route of hepatocyte glycerol uptake for glycerol gluconeogenesis in mice [J].JBiolChem,2011,286(52):44319-44325.
[8]ZHU Z,JIANG Z,ZHOU J,etal.Involvement of insulin resistance in the protective effect of metformin against alcoholic liver injury [J].AlcoholClinExpRes,2014,38(6):1510-1519.
[9]MAEDA N.Implications of aquaglyceroporins 7 and 9 in glycerol metabolism and metabolic syndrome [J].MolAspectsMed,2012,33(5-6):665-675.
[10]WATANABE S,MONIAGA CS,NIELSEN S,etal.Aquaporin-9 facilitates membrane transport of hydrogen peroxide in mammalian cells [J].BiochemBiophysResCommun,2016,471(1):191-197.
[11]MARCHISSIO MJ,FRANCES DE,CARNOVALE CE,etal.Mitochondrial aquaporin-8 knockdown in human hepatoma HepG2 cells causes ROS-induced mitochondrial depolarization and loss of viability [J].ToxicolApplPharmacol,2012,264(2):246-254.
[12]KAKIYAMA G,HYLEMON PB,ZHOU H,etal.Colonic inflammation and secondary bile acids in alcoholic cirrhosis [J].AmJPhysiolGastrointestLiverPhysiol,2014,306(11):G929-G937.
[13]ELAMIN E,MASCLEE A,TROOST F,etal.Cytotoxicity and metabolic stress induced by acetaldehyde in human intestinal LS174T goblet-like cells [J].AmJPhysiolGastrointestLiverPhysiol,2014,307(3):G286-G294.
[14]OKADA S,MISAKA T,MATSUMOTO I,etal.Aquaporin-9 is expressed in a mucus-secreting goblet cell subset in the small intestine [J].FEBSLett,2003,540(1-3):157-162.
[15]ARTHUR J,HUANG J,NOMURA N,etal.Characterization of the putative phosphorylation sites of the AQP2 C terminus and their role in AQP2 trafficking in LLC-PK1 cells [J].AmJPhysiolRenalPhysiol,2015,309(8):F673-679.
[16]BOGUM J,FAUST D,ZUHLKE K,etal.Small-molecule screening identifies modulators of aquaporin-2 trafficking [J].JAmSocNephrol,2013,24(5):744-758.

