三种粗粮粉体外调节肠道菌群的作用研究
曹文燕,黄莲燕,朱红广,丁 立,王 静
(北京工商大学,北京食品营养与人类健康高精尖创新中心,食品添加剂与配料北京高校工程研究中心,北京 100048)
肠道菌群是一个庞大复杂的生态系统,一个健康成人的肠道有500~1000种细菌,总数达1013~1014,是人体体细胞的10倍之多,它们编码的基因是人体自身基因的100倍,大量研究表明,肠道菌群组成的结构和比例与人体健康状况存在着密切的联系。肠道菌群失调不仅会引起腹泻、便秘等多种胃肠道疾病[12],也会诱发肥胖、衰老、代谢综合征、糖尿病甚至癌症等其他疾病[34]。21世纪以来,高通量测序技术的出现掀起了研究肠道菌群的热潮,其可直接测序16S rRNA基因的PCR产物,每次分析获得的基因序列数百万甚至亿万计,不仅通量高,而且能够同时分析上百个不同的样品,是分析复杂环境微生物群落物种组成的重要工具[5]。
麸皮是粮食加工过程中的副产品,来源充足且价格低廉,麸皮中不仅富含蛋白质、矿物质、维生素等物质,更是一种重要的膳食纤维来源,对人体的健康起着重要作用[67]。
麸皮中的膳食纤维和生物活性物质,虽然不被机体内源性消化酶所水解,但是可以被肠道微生物所利用,产生包括短链脂肪酸在内的一系列代谢产物,通过代谢产物对机体健康起着重要的调节作用。研究表明,膳食纤维能够有效调节肠道菌群组成,如促进双歧杆菌和乳酸杆菌等益生菌的增殖,抑制病原菌生长、减少有毒发酵产物的形成[8]。麸皮中各种营养成分和植物化学素保持原生状态、并存在协同增效作用,因此与摄入提纯的植物化学素相比,更加有利于人体健康。本文选用了不同品种的三种谷物麸皮(小麦、黑小麦和燕麦),将其配制成粗粮粉,在体外构建模拟发酵体系,利用16S rRNA高通量测序技术探究不同粗粮粉对肠道菌群组成和结构的影响。
1 材料与方法
1.1 材料与仪器
小麦麸皮、燕麦麸皮 源自河北热河有限公司;黑小麦麸皮 源自济南渲益农业科技有限公司;金沙河富强高筋小麦粉 当地超市;α淀粉酶(1 kU)、胃蛋白酶(8 kU)、胰液素 美国Sigma公司;猪胆盐、低聚果糖、透析袋(1000 kDa) 上海源叶生物科技有限公司;胰蛋白胨、酵母浸粉 北京奥博星生物技术有限公司;无水氯化钙、磷酸氢二钾、氢氧化钠、碳酸氢钠、碳酸钠、磷酸二氢钠、磷酸氢二钠 分析纯,西陇化工股份有限公司;七水硫酸镁、树脂天青、维生素K1、氯化血红素 分析纯,麦克林公司;L半胱氨酸、吐温80 化学纯,国药集团化学试剂有限公司;β葡聚糖试剂盒 爱尔兰Megazyme公司;DNA提取试剂盒 美国Omega公司;DNA凝胶回收试剂盒 美国Axygen公司。
漩涡仪 大龙兴创实验仪器(北京)有限公司;AL203电子天平 梅特勒托利多仪器有限公司;YXQLS50A高压灭菌锅 上海云泰仪器仪表有限公司;THZ82A水浴恒温振荡器 上海江心仪器有限公司;DG250小型厌氧工作站 英国don whitley scientific公司;920 Titrando恒定pH电位滴定仪 美国奥豪斯(上海)有限公司;Freezone®真空冷冻干燥机 美国Labconco公司;CMAG HS 7磁力搅拌器 德国IKA公司;AOC20i气相色谱 日本岛津公司;ThermoNanoDrop2000紫外分光光度计 美国赛默飞公司
1.2 实验方法
1.2.1 麸皮与面粉的混合 分别将小麦麸、黑小麦麸、燕麦麸用超微粉碎机进行碾磨,并过80目筛,按照15%(W/W)麸皮添加量添加到面粉中,混匀。
1.2.2 麸皮中总膳食纤维、多酚和β葡聚糖含量的测定 膳食纤维含量的测定参照:GB/T5009.882014。
β葡聚糖含量的测定方法参照MIXED-LINKAGE BETAGLUCAN试剂盒中AACC Method 3223.01方法进行测定。
麸皮中多酚类物质的测定参照蔺艳君等[9]的方法,结果以没食子酸当量表示,即μg没食子酸(GAE)/g原料表示。
1.2.3 体外模拟消化过程 称取约12 g的混合粉,加100 mL蒸馏水用磁力搅拌器混匀后,121 ℃高压灭菌15 min,待冷却至常温后再加入100 mL无菌蒸馏水;加入7 mL(20 U/mL)α淀粉酶溶液,在37 ℃恒温水浴振荡器中培养30 min,模拟口腔消化;用6 mol/L盐酸调节pH=2,加入5 mL 0.1 mol/L盐酸(含0.54 g蛋白酶),37 ℃恒温水浴振荡器培养2 h,模拟胃消化;用6 mol/L氢氧化钠调节pH=6.8,并加入25 mL 0.5 mol/L碳酸氢钠(含0.11 g胰液素和0.7 g猪胆盐),放入1 kDa的再生纤维素透析袋中,在0.1 mol/L氯化钠溶液,37 ℃过夜透析,第2 d更换一次透析液,再透析2 h,模拟小肠消化;将透析袋中的消化乳糜低温真空冷冻干燥后保存于20 ℃冰箱中[1011]。
1.2.4 体外模拟发酵过程
1.2.4.1 基础培养基的配制 胰蛋白胨2 g/L、酵母浸粉2 g/L、氯化钠0.1 g/L、磷酸氢二钾0.04 g/L、碳酸钠2 g/L、七水硫酸镁0.01 g/L、无水氯化钙0.01 g/L、吐温80 2 mL/L、氯化血红素50 mg/L、维生素K110 μL/L、L半胱氨酸0.5 g/L、猪胆盐0.5 g/L、树脂天青1 mg/L[10]。配成溶液后,用1 mol/L盐酸调节基础培养基的pH=6.8,分装到100 mL锥形瓶中,每个锥形瓶45 mL基础培养基,经高压灭菌后转移到厌氧工作站除氧24 h。
1.2.4.2 新鲜粪便的采集 于实验当天原位采集2女1男的粪便各30 g左右,置于厌氧箱中,整个采集过程10 min内完成。要求所有提供粪便的志愿者身体健康,没有胃肠病史,近半年来没有接受过抗生素的治疗。在厌氧工作站中用0.1 mol/L pH=6.8的无氧无菌磷酸盐缓冲溶液按1∶10(w/v)稀释混匀[12]。
1.2.4.3 发酵过程 向每个培养基中加入5 mL的粪便稀释液和0.5 g(按1%(w/v)的添加量)的消化乳糜,在37 ℃厌氧条件下发酵48 h,一式三份。同时以添加1%(w/v)的低聚果糖发酵作为阳性对照,以不添加任何碳水化合物的发酵作为阴性对照。
1.2.5 16S rRNA对菌群多样性分析
1.2.5.1 提取细菌总DNA 参照试剂盒Stool DNA kits提取发酵液中(一式三份等体积混合)总DNA,用紫外分光光度计测定OD值,并用1%的琼脂糖凝胶电泳对DNA进行质量检测。扩增细菌的16S区域V3~V4区,扩增引物515F(GTGCCAGCMGCCGCGGTAA)和806R(GGACTACHVGGGTWTCTAAT),在引物的5′端加上合适的Hiseq2500 PE250测序的index序列和接头序列,完成特异性引物的设计。
1.2.5.2 PCR扩增和产物纯化 以稀释后的基因组DNA为模板,使用KAPA HiFiHotstartReadyMix PCR kit高保真酶进行PCR[13],确保扩增的准确性和高效性。用2%的琼脂糖凝胶电泳检测PCR产物,并用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物。切胶回收后,用紫外分光光度计和1%的琼脂糖凝胶电泳进行文库质检。
1.2.5.3 Illumina测序 质检合格后,使用Illumina Hiseq PE250进行上机测序。测序结束后,按照相似度97%进行聚类,得到OTU(Operational Taxonomic Units),每个OTU被认为可以代表一个物种。
1.2.6 气相色谱(GC)测定发酵液中短链脂肪酸(SCFA)
1.2.6.1 GC条件 色谱柱:SHRtx5柱(30 m×0.25 mm×0.25 μm);以氮气作为载气,总流速为140 mL/min;进样量 1 μL,进样口温度280 ℃,FID检测器温度300 ℃,不分流;采用程序升温:80 ℃;3 ℃/min,150 ℃;20 ℃/min,250 ℃,2 min。
1.2.6.2 标准曲线的制作 分别配制一定浓度的乙酸、丙酸和丁酸标准母液,按照上述色谱条件分别找出每种标准物质的保留时间。将三种母液混合后,梯度稀释,进样检测。以峰面积为纵坐标,对照品浓度为横坐标绘制标准曲线。
乙酸回归方程:y=1686.5x3940.4(R2=0.98)
丙酸回归方程:y=2906.1x+2235.3(R2=0.99)
丁酸回归方程:y=4154.4x+809.2(R2=0.99)
1.2.6.3 样品前处理 取发酵48 h的2 mL发酵液,加0.2 mL 50% H2SO4酸化10 min,再加2 mL乙醚在冰上间歇振荡提取30 min,后于4800 r/min离心10 min,取上清液进样[1415]。
1.3 数据处理方法
采用SPSS v19.0软件进行显著性分析,所有样品进行三次测定(n=3),数据用平均值±标准差表示。
2 结果与分析
2.1 麸皮中膳食纤维、β葡聚糖和总酚成分分析
从表1可知,黑小麦麸皮总膳食纤维(TDF)最高,达53.42%,其次是小麦麸皮(41.00%),燕麦麸皮的TDF含量最低,为29.66%,这一结果与顾尧臣[16]报道的谷物麸皮中膳食纤维含量相一致。燕麦麸皮中β葡聚糖含量显著高于其他两种麸皮(p<0.05),达到10.70%,分别比小麦麸皮和黑小麦麸皮高出2.6和3.2倍。小麦麸皮和黑小麦麸皮的总酚含量(分别为2955.39和2786.58 μgGAE/g)显著(p<0.05)高于燕麦麸皮(1762.28 μgGAE/g)这一结果与目前报道的麸皮总酚含量相一致[1718]。
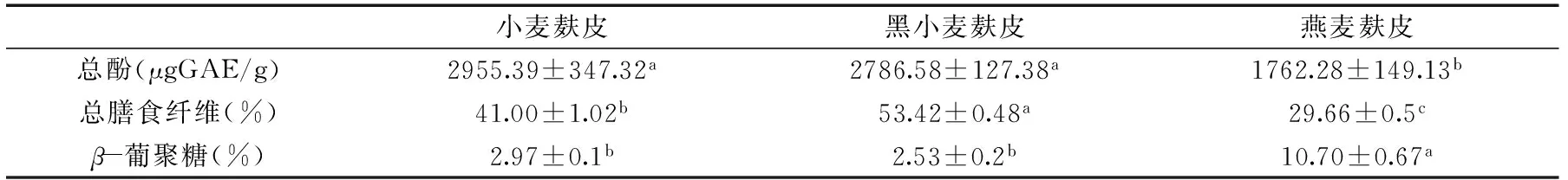
表1 麸皮中膳食纤维、β葡聚糖和总酚含量Table 1 Total dietary fibers,βglucan and total phenolie contents of brans
2.2 稀释曲线分析
通过高通量测序16S rRNA每个样品产生了至少27266条序列,在相似度为97%的条件下,共产生了658个OTU。如图1所示,Shannon曲线和稀释曲线反映了在目前的测序深度下,每个样品的微生物多样性测序深度足够。Chao1和ACE指数反映的是样品中物种的丰富度,从表2可知,与阳性对照组相比,粗粮发酵后微生物丰度降低;三种粗粮组之间比较发现,小麦粗粮组微生物丰度最高,其次是黑小麦粗粮和燕麦粗粮。Shannon和Simpson指数反映的是群落的多样性,与阴性对照组相比,在体外添加基质发酵后微生物多样性均降低,可能原因是体外模拟发酵环境下添加基质对肠道菌群的刺激导致;与阳性对照组相比,粗粮发酵后微生物多样性降低,因为低聚果糖被公认为一种益生元,能够被肠道菌群利用,维持肠道菌群的多样性[19],这和本文实验结果一致。三种粗粮之间比较,黑小麦粗粮发酵后微生物多样性指数高于其他两组粗粮发酵,可能是因为黑小麦麸皮中TDF含量高于其他两种麸皮所导致。麸皮中含有丰富的膳食纤维和植物活性成分,大部分的物质是不能被人体内源性酶所消化,而直接进入大肠被肠道菌群所分解利用,研究发现,在面粉中添加15%的麸皮的粗粮制品经体外发酵肠道菌群的多样性降低,不同粗粮对肠道菌群多样性的影响不一样。
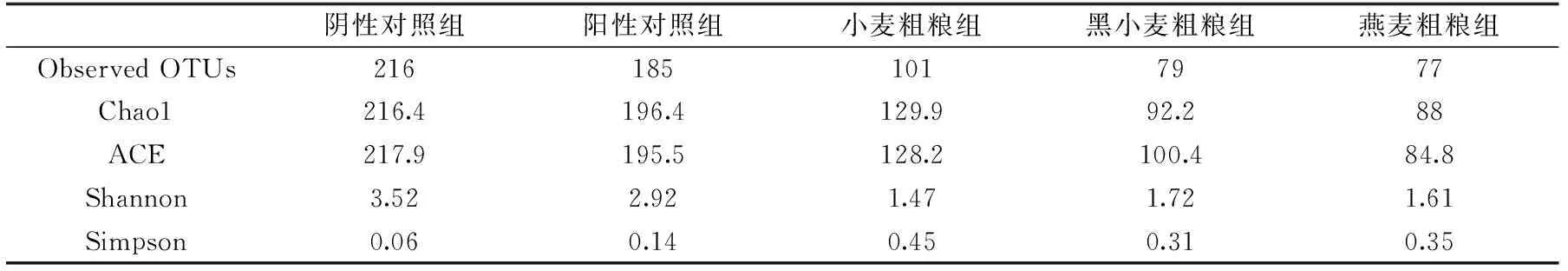
表2 多样性指数Table 2 Diversity index
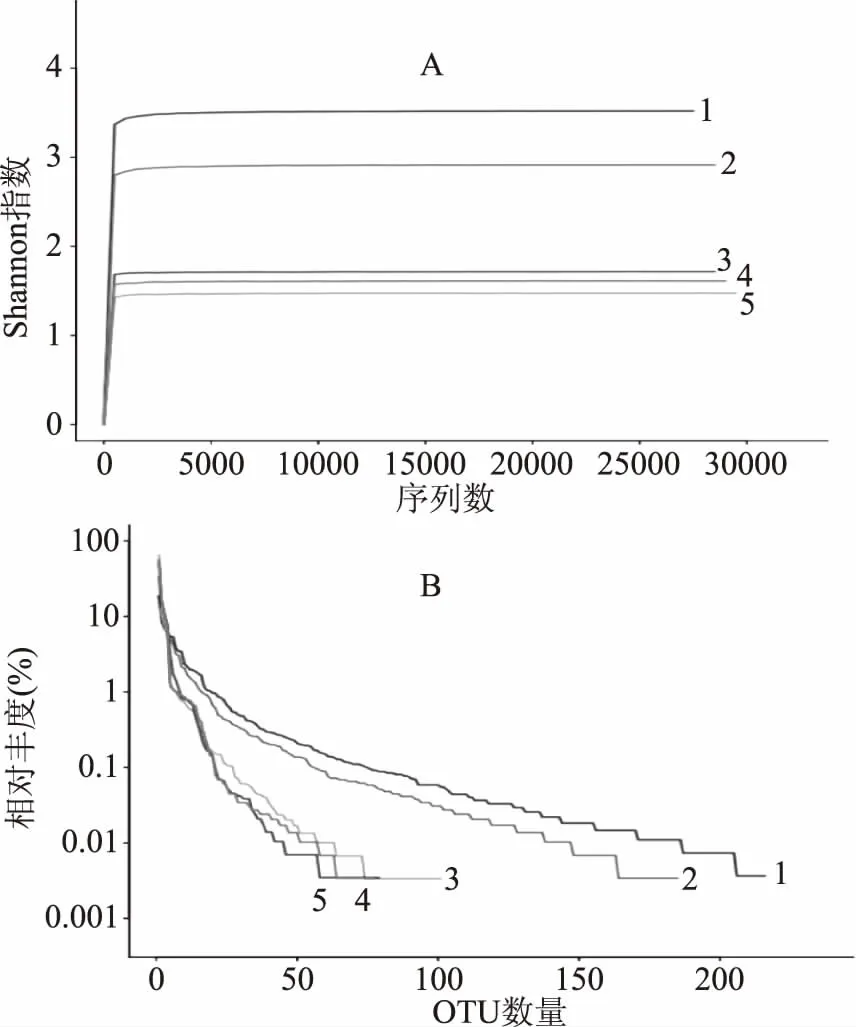
图1 Shannon曲线图(A)和OTU稀释曲线(B)Fig.1 Shannon curves(A)and OTU rank curve(B)注:1阴性对照组;2阳性对照组;3小麦粗粮组;4黑小麦粗粮组;5燕麦粗粮组。
2.3 物种组成分析
物种在门的水平上进行组成分析,结果如图2所示,大肠中肠道菌群主要是由拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)两大类组成,占总细菌的85%以上,其次是变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria),与李旻[20]和Schuurman T等[21]报道相一致。与阴性对照组相比,粗粮发酵后肠道菌群在门的水平组成上发生了显著变化,拟杆菌门(Bacteroidetes)相对丰度下降,厚壁菌门相对丰度升高,可能是麸皮中物质刺激了厚壁菌门生长,抑制了拟杆菌门的生长,这与Zhao等[22]研究结果一致,Zhao用了五种全谷物在体外模拟发酵发现,添加全谷物体外发酵拟杆菌水平下降。与阴性对照组相比(放线菌门相对丰度为0.1%),加入发酵基质后,放线菌门相对丰度升高,低聚果糖组高达6.86%,小麦粗粮、黑小麦粗粮和燕麦粗粮放线菌门相对丰度分别为1.82%、1.29%和2.70%。如图2所示,阴性对照组中细菌总数最少,小麦粗粮组中细菌总数最多,其次是燕麦粗粮组、阳性对照组、黑小麦粗粮组,这表明添加发酵基质后,能够刺激或者维持细菌的生长。
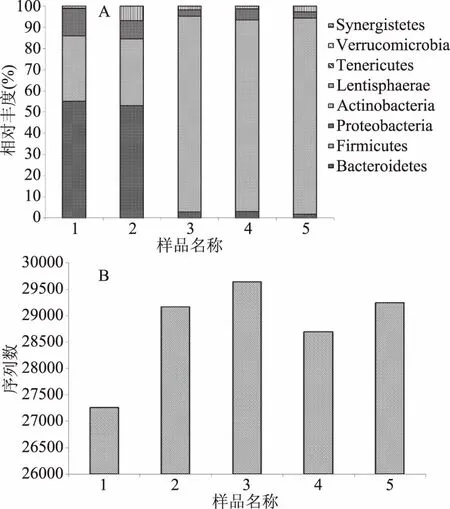
图2 物种门分类水平柱状图(A)与绝对丰度柱状图(B)Fig.2 The taxonomic composition distribution in samples of phylumlevel(A)and absolute abundance of phylumlevel(B)注:1代表阴性对照组;2代表阳性对照组;3代表小麦粗粮组;4代表黑小麦粗粮组;5代表燕麦粗粮组。
体外发酵后对肠道菌群测序结果见图3,由图3A可知,厚壁菌门主要由巨单胞菌属(Megamonas)、巨型球菌属(Megasphaera)、考拉杆菌属(Phascolarctobacterium)、乳酸杆菌属(Lactobacillus)、瘤胃球菌属(Ruminococcus)、粪杆菌属(Faecalibacterium)、布劳特氏菌属(Blautia)、Dorea菌属和颤螺菌属(Oscillospira)组成;添加低聚果糖发酵后,乳酸杆菌属(Lactobacillus)相对丰度最高,达3.5%;小麦粗粮、黑小麦粗粮和燕麦粗粮发酵后乳酸杆菌丰度分别为0.051%、0.003%和0.021%,粗粮组中,小麦粗粮组发酵后乳酸杆菌丰度最高,是其他两种粗粮的2倍,Jose等[23]在肥胖糖尿病小鼠中添加全谷小麦,乳酸杆菌相对丰度比对照组增大了三倍。与阳性对照组相比,粗粮在体外发酵后,巨单胞菌属(Megamonas)和巨型球菌属(Megasphaera)丰度增加,占总细菌丰度的60%以上。从图3B可以看出,拟杆菌门主要由拟杆菌属(Bacteroides)、普斯菌属(Prevotella)和副杆状菌属(Parabacteroides)组成。双歧杆菌(Bifidobacterium)是一种益生菌,由图3C可知,与阴性对照组相比,三种粗粮能增加双歧杆菌的相对丰度(小麦粗粮、黑小麦粗粮和燕麦粗粮双歧杆菌相对丰度分别为1.79%、1.23%和2.62%),这是由于麸皮中有益成分刺激了双歧杆菌的生长,不同麸皮中膳食纤维和植物活性成分的含量以及理化性质的差异,对刺激双歧杆菌的生长会有一定的影响,三种粗粮相比较,燕麦粗粮发酵后,更好地促进了双歧杆菌的生长,这与Zhang和Shen等[2425]研究结果一致,燕麦麸皮和燕麦β葡聚糖能够增加小鼠体内双歧杆菌的生长。

图3 厚壁菌门在属的分类水平柱状图(A)、拟杆菌门在属的分类水平柱状图(B)以及双歧杆菌相对丰度柱状图(C)Fig.3 The taxonomic composition distribution in samples of genuslevel Firmicutes(A),Bacteroidetes(B)and Bifidobacterium(C)注:1阴性对照组;2阳性对照组;3小麦粗粮组;4黑小麦粗粮组;5燕麦粗粮组。
2.4 代谢产物短链脂肪酸(SCFA)分析
发酵48 h后,对主要的短链脂肪酸(乙酸、丙酸和丁酸)进行了定性定量分析。图4为短链脂肪酸的色谱图,用外标法对乙酸、丙酸和丁酸进行定量,结果见表3,由表3可知,添加发酵基质后,产生的乙酸、丙酸和丁酸含量都显著高于(p<0.05)阴性对照组。三种粗粮相比较,小麦粗粮发酵后产生的丙酸含量高于其他两组粗粮,这是因为小麦粗粮发酵后巨单胞菌属和巨行球菌属相对丰度高于其他两组粗粮,而这两种细菌是产丙酸盐的细菌[26],故小麦粗粮发酵后丙酸含量增加。

图4 短链脂肪酸气相色谱图Fig.4 Chromatograms of SCFA
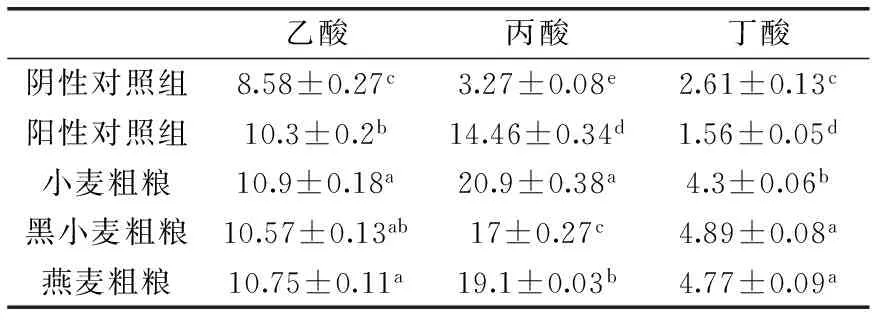
表3 短链脂肪酸含量(mmol/L)Table 3 The content of SCFA(mmol/L)
3 结论
在面粉中添加15%麸皮发酵后,降低了肠道菌群的丰富度和多样性,肠道菌群的组成发生了较大的变化,拟杆菌门相对丰度水平降低,厚壁菌门相对丰度水平升高,产丙酸盐细菌巨单胞菌属和巨型球菌属相对丰度增加,发酵液中短链脂肪酸含量也显著增加(p<0.05);同时粗粮粉发酵后,增大了双歧杆菌和乳酸杆菌的相对丰度,表明在面制品中添加麸皮能够有效的调节肠道菌群,促进肠道中有益菌的增殖。
[1]Chassard C,Dapoigny M,Scott K P,et al. Functional dysbiosis within the gut microbiota of patients with constipatedirritable bowel syndrome[J]. Alimentary Pharmacology & Therapeutics,2012,35(7):828838.
[2]Rigsbee L,Agans R,Shankar V,et al. Quantitative profiling of gut microbiota of children with diarrheapredominant irritable bowel syndrome[J]. The American Journal of Gastroenterology,2012,107(11):17401751.
[3]Cani P D,Bibiloni R,Knauf C,et al. Changes in gut microbiota control metabolic endotoxemiainduced inflammation in highfat dietinduced obesity and diabetes in mice[J]. Diabetes,2008,57(6):14701481.
[4]Biagi E,Candela M,Franceschi C,et al. The aging gut microbiota:new perspectives[J]. Ageing Research Reviews,2011,10(4):428429.
[5]夏围围,贾仲君. 高通量测序和 DGGE 分析土壤微生物群落的技术评价[J]. 微生物学报,2014,54(12):14891499.
[6]崔晨晓. 麸皮的发酵改性及其在馒头中的应用[D]. 无锡:江南大学,2015.
[7]Anderson J W,Baird P,Davis R H,et al. Health benefits of dietary fiber[J]. Nutrition Reviews,2009,67(4):188205.
[8]David L A,Maurice C F,Carmody R N,et al. Diet rapidly and reproducibly alters the human gut microbiome[J]. Nature,2014,505(7484):559563.
[9]蔺艳君,刘丽娅,钟葵,等. 不同来源小麦麸皮营养成分及酚类物质含量的比较[J]. 现代食品科技,2014(12):194200.
[10]Guergoletto K B,Costabile A,Flores G,et al.Invitrofermentation of juçara pulp(Euterpeedulis)by human colonic microbiota[J]. Food Chemistry,2016,196:251258.
[11]赵兰涛. 全谷物对肠道菌群益生作用的研究[D]. 无锡:江南大学,2013.
[12]SánchezPatán F,Cueva C,Monagas M,et al.Invitrofermentation of a red wine extract by human gut microbiota:changes in microbial groups and formation of phenolic metabolites[J]. Journal of Agricultural and Food Chemistry,2012,60(9):21362147.
[13]Roos S,Dicksved J,Tarasco V,et al. 454 pyrosequencing analysis on faecal samples from a randomized DBPC trial of colicky infants treated withLactobacillusreuteriDSM 17938[J]. PLoS One,2013,8(2):e56710.
[14]贾益群,叶福媛,王双,等. 生物样品中短链脂肪酸的快速提取与分析方法[J]. 实验室研究与探索,2012,31(7):262264.
[15]Zhao G,Nyman M,ÅkeJönsson J. Rapid determination of shortchain fatty acids in colonic contents and faeces of humans and rats by acidified waterextraction and directinjection gas chromatography[J]. Biomedical Chromatography,2006,20(8):674682.
[16]顾尧臣. 小宗粮食加工(一)[J]. 粮食与饲料工业,1999(4):1216.
[17]N Balasundram,K Sundram,S. Samman. Phenolic compounds in plants and agriindustrial byproducts:Antioxidant activity,occurrence,and potential uses[J]. Food Chemistry,2006,99(1):191203.
[18]K H Kim,R Tsao,R Yang,et al. Phenolic acid profiles and antioxidant activities of wheat bran extracts and the effect of hydrolysis conditions[J]. Food Chemistry,2006,95(3):466473.
[19]刘晓梅,彭芝榕,倪学勤,等. 低聚果糖、乳酸杆菌对便秘模型大鼠的通便功能影响[J]. 食品科学,2013(11):296299.
[20]李旻. 人体肠道菌群结构与宿主代谢的相关性研究[D]. 上海:上海交通大学,2009.
[21]Schuurman T,de Boer R,Patty R,et al. Comparative evaluation of inhouse manual,and commercial semiautomated and automated DNA extraction platforms in the sample preparation of human stool specimens for a Salmonella enterica 5′nuclease assay[J]. Journal of Microbiological Methods,2007,71(3):238245.
[22]赵兰涛,程李琳,张晖,等. 全谷物体外对肠道菌群影响的研究[J]. 粮食与食品工业,2014,21(1):2433.
[23]GarciaMazcorro J F,Ivanov I,Mills D A,et al. Influence of wholewheat consumption on fecal microbial community structure of obese diabetic mice[J]. PeerJ,2016,4:e1702.
[24]Zhang P P,Hu X Z,Zhen H M,et al. Oatβglucan increased ATPases activity and energy charge in small intestine of rats[J]. Journal of Agricultural and Food Chemistry,2012,60(39):98229827.
[25]Shen R L,Dang X Y,Dong J L,et al. Effects of oatβglucan and barleyβglucan on fecal characteristics,intestinal microflora,and intestinal bacterial metabolites in rats[J]. Journal of Agricultural and Food Chemistry,2012,60(45):1130111308.
[26]Flint H J,Duncan S H,Scott K P,et al. Links between diet,gut microbiota composition and gut metabolism[J]. Proceedings of the Nutrition Society,2015,74(1):1322.

