应用WS/T 514- 2017新标准建立并验证输血前ELISA定性筛查八项的检出限*
岑伟明,梁宝环,黄明兰,黄媛萍,梁越媚,方凤媚,隋 洪
(东莞康华医院,广东东莞 523080)
酶联免疫吸附试验(ELISA)因具有价格低廉、对仪器要求较低、操作相对简便等优点,目前是临床实验室筛选输血前八项,包括乙型肝炎表面抗原(HBsAg)、乙型肝炎表面抗体(HBsAb)、乙型肝炎e抗原(HBeAg)、乙型肝炎e抗体(HBeAb)、乙型肝炎核心抗体(HBcAb)、人类免疫缺陷病毒(HIV)、梅毒螺旋体特异性抗体(TP)和丙型肝炎病毒抗体(HCV)的常规方法。在三级医院评审及ISO15189:2012实验室质量体系和能力的认可中,对试验方法进行方法学性能验证是实验室技术要求中非常重要的一环。CNAS- CL39《实验室质量和能力的认可准则在临床免疫学定性检验领域的应用说明》的条款5.5.1.2中,明确规定检验方法和程序的分析性能验证内容应包括检出限(limit of detection,LoD)、符合率[1]。本实验室根据上述要求,结合实际工作环境,应用2017年卫计委新发布的WS/T 514- 2017:《临床检验方法检出能力的确立和验证》行业标准文件中的概率单位方案对上述项目建立了检出限并进行评价,具体如下:
1 材料和方法
1.1实验样本北京康彻斯坦生物科技有限公司生产的标准物质8种,分别为HBsAg(浓度0.5 IU/ml),HBsAb(浓度30 mIU/ml),HBeAg(浓度2 NCU/ml),HBeAb(浓度4 NCU/ml),HBcAb(浓度1 IU/ml),HIV(浓度0.5 NCU/ml),TP(浓度6 mIU/ml),HCV(浓度1 NCU/ml)。上述试剂盒及标准物质均按说明书要求保存,在有效期内使用。采用北京康彻斯坦生物科技有限公司提供的阴性标准物质进行稀释。
1.2试剂和仪器试剂:国产酶联免疫吸附试验(ELISA)检测HBsAg,HBsAb,HBeAg,HBeAb,HBcAb,HIV,TP和HCV试剂盒,共8种试剂盒,每种试剂均有两个批号的试剂盒。仪器:TECAN SUNRISE酶标仪,上海一恒电热恒温水箱,汇松全自动酶标洗板机PW- 960。所有仪器均按ISO15189质量体系要求进行校准。
1.3评价方法
1.3.1LoD的建立:根据卫生行业标准WS/T 514- 2017:《临床检验方法检出能力的确立和验证》中的概率单位方案设计实验方案。
1.3.1.1按一定倍数稀释已知浓度标准物质,每个稀释度的标本严格按照试剂说明书进行实验操作,重复测定三次,取S/CO平均值为1附近的浓度值,根据其S/CO平均值来确定5个评估浓度值。在同一套检测系统中,使用2个试剂批号连续4天对这5个评估浓度值标本,每个批号每个标本每天重复检测5次。
1.3.1.2选择估计LoD的β错误风险为0.05,即命中率为95%,对应的概率单位为1.645。
1.3.1.3收集数据,计算每个批号的5个评估浓度值标本的命中率,根据《百分比与概率单位对照表》将其转换为概率单位,然后以此为横坐标,以浓度值的对数值为纵坐标绘制散点图,制作回归模型,得到回归曲线方程,将命中率为95%对应的概率单位1.645代入方程式中,所得的浓度值即为LoD估计值。
1.3.1.4将两个试剂批号的LoD估计值作比较,取所得的LoD估计值的最大值作为测量程序的最终LoD估计值。
1.3.2LoD的验证:根据卫生行业标准WS/T 514- 2017:《临床检验方法检出能力的确立和验证》中的“LoD声明的验证”部分的要求,设计实验方案如下:连续3天检测对2个LoD声明浓度附近的标本(由标准物质稀释所得)重复检测4次,所有数据来源于1个仪器系统和1个批号的试剂。收集数据进行统计,计算≥LoD声明的阳性结果百分比,将该百分比与WS/T 514- 2017:《临床检验方法检出能力的确立和验证》中的附录E“测量结果总数与临界值观察比例对照表”中对应的临界值(本次实验的条件下,该临界值为87%)比较,若该百分比≥临界值,则验证成功,否则验证失败。
1.4统计学分析所有数据均用EXCEL表进行记录及计算处理。
2 结果
2.1检出限的建立过程及结果
2.1.1稀释标准物质,测得S/CO值为1附近的浓度:HBsAg 0.10 IU/ml(S/CO值为1.09),HBsAb 10.0 mIU/ml(S/CO值为1.06),HBeAg 0.67 NCU/ml(S/CO值为1.01),HBeAb 3.50 NCU/ml(S/CO值为1.06),HBcAb 0.80 IU/ ml(S/CO值为0.97),HCV 0.50 NCU/ml(S/CO值为1.03),TP 2.00 mIU/ml(S/CO值为0.94)和HIV 0.13 NCU/ml(S/CO值为1.09)。根据上述结果,选择各项目的评估浓度为HBsAg(IU/ml):0.092,0.094,0.096,0.098,0.100;HBsAb(mIU/ml):8,8.5,9,9.5,10;HBeAg(NCU/ml):0.60,0.62,0.64,0.66,0.68;HBeAb(NCU/ml):3.50,3.55,3.60,3.65,3.70;HBcAb(IU/ml):0.72,0.74,0.76,0.78,0.80;HCV(NCU/ml):0.42,0.44,0.46,0.48,0.50;TP(mIU/ml):2.00,2.05,2.10,2.15,2.20;HIV(NCU/ml):0.110,0.115,0.120,0.125,0.130。
2.1.2各项目各浓度测定命中率及LoD估计值:见表1及表2。
根据表1和表2的结果,将两个批号试剂的LoD作比较,取所得的LoD最大值作为测量程序的最终LoD估计值,得出各个项目的LoD估计值为:HBsAg:0.100 IU/ml,HBsAb:9.642 mIU/ml,HBeAg:0.666 NCU/ml,HBeAb:3.700 NCU/ml,HBcAb:0.786 IU/ml,HCV:0.506 NCU/ml,HIV:0.135 NCU/ml,TP:2.236 mIU/ml。
2.2检出限的验证见表3。
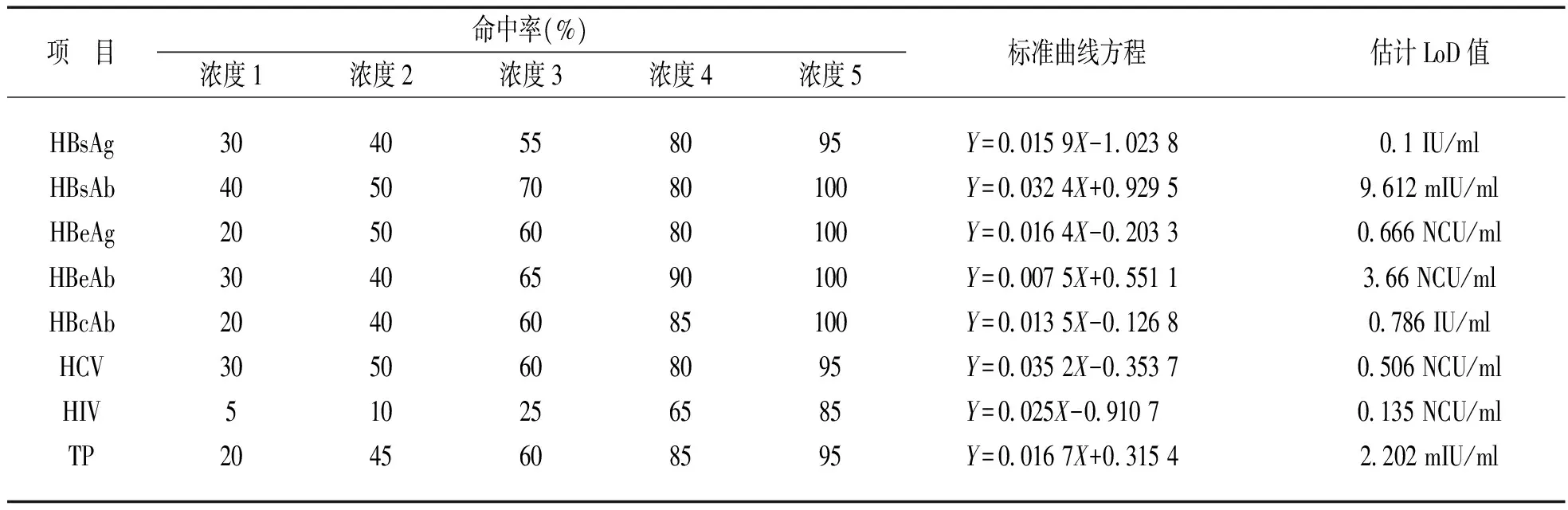
表1 各项目批号1测试结果

表2 各项目批号2测试结果

表3 各项目LoD估计值验证结果
3 讨论
临床输血是临床治疗的重要组成部分,是抢救的重要手段之一,但输血的同时也会传播危害极其严重的疾病[2],其中最严重的是艾滋病、病毒性乙型肝炎和丙型肝炎。为减少和避免医院感染和医疗纠纷,输血前对患者进行上述病毒的检测显得十分重要[3]。为此,临床实验室对其检验方法和程序的分析性能合理选择方法学验证试验,系统设计方法学验证方案,以保证实验结果的准确性。
评价实验室检验方法的检出能力的性能指标主要有空白限(limit of blank,LoB)及检出限。以往测定检出限的方案是以健康人群血清为空白样本做重复测定,计算这些结果的平均值及标准差,以平均值加3个标准差作为LoD值,这种方案由于其没有区分统计数据是否为正态分布或偏态分布,容易引起统计错误而被淘汰。美国临床实验室标准化委员会(CLSI)在2004年发布的《确定检出低限和定量检测限的方案》(EP17- A)[4]文件推荐用空白及系列低浓度的样本连续数天检测至少60次,并根据数据为正态分布或偏态分布分别采用不同的公式来计算空白限、检出限,结果更加可靠,国内外学者以此作为标准对不同项目检出限进行建立及验证[5~7],但CLSI EP17- A文件的方案在操作上更适用于定量检验程序,对于定性检验程序在2017年以前国内并没有适用的完整而标准的检出限建立及验证方法标准文件。2017年1月15日卫计委发布了卫生行业标准WS/T 514- 2017:《临床检验方法检出能力的确立和验证》,对检出限的建立及验证起到了极其重要的指导作用,其中的概率单位方案[8]适用于检出能力以比例(阳性结果数/重复检测的总数)的形式表示的定性检验程序,由于这种检验程序没有阴性标本结果的分布,因为此类结果通常报告为0,这种情况下,空白标本检测结果的第95百分位数为0,LoB是测量空白标本时可能得到的最高检出结果[9],按定义设为0,故本次验证中无LoB的内容。LoD是检测方法可以检测出的最低被测物浓度[10],本文根据最新的行业标准文件的要求建立了相关项目的LoD估计值,并对这些LoD估计值进行了验证,验证结果通过,表明各个项目在检测对应的检出限浓度以上的标本时,可以为临床提供稳定可靠的结果。
另外需要说明的是,WS/T 514- 2017:《临床检验方法检出能力的确立和验证》行业标准有关LoD声明验证的条款中,仅说明“使用2个LoD声明浓度附近的标本”,并没有明确要求验证标本浓度的合适范围,让人困惑。本次评估根据实验室的实际情况选择了比LoD声明浓度值高5%左右的浓度值进行验证。此方法恰当与否,欢迎各位同行讨论及指正。
参考文献:
[1]中国合格评审国家认可委员会.CNAS- CL39:2012《医学实验室质量和能力认可准则在临床免疫学定性检验领域的应用说明》[S].北京:CNAS- CL39,2013.
China National Accreditation Service for Conformity Assessment.Guidance on the application of accreditation criteria for the medical laboratory quality and competence in the field of clinical immunology[S].Beijing:CNAS- CL39,2013.
[2]任立明.浅谈输血感染和输血安全[J].中国卫生产业,2017,14(12):28- 29.
Ren LM.Talk about blood transfusion and safety of blood transfusion[J].China Health Industry,2017,14(12):28- 29.
[3]孙桂香,吴月清.1 026例输血前患者血HBsAg,抗HCV,抗HIV和梅毒抗体检测结果分析[J].标记免疫分析与临床,2015,22(1):18- 19.
Sun GX,Wu YQ.Analysis of infectious disease test results before transfusion among 1 026 patients[J].Labeled Immunoassays and Clinical Medicine,2015,22(1):18- 19.
[4]Clinical and Laboratory Standards Institute.Evaluation of detection capability for clinical laboratory measurement procedure;approved guideline- second edition[S].Wayne:PA,CLSI EP17- A2,2012.
[5]谭丽娜,杨泽华,赵克斌.酶联免疫法检测血清乙型肝炎表面抗原的空白限、检出限及定量限的建立与评价[J].中国药物与临床,2013,13(2),144- 146.
Tan LN,Yang ZH,Zhao KB.The establishment and evaluation of limit of blank,limit of detection and limit of quantitation for detection of serum hepatitis B surface antigens by enzyme- linked immunosorbent assay[J].Chinese Remedies & Clinics,2013,13(2):144- 146.
[6]Moretti M,Pieretti B,Sisti D,et al.Analytical performance and clinical decision limit of a new release for cardiac troponin I assay[J].Ann Clin Biochem,2015,52(Pt 1):169- 72.
[7]郭绪晓,柏淑美,张春来,等.基于EP- 17 A2的胶体金法检测粪便隐血的空白限、检出限及定量限的建立及评价[J].现代医学检验杂志,2015,30(1):78- 81.
Guo XX,Bai SM,Zhang CL,et al.Establishment and evaluation of blank limit,detection limint and quantitation limit of fecal occult blood tests with colloidal gold method based on the document of EP- 17 A2[J].Journal of Modern Laboratory Medicine,2015,30(1):78- 81.
[8]中华人民共和国国际卫生和计划生育委员会.WS/T 514- 2017.临床检验方法检出能力的确立和验证[S].北京:中国标准出版社,2017:8- 9.
National Health and Family Planning Commission of the People’s Republic of China.WS/T 514- 2017.Establishment and verification of detection capability for clinical laboratory measurement procedures[S].Beijing:Standards Press of China,2017:8- 9.
[9]康凤凤,王薇,王治国.临床实验室检测方法空白限、检出限和定量限评价新方法[J].中国卫生统计,2014,31(5):901- 904.
Kang FF,Wang W,Wang ZG.The new way evaluation of limit of blank,limit of detection and limit of quantitation in the clinical laboratory[J].Chinese Journal of Health Statistics,2014,31(5):901- 904.
[10]杨有业,张秀明.临床检验方法学评价[M].北京:人民卫生出版社,2008:142- 167.
Yang YY,Zhang XM.The methodology evaluation guide in clinical laboratory[M].Beijing:People’s Medical Publishing House,2008:142- 167.

