基于MGB探针法荧光PCR检测手足口病病原的研究*
许先凯,邱鸿杰,卢秋梅
(1.汕头市龙湖区动物防疫监督所,广东汕头 515041;2.广州市药品检验所,广州 510160)
手足口病(hand- foot- mouth disease,HFMD)是一种具有较高传染性的传染病,由肠道病毒引起的疾病,为全球性传染病。多发于5岁以下儿童,3岁以下的儿童发生率最高。可引起手、足、口腔等部位皮肤斑丘疹、疱疹、溃疡,个别患者可引起心肌炎、肺水肿和无菌性脑膜炎等并发症[1],甚至导致死亡。
引发手足口病的肠道病毒有20多种(型),包括肠道病毒71型(enterovirus71,EV71),柯萨奇病毒A组(coxsackievirus A)4,5,9,10,16型等,其中以柯萨奇病毒A组的16型(Cox A16)和EV71型最为常见[2]。近年手足口病感染率呈上升趋势,连续数年成为我国传染病发病率最高的病种之一,对我国儿童的健康造成严重危害,研发出一种高灵敏度、准确度、特异度的检测方法,对手足口病防治与治疗显得尤为重要[3]。
传统的病毒检测方法有病毒分离、血清学检测和常规PCR检测,病毒分离法周期长,血清学检测法容易发现交叉反应,常规PCR检测易发生污染等问题,现已较少用于临床。近年来,伴随着分子技术的发展,采用荧光定量RT- PCR技术对肠道病毒进行诊断国内外已有报道,该方法具有快速、灵敏、准确以及自动化程度高的特点,适用于传染性病毒的检测[4]。由于RNA病毒基因组的高度变异率,针对CA16病毒、EV71病毒及其它肠道病毒基因组设计的引物及探针都具有一定的时效性,需要不断更新。本实验对手足口病病毒检测方法的研究,为快速检测诊断手足口病病原体奠定基础[5~7],有利于减少该病的传染,保护我国儿童生命健康。
1 材料与方法
1.1研究对象手足口病病原菌由疾病预防控制中心提取及保存;大肠埃希菌DH10由实验室保存。
1.2试剂和仪器pUC19 T载体、Taq酶、反转录酶、DNA Marker DL 2000,DNA纯化回收试剂盒、质粒提取试剂盒(离心柱型)等均为上海生物工程有限公司产品。ABI 7500 荧光PCR仪为Applied Biostems公司产品;紫外可见分光光度计为北京普析通用仪器有限公司产品。
1.3方法
1.3.1引物和探针设计:在NCBI数据库中搜索并选择中国大陆近期流行EV71型,CA16型及其它肠道病毒基因序列,采用DNAstar软件进行序列比对,选择肠道病毒序列的共同保守区设计引物和探针序列,引物和探针序列如下所示:上游引物EVUN- F 5’- GACTACTTTGGGTGTCCGTG- 3’;下游引物EVUN- R 5’- GCCAATCCAATAGCTATATG- 3’;EVUN- B:MGB探针CY5 5’- GTCACCATAAGCAGCCA- 3’MGB。
1.3.2一步法RT- PCR扩增:反应条件:42℃30 min,95℃3 min;95℃5 s,60℃35 s,45个循环。反应结束后,取5 μl PCR产物于12 g/L琼脂糖凝胶进行电泳鉴定。
1.3.3EVUN质粒标准阳性模板的制备
1.3.3.1EVUN目的基因的纯化回收:将以上PCR产物于12 g/L琼脂糖凝胶电泳后,紫外灯下切回目的片段,按照PCR产物纯化试剂盒说明操作,回收目的DNA,置于-20℃保存备用。
1.3.3.2目的基因的克隆及鉴定:将回收的DNA片段基因克隆到pUC19克隆载体上,然后将连接产物转化入感受态细胞DH10中。挑取单个菌落扩大培养,收集菌液,用高纯质粒小量制备试剂盒提取质粒进行PCR及琼脂糖凝胶鉴定,最后将阳性质粒送到上海英维捷基贸易有限公司测序鉴定。
1.3.3.3EVUN重组质粒浓度的测定:利用可见分光光度计测定阳性重组质粒的浓度,并计算其拷贝数。
1.3.4实时荧光定量PCR检测方法的研制
1.3.4.1实时荧光定量PCR方法反应条件的优化:以标准阳性质粒为模板,已合成的EVUN基因引物和探针,选用不同的引物探针浓度和退火温度进行PCR反应,根据PCR反应结果,选择最佳的荧光PCR反应条件。
引物浓度优化:在其它条件相同情况下,比较不同引物探针浓度对荧光PCR扩增效率影响,具体方案见表1。

表1 EVUN引物浓度优化方案(μmol/L)
PCR反应程序优化方案:在其它条件相同情况下,设计不同(55℃,58℃,60℃,63℃,65℃)退火温度,比较不同退火温度对荧光PCR扩增效率影响。
1.3.4.2标准曲线的制备:以8×108,8×107,8×106,8×105,8×104,8×103和8×102copies/μl 7个标准品作为模板,进行荧光定量PCR扩增,构建标准曲线。
1.3.4.3重复性试验:选取浓度为8×102copies/μl的阳性标准质粒,重复检测5次,根据检测的Ct值计算变异系数,判定该检测方法的重复性是否良好。
1.3.4.4特异性试验:用RNA提取试剂盒提轮状病毒株、口蹄疫灭活毒株两种病毒RNA,将其RNA作为特异性对照,进行荧光定量PCR检测。
1.3.4.5临床样品:以预防控制中心的26例手足口病患者RAN为模板,和10份健康人RNA作为阴性对照,进行荧光定量RT- PCR检测。
1.4统计学分析采用SPASS17.0统计学软件计算Ct值变异系数,CV≤5%为差异具有统计学意义。
2 结果
2.1目的基因的克隆与鉴定PCR产物经回收后,与pUC19克隆载体连接构成重组质粒,用引物对所构建的质粒进行PCR扩增验证,得到一条约120 bp(EVUN基因片段)DNA条带,与连接前的PCR产物大小一致。将经PCR鉴定的阳性重组质粒送至上海生物工程有限公司进行测定鉴定。鉴定结果与目的片段序列完全一致。
2.2实时荧光定量PCR检测方法的建立
2.2.1荧光定量PCR反应条件的优化:优化后的荧光定量PCR反应体系为20 μl,上游引物EVUN- F,下游游引物EVUN- R和探针EVUN- B终浓度分别为0.50 μmol/L,0.50 μmol/L,0.30 μmol/L,Mg离子终浓度为0.25 mmol/L,dNTP终浓度为0.30 mmol/L。
优化后荧光定量PCR反应条件:42℃30 min,95℃3 min;95℃5 s,58℃40 s,45个循环,在60℃接收荧光。
2.2.2按照以上最佳的优化条件选择:8×108,8×107,8×106,8×105,8×104,8×103,8×102copies/μl 7个梯度浓度的标准质粒作为标准曲线试验模板,见图1。
试验结果显示,随着模板浓度的减少,Ct值逐渐增大,检测曲线线型良好,r2值达到0.99,检测的灵敏度达到800 copies/μl。
2.2.3重复性试验结果分析:试验选取8×102copies/μl的标准模板以优化的反应条件分别连续
扩增5次,Ct值批内和批间变异系数(Coefficient of variation,CV)CV<5%(表2),检测结果表明:所建立的实时荧光定量PCR检测方法重复性良好。
2.2.4特异性试验结果:以轮状病毒株和口蹄疫灭活毒株为对照,进行实时荧光定量PCR检测,检测结果为阴性,表明特异性良好。
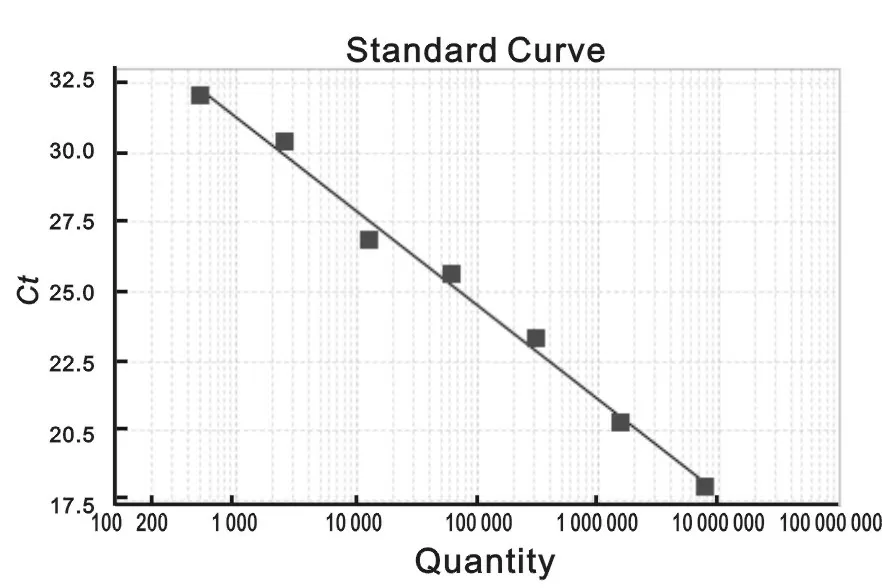
图1 EVUN基因片段实时荧光定量PCR方法的标准曲线试验
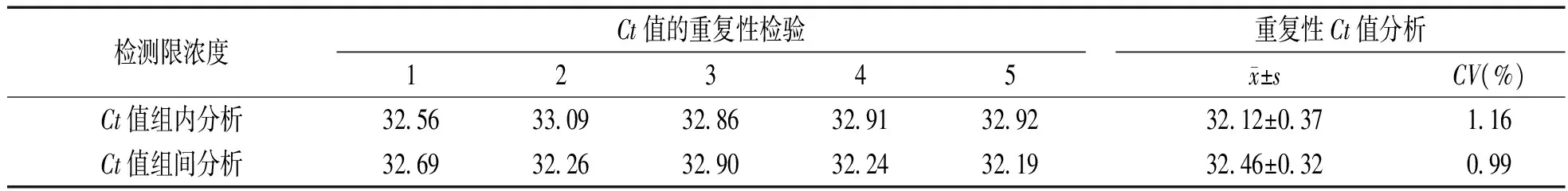
表2 实时荧光RT- PCR的重复性实验
2.3临床检测结果见表3。以预防控制中心的26例手足口病患者RNA为模板,并做10份阴性对照,进行荧光定量RT- PCR检测,检测结果显示:手足口病患者检测结果为阳性,阴性样本检测结果为阴性,检测结果与实际诊断结果一致,检测准确率达100%。

表3 临床检测结果
3 讨论
手足口病病原主要包括CA16型、EV71型及其它肠道病毒,不同肠道病毒基因之间具有一定的同源性,试验选取了肠道病毒基因的一段高度保守序列作为目的基因检测片段,从而避免了漏检问题[5]。根据不同荧光定量PCR检测标记方法,分为荧光探针法和荧光染料法,荧光探针法除了特异引物外,还增加了特异性的荧光探针检测,从而提高了特异性和准确度,更适合临床诊断和科学研究的需要[6~8]。MGB探针的淬灭基团采用非荧光淬灭基团,本身不产生荧光,可以大大降低本底信号的强度,避免干扰;同时探针上连接有MGB修饰基团,可以将探针的Tm值提高10℃左右,因此在相同的Tm值条件下,MGB探针可以比普通TaqMan探针设计的更短,更有利于设计出保守的探针序列,从而提高检测灵敏度和准确度,弥补了检测方法的不足[9~11]。
今年以来,全国手足口病发病率上升,部分省份呈现高发态势,死亡人数上升。手足口病病原检测试剂盒的开发,有利于手足口病患者及时检测诊断,做到早发现、早诊断、早治疗,是防治手足口病的关键[12,13]。一步法荧光PCR检测,可同时检测EV71型、CA16型和其它肠道病毒,缩短了检测时间,节约成本,与常规的检测方法相比,具有很大的优势,可适用于手足口病临床诊断,同时也为检测手足口病病原的研究奠定基础。
参考文献:
[1]Hwang S,Kang B,Hong J,et al.Development of duplex real- time RT- PCR based on Taqman technology for detecting simultaneously the genome of pan- enterovirus and enterovirus 71[J].Journal of Medical Virology,2013,85(7):1274- 1279.
[2]解娟,袁军,张艳,等.血清淀粉样蛋白A(SAA)在儿童手足口病中的临床应用[J].现代检验医学杂志,2016,31(6):102- 104.
Xie J,Yuan J,Zhang Y,et al.Clinical application of serum amyloid a(SAA) in children with hand foot and mouth disease[J].Journal of Modern Laboratory Medicine,2016,31(6):102- 104.
[3]Sun LL,Wang JK,Cui XQ,et al.Association of viral replication capacity with the pathogenicity of enterovirus 71[J].Virus Res,2014(189):1- 7.
[4]Yan XF,Gao S,Xia JF,et al.Epidemic characteristics of hand,foot,and mouth disease in Shanghai from 2009 to 2010:Enterovirus 71 subgenotype C4 as the primary causative agent and a high incidence of mixed infections with coxsackievirus A16[J].Scandinavian Journal of Infectious Diseases,2012,44(4):297- 305.
[5]Yi EJ,Shin YJ,Kim JH,et al.Enterovirus 71 infection and vaccines[J].Clinical and Experimental Vaccine Research,2017,6(1):4- 14.
[6]Zhang LJ,Huang GL,Cai QX,et al.Optimize the interactions at S4 with efficient inhibitors targeting 3C proteinase from enterovirus 71[J].Journal of Molecular Recognition,2016,29(11):520- 527.
[7]Zhang YJ,Mao HY,Yan JY,et al.Development of no- vel all Glo- probe- based one- step multiplex qRT- PCR assay for rapid identification of avian influenza virus H7N9[J].Arch Virol,2014,159(7):1707- 1713.
[8]陈勉乔,于浩洋,卢秋梅,等.EV71- CA16肠道病毒荧光定量RT- PCR诊断试剂盒的研制[J].现代检验医学杂志,2015,30(6):73- 76.
Chen MQ,Yu HY,Lu QM,et al.Development of EV71- CA16 enterovirus fluorescence qualitative RT- PCR diagnostic kit[J].Journal of Modern Laboratory Medicine,2015,30(6):73- 76.
[9]Yang TC,Xu GZ,Dong HJ,et al.A case- control study of risk factors for severe hand foot mouth disease among children in Ningbo,China,2010- 2011[J].European Journal of Pediatrics,2012,171(9):1359- 1364.
[10]Xing W,Liao Q,Viboud C,et al.Hand,foot and mouth disease in China,2008- 12:an epidemiological study[J].Lancet Infect Dis,2014,14(4):308- 318.
[11]于浩洋,陈勉乔,邵曼.用于检测肠道病毒的核酸及其应用.中国,201410251945.0[P].食品伙伴网知识产权服务中心,2015- 05- 06.
Chen HY,Chen MQ,Shao M.Application for detection of enteroviruses nucleic acid:China,201410251945.0[P].Foodmate IPr service Center,2015- 05- 06.
[12]Wang Y,Zou G,Xia AM,et al.Enterovirus 71 infection in children with hand,foot,and mouth disease in Shanghai,China:epidemiology,clinical feature and diagnosis[J].Virology Journal,2015,12(1):83.
[13]Ben- Chetrit E,Wiener- Well Y,Shulman LM,et al.Coxsackievirus A6- related hand foot and mouth disease: skin manifestations in a cluster of adult patients[J].J Clin Virol,2014,59(3):201- 203.

