响应面法优化蛋壳内膜酶解制备抑菌活性物质的工艺条件
牛明福,杜梦璇,张婷婷,李亚恒,宫 强,秦翠丽,侯 颖,李 阳
(河南科技大学食品与生物工程学院微生物资源开发与利用重点实验室,河南洛阳471023)
蛋壳由蛋外壳与蛋壳内膜两部分组成,两者都具有多种有效成分(何柳,2012),是丰富的钙资源和蛋白资源,可作为食品、饲料、化学、轻工、医药等相关行业的宝贵原材料 (白鑫华,2017;Preetam和Somenath,2016;Eletta,2016)。 蛋外壳主要成分为碳酸钙,蛋壳内膜的主要成分是蛋白质,类似细胞膜蛋白质的组成,以糖蛋白的形式存在,蛋壳膜约含90%蛋白质 (角蛋白、胶原蛋白、复合蛋白等)(Mohammadi,2016;刘焱,2014;周艳华,2010)。 研究表明,蛋壳膜中胶原蛋白可代替食品中动物胶原蛋白(任萌,2012;Zhao,2009;Long,2004),所以蛋壳膜应用于食品、化妆品或其他行业的潜力巨大,也是多肽或氨基酸的极好来源(Shi,2104)。
多肽的制备途径和方法有很多,酶解法反应速度快、条件温和、氨基酸不会被破坏,构型不会发生改变,操作易于控制,不会对环境造成污染,而且能够保证多肽的天然活性(Sarbjeet,2015;汪宝欢,2009;张娴,2007)。本试验首先用不同的蛋白酶酶解蛋壳内膜制备蛋膜酶解液,检测其抑菌活性,为了得到更好的试验效果和最优的酶解工艺条件,进一步应用Box-Behnken中心组合设计和响应面分析法(RSM)(Reza,2016;刘琼,2016;李莉,2013),以蛋壳内膜酶解液对肠炎沙门氏菌(S.enteritidis)的抑菌圈直径为响应值,对蛋壳内膜酶解条件进行优化,以期获得最佳酶解工艺条件,同时对蛋壳内膜的开发利用提供一定的理论依据和参考。
1 材料与方法
1.1试验材料 鸡蛋壳采自学校蛋糕房;碱性蛋白酶(≥200 U/mg)、中性蛋白酶(≥60 U/mg)、胰蛋白酶(4 ~ 6 U/mg)、木瓜蛋白酶(0.5 ~ 2 U/mg)购自上海源叶生物科技有限公司;抗生素对照品恩诺沙星(Enrofloxacin,ENR)购自国家标准物质中心;鸡大肠埃希氏菌(Chicken E.coli)、金黄色葡萄球菌(S.aureus)、铜绿假单胞菌(P.aeruginosa)、鸡肠炎沙门氏菌(S.enteritidis)、痢疾志贺氏菌(S.dysenteriae)、嗜水汽单胞菌(A.hydrophila)、产肠毒大肠埃希氏菌(Enterotoxigenic E.coli)、禽多杀性巴氏杆菌(P.multocida)为实验室保藏菌种。
1.2试验方法
1.2.1蛋壳内膜粉的制备 新鲜鸡蛋壳 (清洗蛋壳上污物及残余蛋清)→手剥蛋壳得蛋壳内膜→置70℃烘箱6 h→粉碎机粉碎 (80目筛)→蛋壳内膜粉,于干燥瓶中储存备用。
1.2.2酶解液的制备 取一定量的蛋壳内膜粉加入PBS溶液中,添加适量的NaOH,90℃水浴20 min,冷却至室温,调整pH,加入适量蛋白酶,在适当温度下酶解数小时,并维持酶解液pH基本不变,反应完毕后于90℃水浴10 min进行灭酶处理。灭酶后的酶解液12000 r/min离心10 min,上清用0.45 μm滤膜过滤得粗酶解液(史雅凝,2015)。
1.2.3蛋白酶的筛选 蛋壳膜中主要是胶原蛋白、角蛋白等硬性蛋白,难溶于水,预试验发现,蛋壳内膜质量分数为2%时,通过NaOH处理完后溶液呈透明状,黏度较小,较适合于后续的酶解试验,因此后面的酶解试验均使用NaOH预处理的质量分数为2%的蛋壳内膜。称取等量的蛋壳内膜粉分别置于4个锥形瓶中,NaOH预处理后,在不同蛋白酶各自最适温度和pH条件下(具体酶解条件见表1),分别添加同等量的碱性蛋白酶、中性蛋白酶、木瓜蛋白酶和胰蛋白酶,对蛋壳内膜酶解4 h,90 ℃灭酶10 min,12000 r/min离心10 min,上清用0.45 μm滤膜过滤得各酶解液,采用牛津杯法(佘之蕴等,2016)测定各种蛋白酶酶解液的抑菌活性,选择酶解效果最好的蛋白酶。
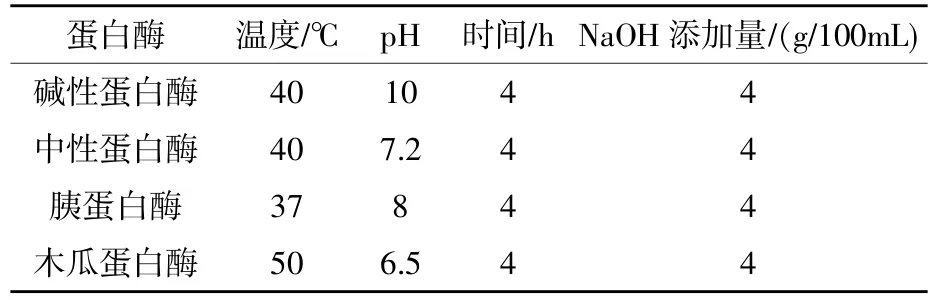
表1 各种蛋白酶的酶解条件
1.2.4单因素试验 参照李鑫(2013)的方法并加以改进进行单因素试验,以2%蛋壳内膜为底物,选择NaOH添加量、酶添加量、酶解温度、酶解时间及酶解pH五因素,各因素梯度见表2,以对S.enteritidis的抑菌效果为指标,筛选较合适的酶解条件范围。
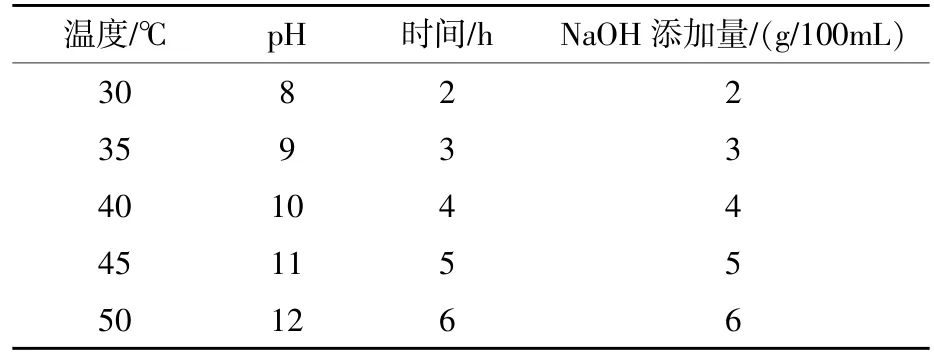
表2 酶解条件的单因素试验
1.2.5响应面分析因素及水平的确定 在单因素试验基础上,以抑菌圈直径Y为响应值,利用Design Expert 8.0.6软件的Box-Behnken中心组合设计法对酶解温度(A)、酶解时间(B)、酶用量(C)、pH(D)设计四因素三水平响应面试验进行优化分析(表 3)(杨莹莹等,2012;黎元生,1996)。

表3 响应面试验因素与水平
1.2.6蛋壳内膜酶解液抑菌活性成分的初步确定将蛋壳内膜碱性蛋白酶酶解液12000 r/min离心10 min,取上清0.45 μm滤膜过滤,滤液加入2倍体积无水乙醇沉淀过夜,12000 r/min离心10 min,上清蒸发除去乙醇(标记为①),沉淀用水溶解,加入等体积10%TCA溶液,再静置2 h,12000 r/min离心10 min,离心后的上清液即为含多糖的溶液(标记为②),沉淀用适量PBS溶液溶解后即为含多肽的溶液(标记为③),仍采用牛津杯法,恩诺沙星(ENR)做阳性对照,检测样品①、②、③对S.enteritidis的抑菌活性(胡徐登等,2015)。
1.3数据处理 所有数据均为3次重复试验的平均值,并表示为“平均值±标准差”,单因素试验数据运用 Origin7.5软件绘制曲线图;响应面试验采用 Design-Expert 8.0.6软件进行方差分析,并优化出最佳提取工艺。
2 试验结果与讨论
2.1蛋壳内膜酶解的单酶筛选 由表4可知,碱性蛋白酶和中性蛋白酶酶解液对禽大肠埃希氏菌、金黄色葡萄球菌、铜绿假单胞菌、痢疾志贺氏菌、肠炎沙门氏菌、嗜水气单胞菌、产肠毒大肠埃
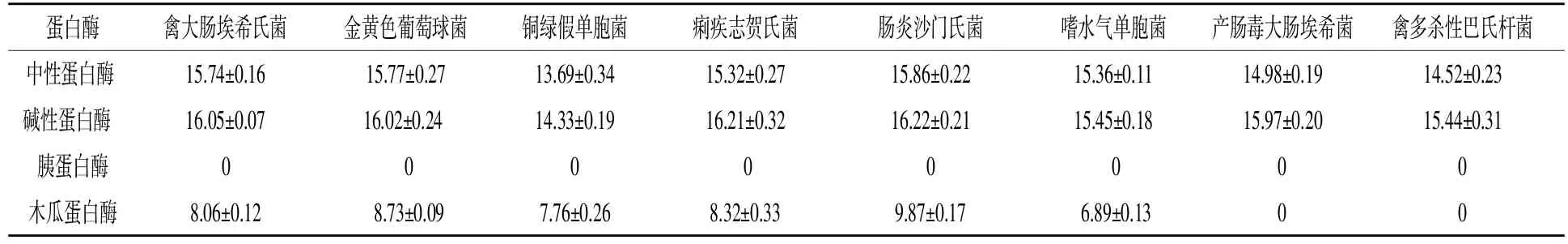
表4 不同酶解液的抑菌结果
希氏菌和禽多杀性巴氏杆菌均有抑菌效果,木瓜蛋白酶酶解液对产肠毒大肠埃希氏菌和禽多杀性巴氏杆菌没有抑菌效果,胰蛋白酶解液对所有菌都没有抑菌效果,这可能是不同蛋白酶的酶切位点不同,所得酶解液中的成分也不同所致。不同蛋白酶酶解液对肠炎沙门氏菌的抑菌效果比其他几种菌都好,基于上述抑菌试验结果,以对肠炎沙门氏菌的抑菌圈直径大小为指标,选用碱性蛋白酶进行单因素试验及优化试验,以获得具有最好抑菌活性的蛋壳内膜酶解液。
2.2酶解单因素试验 由图1可以看出NaOH浓度为4%时酶解液的抑菌圈直径最大;温度为30~45℃时,随着温度的升高,抑菌圈直径呈现增长趋势;当温度达到45℃时,抑菌圈直径几乎是最大值;当温度为50℃后,抑菌圈直径明显变小,说明温度可能会影响碱性蛋白酶的活性,酶解温度为40℃和45℃时的抑菌圈直径差异不显著(P>0.05)。当酶解时间为1~3 h,抑菌圈直径趋于增大,抑菌效果有明显提高,3 h后抑菌圈直径趋于平稳,变化不明显,4 h和5 h的抑菌圈直径与3 h的差异不显著(P>0.05)。随着加酶量的逐渐加大,酶解液抑菌圈直径逐渐增大,超过40 U/mg后不再增大,50 U/mg与40 U/mg加酶量的抑菌圈直径差异不显著(P>0.05)。抑菌圈直径随pH的增大先上升后下降,pH是影响蛋白酶活性的重要因素,当pH低于10时,可能未达到碱性蛋白酶的最佳催化效果,而当pH超过10时,又会影响蛋白酶自身的结构和活性,使酶的催化能力受到一定程度的抑制,pH 9和pH 11的抑菌圈直径与pH 10的差异显著 (p<0.05)。综上可知,单因素酶解的较适条件为:NaOH 4%,酶解温度45℃,酶解时间3 h,加酶量 40 U/mg,pH 10。
2.3响应面法优化试验结果
2.3.1响应面试验结果 利用Design Expert 8.0.6分析软件,采用Box-Behnken中心组合设计法及响应面分析法,探讨A-酶解温度、B-酶解时间、C-酶用量、D-pH及其交互作用对鸡蛋壳内膜蛋白酶酶解液抑菌效果的影响。21个试验点分为析因点和零点,试验号 2、4、7、14、21 是中心试验点(零点),其中析因点为自变量取值在 A、B、C、D所构成的三维顶点;零点为区域的中心点,零点试验重复5次,用以估计试验误差。响应面试验结果与分析如表5所示,响应面数据方差分析结果见表6。
2.3.2响应面模型的建立及显著性检验 根据表5试验结果,运用Design Expert 8.0.6软件对响应值进行多元回归拟合分析,得到的模拟回归方程,如下所示:
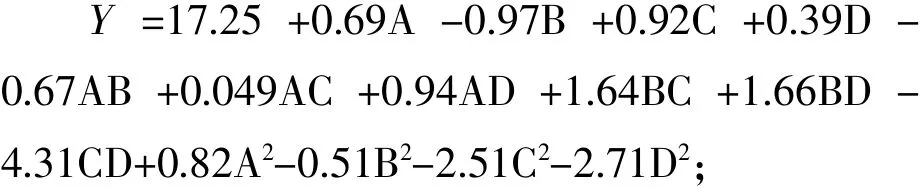
响应面的回归显著性方差分析见表5。
由表6可知,该回归二次方程模型具有显著差异性(p< 0.05), R2=0.9275,模型相关度很好,说明该模型是显著的、拟合情况良好、可靠性较高。失拟项P值0.0543>0.05,不显著,表明试验误差较小,失拟度好,一些未知因素对试验干扰少,这进一步说明各因素值和响应值之间的关系可以用Quadratic模型来函数化。模型的信噪比为7.499>4,表明选用的响应面模型合理。当显著水平小于0.05时,它所对应的单个条件对响应值的作用是显著的。分析结果表明,因素一次项以及二次项A、B、C、C2、D2对酶解液抑菌效果有显著影响 (P <0.05),交互项 BC(P=0.0135<0.05)、BD(P=0.0181<0.05)、CD(P=0.0034<0.05)差异显著,表明酶解时
间、酶用量、酶解pH对蛋壳内膜酶解液的抑菌效应显著,并且它们之间存在交互作用。由回归方程可知,各因素对蛋壳内膜酶解液的抑菌效果影响的方程系数为 A-酶解温度 (0.69)、B-酶解时间(0.97)、C-酶用量(0.92)、D-pH(0.39),影响因素的主次顺序为酶解时间>酶用量>酶解温度>pH。
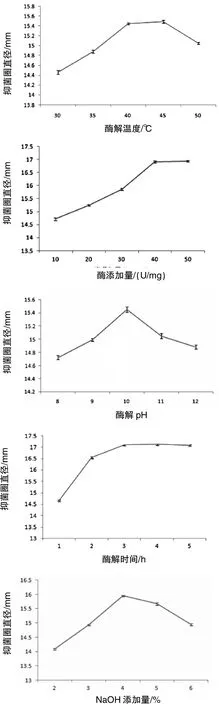
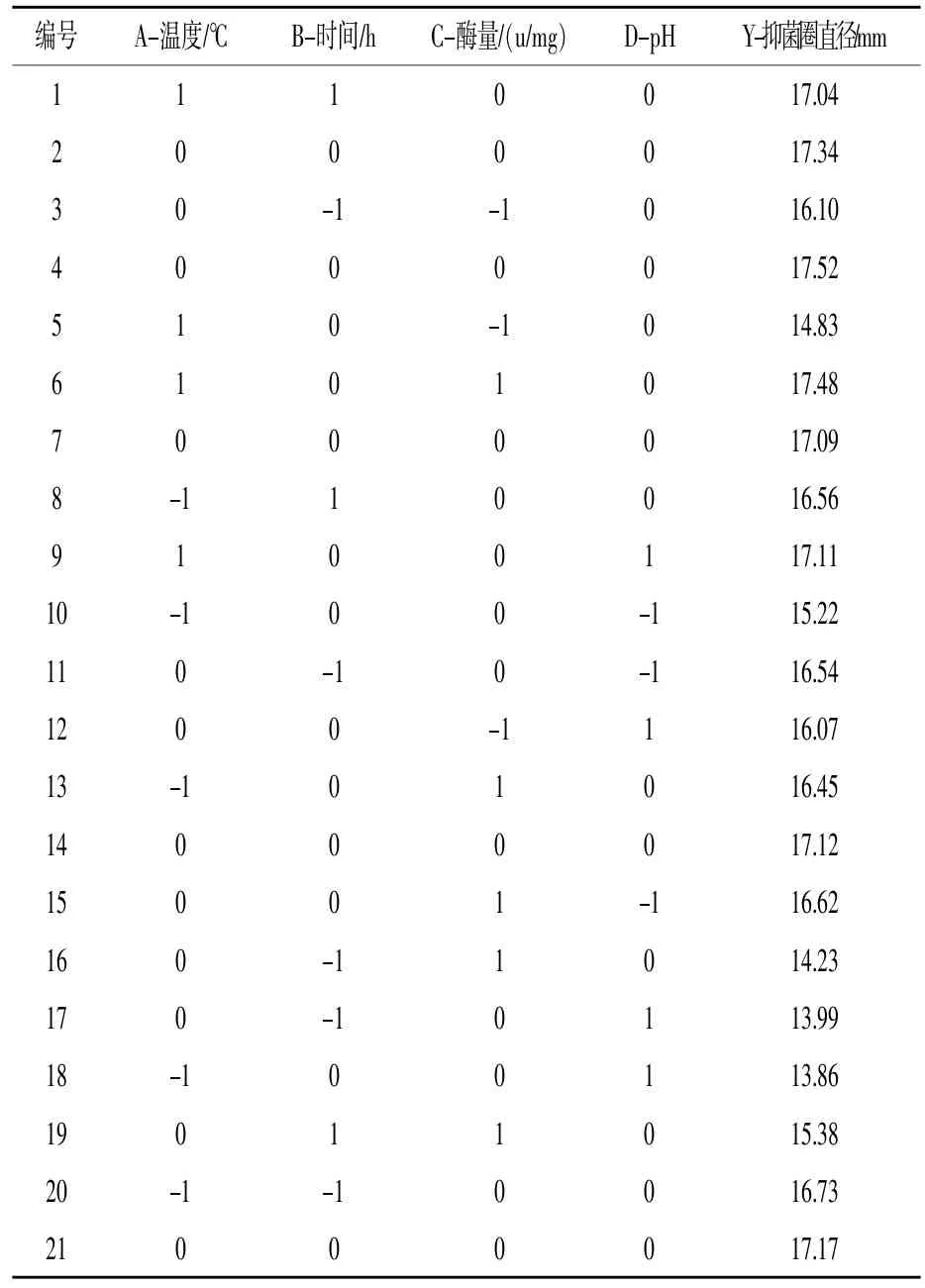
表5 响应面试验结果与分析
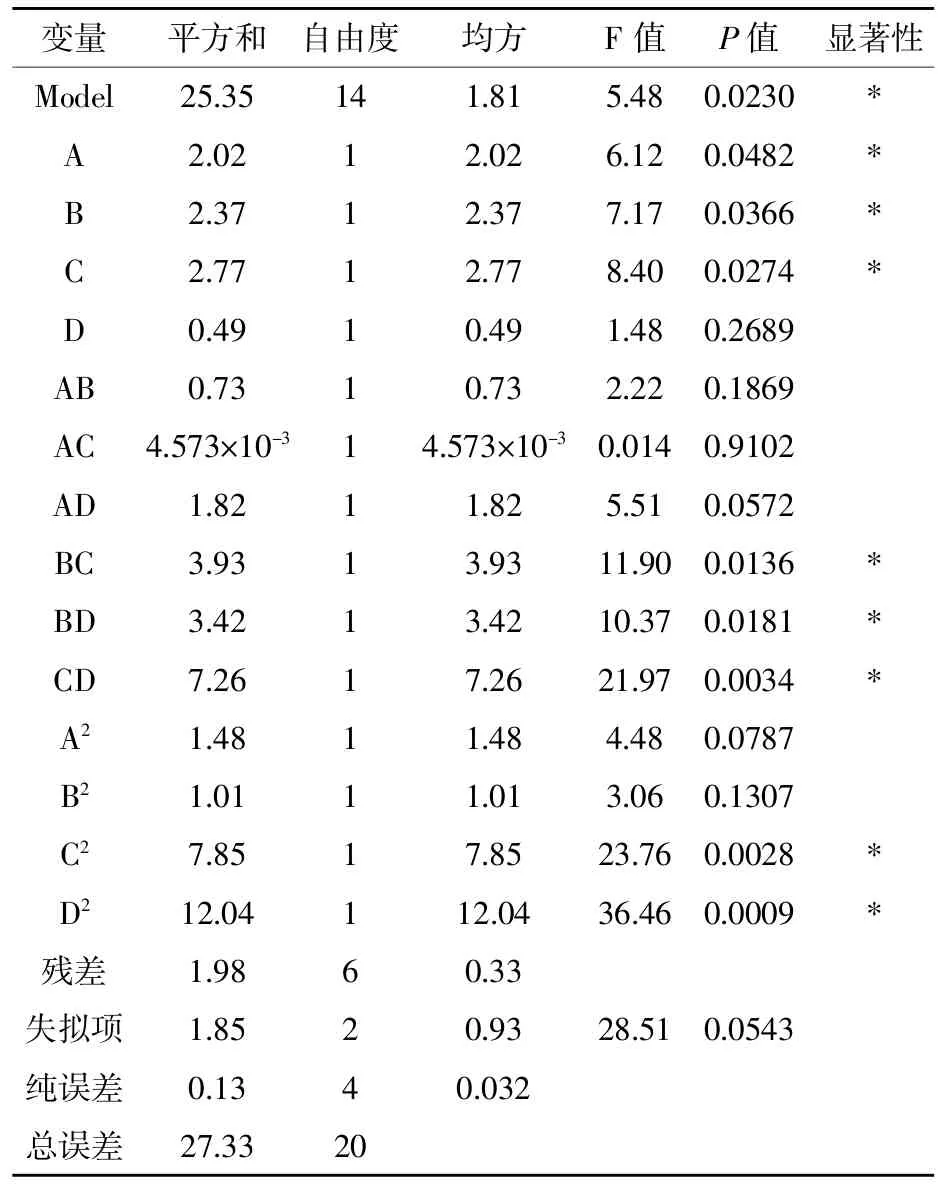
表6 回归模型方差分析
2.3.3响应面交互作用结果分析 采用软件Design Expert 8.0.6分析软件做两两因素交互作用的响应曲面及等高线,确定酶解时间、酶用量、酶解温度、酶解pH对蛋壳内膜酶解液抑菌效果的影响,经回归模型方差分析结果可知,交互项AB、AC、AD的P值均大于0.05,差异不显著,交互项BC(P=0.0135<0.05)、BD(P=0.0181<0.05)、CD(P=0.0034<0.05)差异显著,所选试验因素与响应面之间的具有显著作用的交互项,通过绘制响应面曲线图及等高线进行可视分析,结果如图2、3、4 所示。
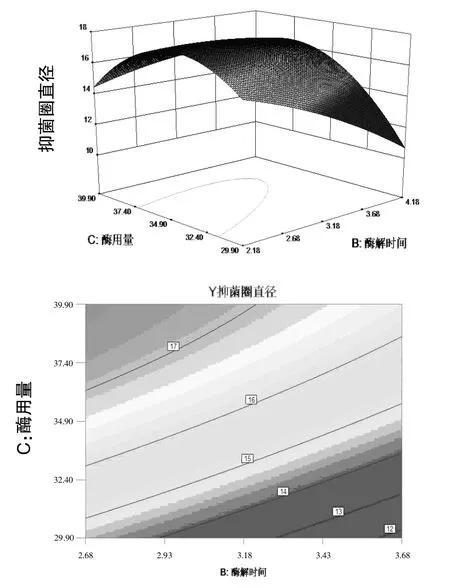
图2 酶解时间和酶用量交互作用对蛋壳内膜酶解液抑菌效果影响的响应曲面及等高线
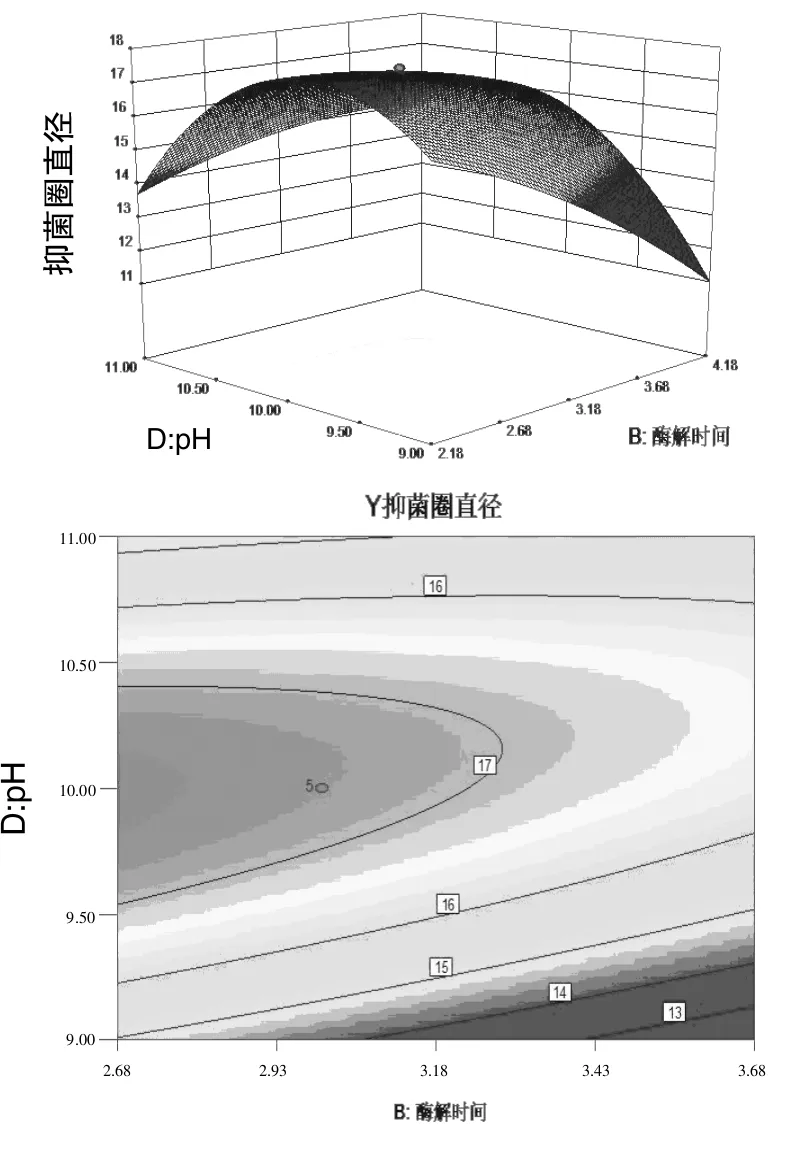
图3 酶解时间和pH交互作用对蛋壳内膜酶解液抑菌效果影响的响应曲面及等高线
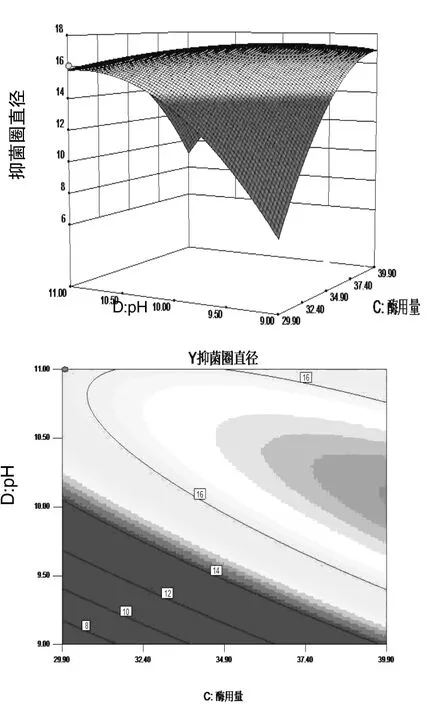
图4 pH和酶用量交互作用对蛋壳内膜酶解液抑菌效果影响的响应曲面及等高线
图2、3、4表明酶解时间、酶用量、pH中任意一个变量取零水平时,其余两个变量对蛋膜酶解液抑菌效果的影响。一个响应曲面图的坡度越陡峭,表明响应值对于这种处理条件下的改变越敏感,说明这两种自变量的交互作用比较强。从图中可以看出酶用量与酶解pH的交互作用,以及酶解时间与酶用量的交互作用比酶解时间与酶解pH的交互作用要大。等高线图的形状反映出交互作用的强弱,椭圆表示2个因素作用显著,圆形则相反,图 2、3、4等高线曲率较小,说明交互项CD,BC,BD的影响较显著,当酶用量一定时,随着酶解时间的延长抑菌圈直径增大,当酶解到一定时间后,抑菌效果几乎不变,甚至有减小趋势,说明酶解时间不易过长,否则既浪费资源,抑菌效果也不理想;当pH一定时,抑菌效果随时间的延长先增强后减弱;且当pH一定时,抑菌效果随酶用量的增多而增强,达到一定浓度后抑菌效果不再变化。
2.3.4蛋膜酶解液最佳抑菌效果的酶解条件验证试验 应用响应面分析法优化酶解工艺,经曲面拟合后,得到的最佳酶解条件为:酶解温度45℃,酶解时间2 h,酶用量37.51 U/mg,pH为10.14,此时预期的酶解液对S.enteritidis的抑菌圈直径是(17.941±0.21)mm。为了检测预测结果是否与真实情况相一致,以曲面拟合的最佳条件为试验条件进行三次重复验证,结果得到的抑菌圈直径平均值为(17.927±0.19)mm,高于优化前任一条件下的数据,且与预期的试验最大值接近。因此,在该工艺条件下试验结果比较稳定,重现性良好,同时也证明响应面分析的可靠性,说明按照数学模型进行预测是可行的。
2.4蛋壳内膜酶解液抑菌活性成分的初步确定以对S.enteritidis的抑菌圈直径大小为指标,测酶解液不同成分的抑菌活性,最终结果抑菌圈直径大小分别为:①:0 mm,②:0 mm,③:(14.02 ±0.36)mm,恩诺沙星阳性对照(15.96 ±0.48)mm,从抑菌效果可以看出蛋壳内膜酶解液中发挥抑菌作用的成分为蛋白酶解后的蛋白或多肽,而非蛋壳内膜酶解液中的多糖成分或其他成分,这与充分利用蛋壳膜中丰富的蛋白质成分的试验初衷相符,也为进一步探讨蛋壳膜酶解液的抑菌多肽成分奠定了基础。
3 结论
3.1试验测定了碱性蛋白酶、中性蛋白酶、胰蛋白酶和木瓜蛋白酶4种蛋白酶对鸡蛋壳内膜酶解后的抑菌活性,发现碱性蛋白酶酶解液对几种测试菌的抑菌效果较好。
3.2对碱性蛋白酶的酶解条件进行了单因素试验及响应面优化,通过中心组合设计并同时建立回归模型,经验证得到的回归拟合程度较好 (R2=0.9275)。从模型中看出,酶解时间、酶用量、酶解pH对蛋壳内膜酶解液的抑菌效果影响显著,各因素之间存在交互作用。在单因素试验的基础上,利用Box-Behnken中心组合设计和响应面分析法,确定蛋壳内膜酶解液抑菌效果最佳工艺酶解条件为酶解温度45℃,酶解时间2 h,酶用量37.51 U/mg,酶解pH 10.14。
3.3在获得的最佳酶解条件下,试验验证所得蛋壳内膜酶解液对S.enteritidis的抑菌圈直径为(17.927±0.19)mm,与理论最优值(17.941±0.21) mm接近,抑菌效果比优化前提高了10.52%。
3.4酶解液初步处理说明发挥抑菌活性的成分为蛋白或多肽,证明了试验的可行性,后续将进一步研究抑菌活性成分及其他生物活性。
[1]白鑫华,徐阳,杨思亮,等.食品添加剂和温度对鸡蛋壳膜肽抗氧化活性的影响[J].中国食品添加剂,2017,8:160~165.
[2]何柳.禽蛋不同结构部分的抗菌特性研究[D].武汉:华中农业大学,2012.
[3]胡徐登,陈有亮,马萍.鸭蛋壳膜双酶水解提取黏多糖的工艺研究[J].中国家禽,2015,3:34 ~ 37.
[4]黎元生.计算机在科研工作中的应用:试验设计和试验数据处理[J].抚顺石油化工研究院院报,1996,2:57 ~ 61.
[5]李莉,顾赛麒,王锡昌,等.响应面法优化酶法提取大鲵皮胶原蛋白工艺[J].中国水产科学,2013,4:876 ~ 883.
[6]李鑫,赵燕,涂勇刚,等.蛋壳内膜酶解及其酶解液体外抗氧化活性研究[J].食品工业科技,2013,9:164 ~ 167+171.
[7]刘琼,张新龙,陈楚英,等.响应面法优化茼蒿抑菌物质超声波提取工艺[J].江西农业大学学报,2016,4:734 ~ 740.
[8]刘焱,罗灿,刘伦伦.鸡蛋壳膜角蛋白不同提取工艺的效果比较[J].农业工程学报,2014,7:274 ~ 280.
[9]皮钰珍,王淑琴,李秋红.鸡蛋壳膜资源的开发与应用前景[J].食品科技,2006,4:128 ~ 130.
[10]任萌,宫新统,赵颂宁,等.酶法提取鸡蛋壳膜胶原蛋白工艺[J].食品科学,2012,8:25.
[11]佘之蕴,黄宝莹,刘海卿,等.牛津杯法测定食品添加剂对五种益生菌的抑菌活力[J].食品工业,2016,1:171~174.
[12]史雅凝.鸡蛋膜蛋白酶解物的制备及其对肠道氧化应激和炎症的影响[D].无锡:江南大学,2015.
[13]汪宝欢.鸡蛋壳膜水溶性物质的酶法提取及特性研究[D].无锡:江南大学,2009.
[14]杨莹莹,陈晓平.响应面法优化大蒜抑菌物质超声波提取工艺的研究[J].食品与发酵科技,2012,4:37 ~ 41.
[15]张娴.蛋膜生物活性肽酶法制备工艺研究[D].陕西西安:西北大学,2007.
[16]周艳华.可溶性鸡蛋壳膜蛋白与多肽的制备及其抗氧化活性的研究[D].武汉:华中农业大学,2010.
[17]Zhao Yuhong,等.蛋壳膜中提取出的胶原蛋白的表征[J].陈璎洁译.明胶科学与技术,2009,2(3):132 ~ 135.
[18]Eletta O A A,Ajay O Ai,Ogunleye O O,et al.Adsorption of cyanide from aqueous solution using calcinated eggshells:Equilibrium and optimisation studies[J].Journal of Environmental Chemical Engineering.2016,4(1):1367 ~ 1375.
[19]Long F D,Adams R G,Devore D P.Preparation of hyaluronic acid?from eggshell?membrane.US,080388[P].2004.9 ~ 23.
[20]Mohammadi Reza,Mohammadifar,Mohammad Amin,et al.Extraction optimization of pepsin-soluble collagen from eggshell membrane by response surface methodology(RSM)[J].Food Chemistry.2016,190:186 ~ 193.
[21]Preetam Guha Ray and Somenath Roy.Eggshell membrane:A natural substrate for immobileization and detection of DNA[J].Materials Science and Engineering,2016,59:404 ~ 410.
[22]Reza M,Mohammad A M,Amir M M,et al.Extraction optimization of pepsin-soluble collagen from eggshell memb rane by response surface methodology(RSM)[J].Food Chemistry,2016,190(1):186~193.
[23]Sarbjeet Makkar,RohanaLiyanage,Lakshmi Kannan,etal.Chicken Egg Shell Memrane Associated Proteins and peptides[J].J A-gric Food Chem,2015,63(44):9888 ~ 9898.
[24]Shi Yaning,Jennifer Kovacs-Nolan,Bo Jiang,et al.Peptides derived from eggshell membrane improve antioxida nt enzyme activity and glutathione synthesis against oxidative damage in Caco-2 cells[J].Journal of functional foods.2014,11:571 ~ 580.

