产蛋白酶菌的分离鉴定及产酶条件优化
王 鼎, 余 淼, 付洋洋, 郭春华*, 彭忠利, 高彦华
(1.西南民族大学生命科学与技术学院,四川成都610041;2成都大帝汉克生物科技有限公司,四川成都611130)
蛋白酶存在于动物、植物、微生物中,属于水解酶类,约占世界酶制剂销量的60%(马俊阳等,2014)。在分子生物学和微生物发酵技术快速发展的基础上,微生物蛋白酶在工业上的应用越来越普遍,虽然很多微生物蛋白酶被大量用于饲料工业和畜牧生产,但是大量的研究都集中在单胃动物的生产性能方面(李东东等,2015),而反刍动物方面的研究较少。目前研究已经发现,反刍动物瘤胃中含有10种以上的瘤胃真菌,能产生蛋白酶的共有6种,并且6种均具有氨基酸活性的内切酶。可见,反刍动物瘤胃内的真菌在开发新型蛋白饲料、提高动物饲料利用率、降低饲料成本上具有巨大潜力。
本研究旨在从肉牛瘤胃液中分离出产蛋白酶的霉菌,筛选出产蛋白酶活性较高的菌株,对其产酶条件进行优化,为此菌株更好的应用于畜牧生产提供理论依据。
1 材料与方法
1.1菌株及培养基 菌株来源:从成都市青白江唐家寺肉牛屠宰场的肉牛瘤胃中采集瘤胃液,四层纱布过滤后带回实验室备用。选择性培养基:淀粉8 g,葡萄糖15 g,酵母提取物1 g,蛋白胨6 g,KH2PO43g,MgSO40.5g,琼脂 15g,蒸馏水 1000mL。
发酵培养基:麦麸与水以质量比1∶1配制而成,自然pH。
酪蛋白培养基:酪蛋白15 g,Na2HPO42 g,NaCl 5 g,琼脂 15 g。
查氏培养基: 蔗糖 30 g,NaNO33 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO4·4H2O 0.01 g,K2HPO41 g,琼脂15 g,定容至 1000 mL,pH 6.0 ~ 6.5。
LB液体培养基:蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂糖 10 g,定容至 1000 mL,121 ℃灭菌20 min,冷却后加AMP 1 μL/mL,4℃保存备用。
LB固体培养基:蛋白胨10 g,酵母提取物5 g,NaCl 10 g,琼脂糖 10 g,定容至 1000 mL,115 ℃灭菌 20 min,冷却至 60 ℃左右,加 AMP 1 μL/mL、IPTG 1 μL/mL、X-gal 2 μL/mL, 倒平板后 4 ℃保存备用。
1.2产蛋白酶菌的分离纯化 用灭菌生理盐水将瘤胃液梯度稀释,取 10-3、10-5、10-6梯度的稀释液100 μL涂布选择性初筛平板,30℃倒置培养36 h后挑取单菌落划线培养。将划线培养后的菌株点种于酪蛋白培养基平板,30℃倒置培养48 h,测定产生水解透明圈的菌落HE值(HE值=透明圈直径/菌落直径)后4℃保存备用。吸取1 mL产生透明圈的菌株孢子悬液接种于发酵培养基中,搅拌均匀,30℃培养72 h后测定蛋白酶活力。
1.3产蛋白霉菌的鉴定 综合HE值和酶活性两个指标,选出蛋白酶活性最高的一株进行形态鉴定、分子鉴定。
1.3.1形态鉴定 形态鉴定主要通过 《真菌鉴定手册》、《中国真菌志》的描写,再根据菌株生长情况对其进行判断。
1.3.2分子鉴定 将产蛋白酶菌在30℃、150 r/min的条件下进行扩大培养,培养 3 d后的菌丝体5000 r/min离心5 min。无菌水冲洗2~3遍后,用滤纸吸干水放入液氮中快速冷冻。将冻好的菌体放入研钵中研磨至很细的粉末状,放入离心管中备用。依据天根柱式真菌试剂盒说明书提取菌株DNA基因组。
以菌株DNA基因组为模版,扩增菌株的18S rDNA基因片段。所用引物为P1:5'-GTAGTCATATGCTTGTCTC -3' 和 P2:5' -TCCGCAGGTTCACCTACGGA-3',反应条件为95℃预变性10 min;93℃变性 1 min;56℃退火 1 min;73℃延伸2 min,共30个循环;70℃延伸5 min。取5 μL PCR产物电泳检测,紫外凝胶成像系统观察结果。按照AxyPrep DNA胶回收试剂盒回收目的基因片段,然后将其连接至PMD-19T载体,AMP+挑选阳性菌落,后交送上海英潍捷基公司测序。
1.4单因素试验 选择接种量、培养温度、培养时间作为影响蛋白酶活性的主要因素,通过单因素试验选取响应面试验的水平。
1.4.1不同接种量对蛋白酶活性的影响 将初始菌液按1%、2%、4%、6%、8%、10%、12%的接种量接种,30℃培养48 h,测蛋白酶活力。
1.4.2不同培养温度对蛋白酶活性的影响 以4%接种量接种,培养温度分别为26、28、30、32、35、37℃,培养48 h,测蛋白酶活力。
1.4.3不同培养时间对蛋白酶活性的影响 以4%接种量接种,30℃培养,培养时间分别为24、36、48、54、60、72、76 h,测蛋白酶活力。
1.5响应面法优化试验 根据单因素试验结果,以接种量、培养时间、培养温度为自变量,以蛋白酶活性为响应值,进行中心组合试验设计(陈琳,2011)。每个试验重复3次,取其平均值,试验因素水平及编码见表1。
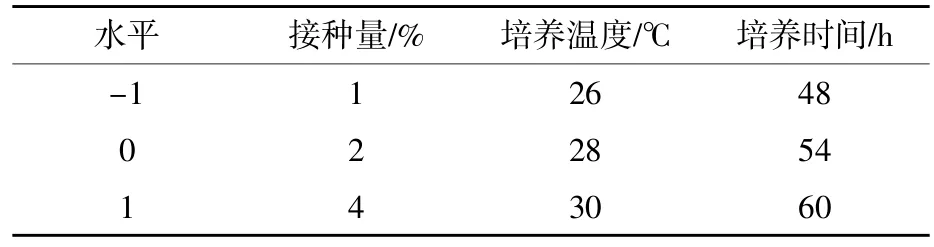
表1 试验因素水平及编码表
1.6数据处理 用Microsoft Excel 2010对数据进行初步整理,用Design Expert 7.0软件进行响应面分析,用SPSS18.0进行方差分析及差异显著性分析。
2 结果与分析
2.1产蛋白酶菌的分离纯化 瘤胃稀释液经选择性初筛平板30℃培养36 h后,共分离纯化出34株菌,分别命名为A1~A34。其中产生酪蛋白水解圈的菌株共17株,测定HE值,如表2所示,其中菌株A18的HE值最大。
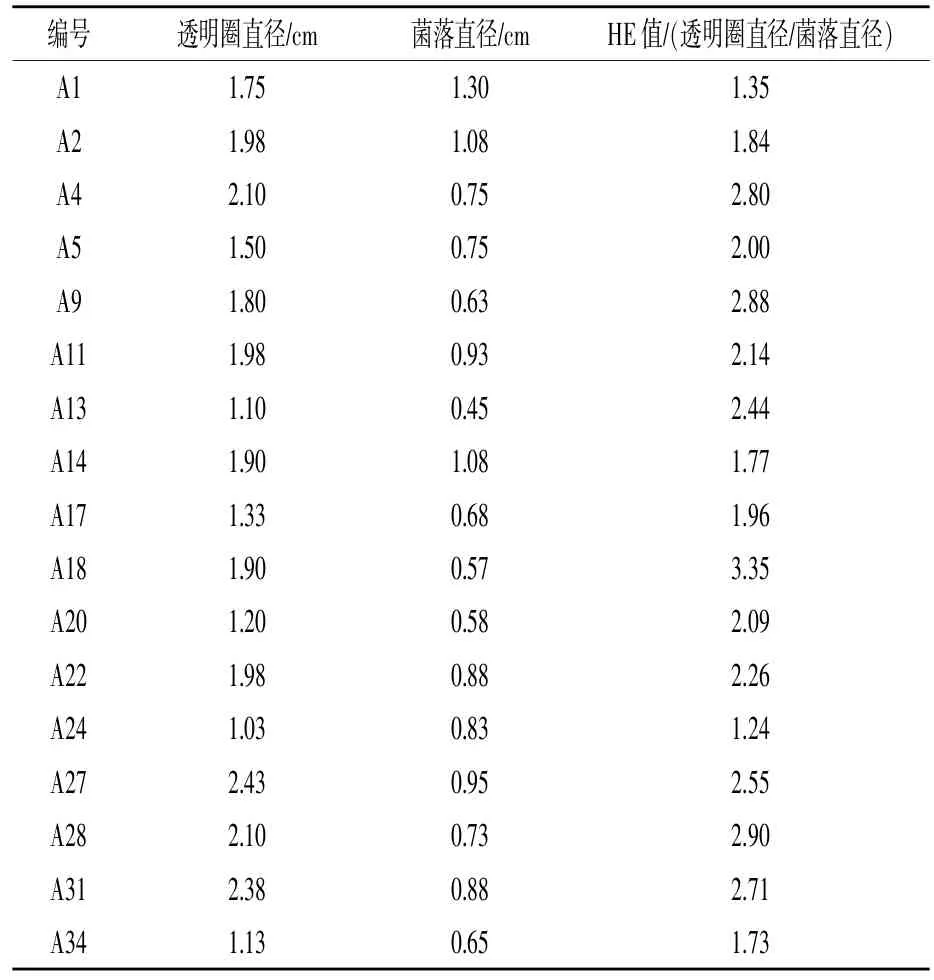
表2 产蛋白酶菌株初筛
将HE值较大的6株菌,发酵培养后测定其蛋白酶活性,如表3所示,综合HE值和蛋白酶活性,选择A18进行形态及分子鉴定。
2.2形态鉴定 将A18菌株涂布于平板中,进行形态观察。该菌在查氏培养基上生长较快,培养24 h左右菌落直径可达2~3 cm,菌落起初呈白色羊毛状,有的略有放射状沟纹,慢慢变黄继而变成黄褐色或绿褐色孢子,菌株衰老后,颜色变暗,背面淡褐色,且有褶皱。显微镜下观察发现,此菌株菌丝相当发达,不但有隔膜,而且菌丝顶端能直接产生孢子梗,并且分生孢子是串生的特征。根据《真菌鉴定手册》和《中国真菌志》的描述,初步判定A18为米曲霉。
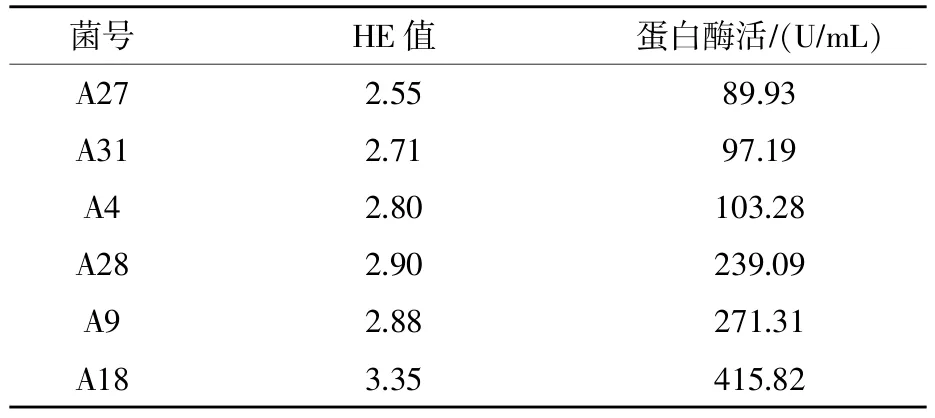
表3 菌株的复筛
2.3分子鉴定
2.3.118S rDNA PCR扩增 以A18菌株基因组DNA为模板,P1、P2为引物,进行PCR扩增。扩增产物进行电泳检测,结果如图1所示,PCR产物大约1800 bp,为一条单带。
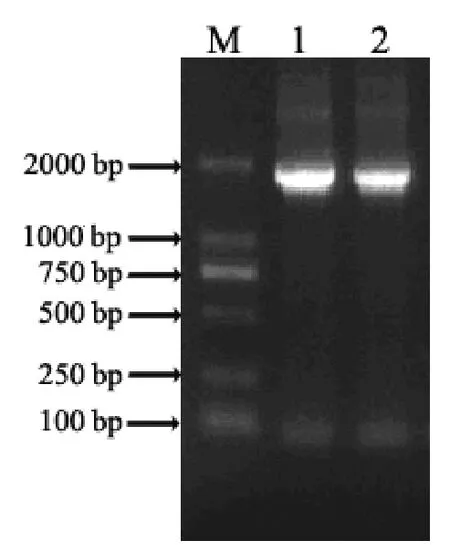
图1 18S rDNA PCR产物电泳图
2.3.2序列分析 测序结果显示,A18菌株18S rDNA全长1800 bp,在NCBI的Blast中进行比对,结果与GenBank中登陆的Aspergillusniger contig An03c0100,genomic contig(AM270052.1)、Aspergillusoryzae DNA for 18S rRNA,partial sequence (AM270051.1)、Aspergillusoryzae RIB40 DNA,SC206(AP007173.1)序列相似性均为 99%,确定A18为米曲霉。
2.4单因素试验
2.4.1接种量对菌株A18产蛋白酶活性的影响由图2可见,蛋白酶活性随着接种量的增加而呈现增加的趋势,在4%时达到最大值,之后随着接种量增加呈下降趋势。因此,在接种量为4%时,蛋白酶活性最高。
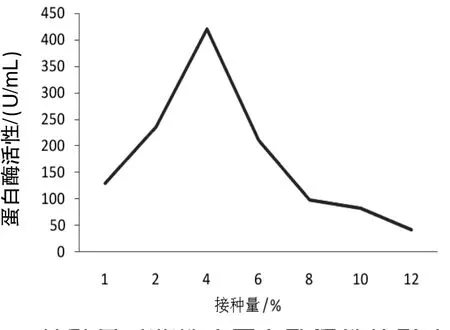
图2 接种量对菌株产蛋白酶活性的影响
2.4.2培养温度对菌株A18产蛋白酶活性的影响 由图3可知,随着温度的升高,蛋白酶活性增加,在30℃时活性达到最大。但继续随着温度升高,蛋白酶活性逐渐降低。所以,在温度为30℃时,酶活性最高。
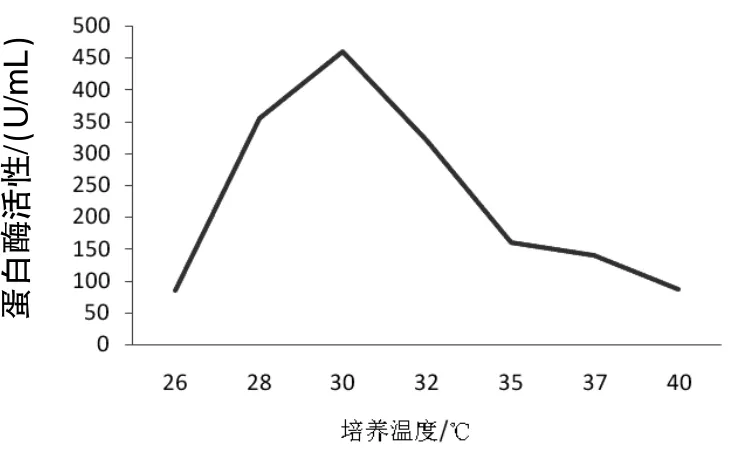
图3 培养温度对菌株产蛋白酶活性的影响
2.4.3培养时间对菌株A18产蛋白酶活性的影响由图4可知,开始阶段,酶活性很低且增长缓慢,36 h后蛋白酶活性随时间的增加呈增大趋势,且在60 h达到最大。60 h之后,蛋白酶活性急剧下降,所以,在培养时间为60 h时,酶活性达到最大。
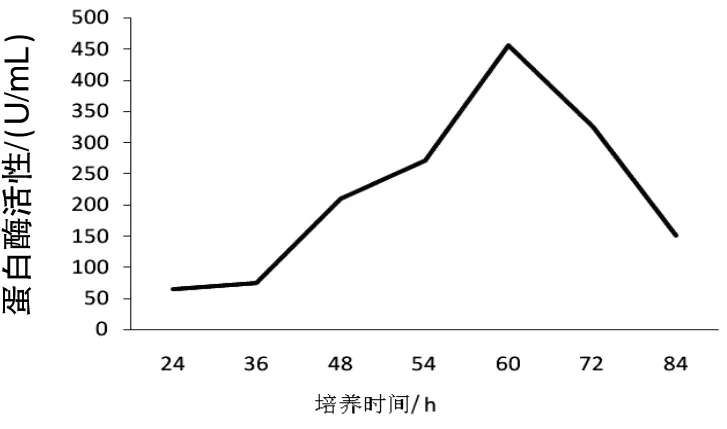
图4 培养时间对菌株产蛋白酶活性的影响
2.5响应面优化结果
2.5.1回归模型的建立及方差分析 采用中心组合试验设计,方案及结果见表4。用Design Expert软件对表中数据进行多元拟合,得到A18蛋白酶活力 Y 对接种量(X1)、培养温度(X2)、培养时间(X3)的多项回归方程为:Y1=372.34+49.17X1+102.58X2+ 91.06X3+34.75X1X2+44.61X1X3-
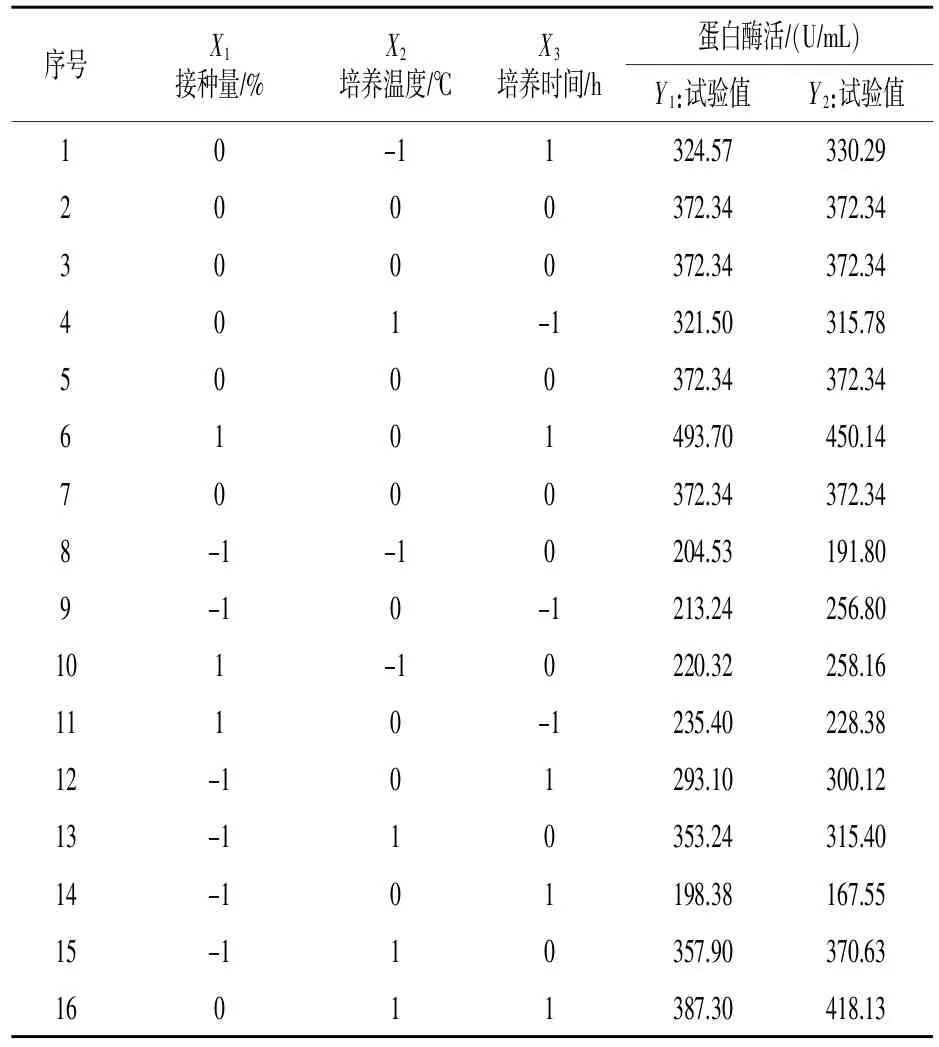
表4 响应面试验设计与试验结果
对上述回归模型进行方差分析,如表5所示,虽然X12系数不显著,但是三因素交互差异极显著,且该模型相关系数R2=0.9884,说明该回归方程与实际情况拟合度良好,利用该方程来代替实际试验点进行分析具有合理性。
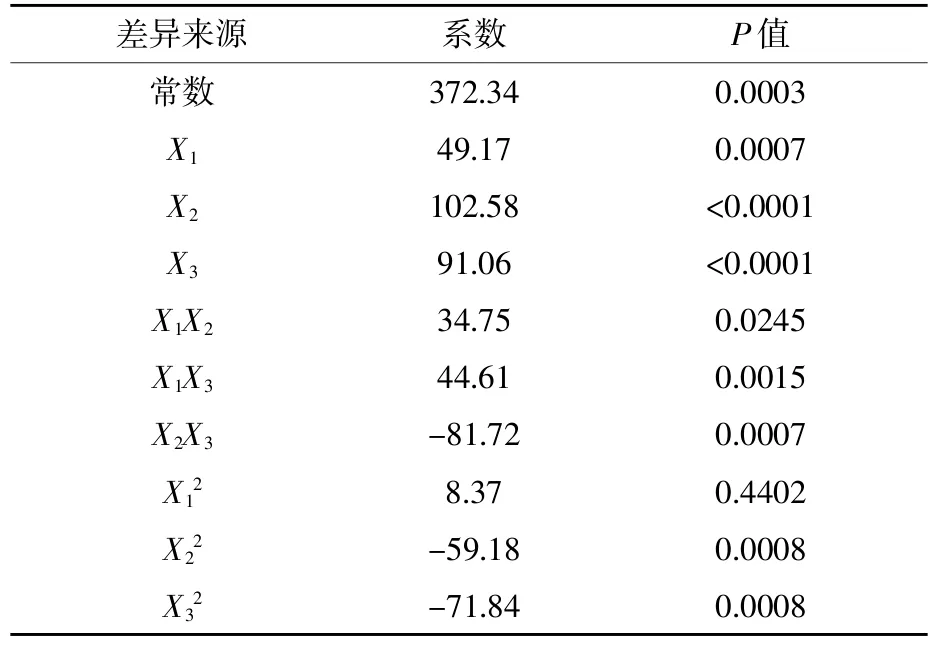
表5 回归模型方差分析
2.5.2两因素对蛋白酶活性的响应面分析 用Design Expert软件对表4数据进行多元回归拟合,所得到的两因素交互的响应面三维图及等高线图,如图5~7所示。
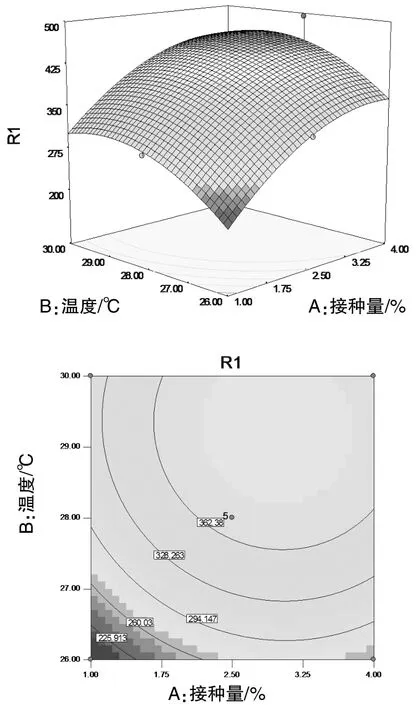
图5 接种量与温度交互作用对蛋白酶活性影响的响应面三维图及等高线图
从图5可以看出,该响应面存在最高点,说明在试验所选择的接种量与温度范围内,存在使米曲霉A18蛋白酶活性达到最大的值,这个值就是该响应面的最高点。在时间为48 h时,接种量与温度对蛋白酶活的交互作用显著,接种量为2.7%~4%,温度为27~29℃时,蛋白酶活性较高。等高线图为椭圆形,说明接种量与温度对米曲霉A18产蛋白酶的交互作用明显。
由图6可以看出,在接种量为3%时,温度与时间对蛋白酶活的交互作用显著,温度为27~29℃,时间为54~60 h时,蛋白酶活性较高。而且从图中可以看出该响应面存在最高点,说明在试验所选择的温度与时间范围内存在一个使米曲霉A18蛋白酶活性达到最大的值,这个值即是此响应面的最高点,也是等高线中最小椭圆的中心点。等高线图为椭圆形,说明温度与时间对米曲霉A18产蛋白酶的交互作用明显。
从图7可以看出,该响应面存在最高点,说明在试验所选择的接种量与时间范围内,存在一个使米曲霉A18蛋白酶活性达到最大的值,这个值即是此响应面的最高点,也是等高线中最小椭圆的中心点。在温度为30℃时,接种量与时间对蛋白酶活的交互作用显著,接种量为3%~4%,时间为54~60 h时,蛋白酶活性较高。等高线图显示为椭圆形,说明接种量与时间对米曲霉产蛋白酶的交互作用明显。
2.5.3回归模型的验证 通过Design Expert 7.0得出米曲酶A18的最佳产酶条件为接种量3.67%、温度28.57℃、培养时间54.59 h。在此条件下,菌株A18中性蛋白酶活力最大。为简化试验,在接种量4%、温度29℃、时间55 h的条件下进行重复试验,测定中性蛋白酶活性为527.57 U/mL。
3 讨论
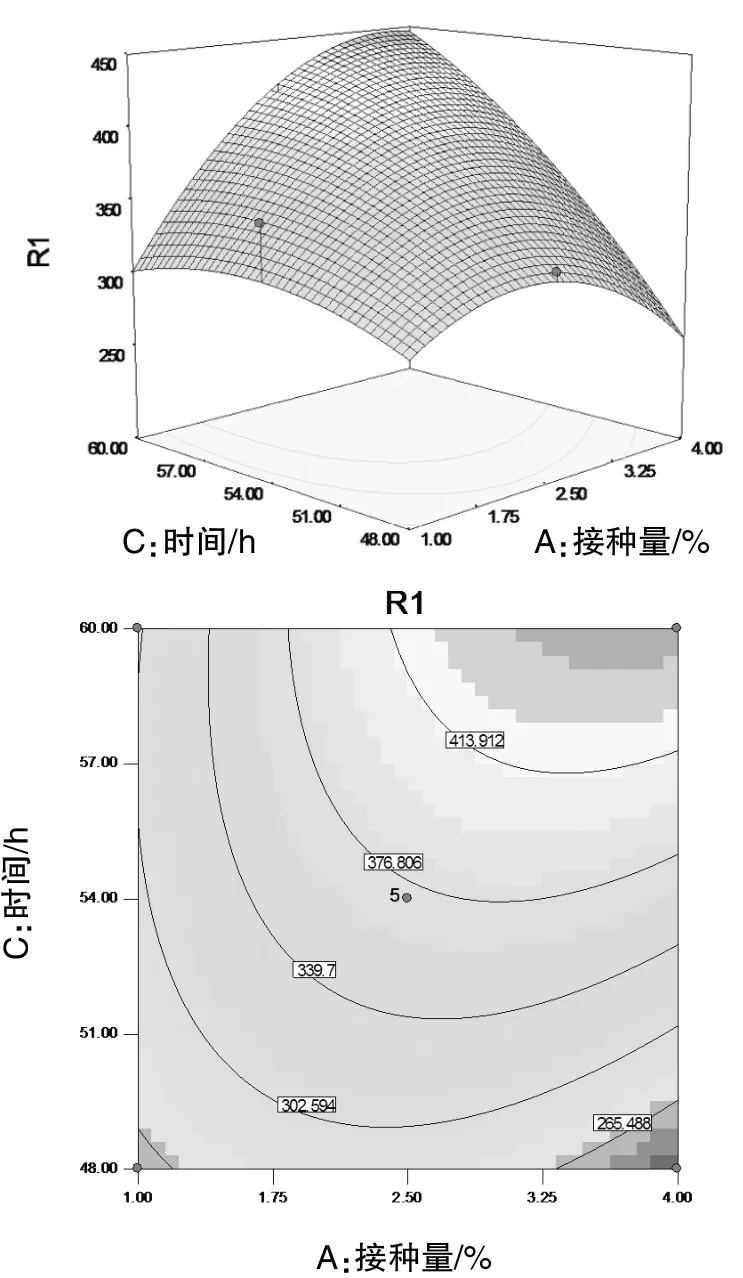
图7 接种量与时间的交互作用对蛋白酶活性影响的响应面三维图及等高线图
鉴定霉菌通常通过形态鉴定和生理生化分析(杨亚晋等,2013;宋鹏,2012),但此种方法往往只能判断到微生物的属水平,不能准确地对微生物进行分类鉴定。通过分子生物学技术对微生物进行鉴定,能充分反映物种之间的同源性,鉴定到种水平。本文通过形态鉴定与分子鉴定相结合的方法,确定A18菌株为米曲霉。对于蛋白酶活性测定方法来说,先通过酪蛋白水解圈法进行产蛋白酶菌初筛,选出产蛋白霉菌共16株,测定其HE值,并以此作为菌株产蛋白霉菌能力的初步鉴定,但HE值不能作为蛋白酶活高低的准确依据,所以本文挑选出HE值较大的6株菌,紫外分光光度法测定蛋白酶活,综合HE值和蛋白酶活比较,选出酶活最高的A18菌株,酶活性为415.82 U/mL。这与徐建国(2010)(最高酶活 129.2 U/mL)、李曹龙(2012)(最高酶活41.653 U/mL)、 吴丽娜 (2017)(最高酶活49.21 U/mL)等研究相比,酶活要高出很多,这对将来此菌用于生产具有重大的意义。
合适的培养条件对微生物生长、繁殖、代谢有很大影响,试验先通过单因素试验研究接种量、培养温度和培养时间三个因素对菌株A18产蛋白酶活性的影响。结果表明,接种量为4%,培养温度为30℃,培养时间为60 h时,A18的蛋白酶活性最高。接种量过低,菌株无法在培养时间内产生足够的孢子数;接种量过高,孢子大量繁殖,在培养基营养物质一定的情况下,菌株的生长受到抑制,这两方面的因素都不利于蛋白酶的产生和积累,导致蛋白酶活性降低。温度也是产酶条件的重要影响因素之一。随着温度的升高,蛋白酶活性增加,到30℃时活性达到最大;再继续增加温度,蛋白酶活性开始降低。出现这一结果的原因可能是温度过高会导致酶的失活,从而影响酶活性的大小。培养时间的长短影响着微生物的生长,培养时间过短,微生物生长缓慢,酶的合成较少;反之,由于培养时间过长,营养物质的消耗以及代谢产物的积累都会影响微生物的生长。
单因素试验结果并不能直接准确得出最佳产酶条件,所以本研究在单因素试验的基础上采用响应面法设计优化试验。采用该试验方案测定数据,得到回归方程,对此回归模型进行方差分析,利用所得回归方程进行预测,如表5所示,回归模型与实际情况拟合较好。Design Expert设计响应面三维图显示,在温度一定的情况下,随着接种量的增加,蛋白酶活性提高,但到达极值时,又有下降的趋势;在接种量为固定值时,蛋白酶活随温度升高而增加,到达极值,呈下降趋势,说明二者对蛋白酶活性提高是有交互作用,当接种量在最高水平附近、温度在中间值附近时,可以提高蛋白酶活性。
4 结论
本试验从肉牛瘤胃液中初筛选出34株菌,其中A18菌株蛋白酶活达415.82 U/mL。通过A18菌株18S rDNA序列比较,结合形态特征,确定其为米曲霉。经连续多次重复优化试验,确定最佳产酶条件为接种量4%、培养温度29℃、培养时间55 h,其最高酶活可达527.57 U/mL,比优化之前提高了22.6%。
[1]陈琳,孟祥晨.响应面法优化植物乳杆菌代谢产细菌素的发酵条件[J].食品科学,2011,32(3):176 ~ 180.
[2]李曹龙,秦艳,欧秀玲,等.高温产蛋白酶菌株的筛选及产酶条件的研究[J].中国酿造,2012,31(12):98 ~ 101.
[3]李东东,李宗锐,丁雪梅,等.不同粗蛋白质水平饲粮添加外源蛋白酶对肉鸡生产性能、血清生化指标和抗氧化功能的影响[J].动物营养学报,2015,27(9):2820 ~ 2831.
[4]马俊阳,诸葛斌,方慧英,等.米曲霉蛋白酶的分离纯化及酶学性质研究[J].微生物学通报,2014,41(1):83 ~ 89.
[5]宋鹏,陈亮,郭秀璞.产蛋白酶菌株的鉴定及酶学特性[J].食品科学,2012,33(13):152 ~ 155.
[6]吴丽娜,赵小惠,郭凯晴,等.金枪鱼肉降解用高产蛋白酶菌株的筛选及鉴定[J].湖北农业科学,2017,56(13):2506 ~ 2511.
[7]杨亚晋,付文娟,刘旭辉,等.产高效细菌素乳酸菌的筛选及鉴定[J].中国畜牧杂志,2013,49(19):72 ~ 76.

