尿液5种肿瘤标记物联合检测对膀胱癌的诊断价值
刘莉,杨永姣,龙安安,Jhamb Sunidhi,Aravind.D,刘晓强
(1天津医科大学第二医院,天津300211;2天津市泌尿外科研究所;3天津医科大学国际医学院)
肿瘤标记物可以用来特异性检测某种恶性疾病,临床上常应用肿瘤标记物来诊断特定肿瘤。许多膀胱肿瘤标记物已经FDA认可应用于临床检测[1],但到目前仍然缺少一种敏感且特异的肿瘤标记物来取代现有有创的膀胱镜以及低敏感度的尿细胞学的检测方法。本研究通过ELISA方法检测膀胱癌患者尿中核基质蛋白22(NMP22)、细胞黏附分子44(CD44)、细胞角蛋白20(CK20)、癌胚抗原相关细胞黏附分子1(CEACAM1)、膀胱肿瘤抗原(BTA)的表达情况,并探讨这5种标记物联合检测对膀胱癌的诊断价值。
1 资料与方法
1.1 临床资料
选择2015年12月~2016年6月因考虑膀胱肿瘤就诊于天津医科大学第二医院的患者84例。所有患者均有完整的病例资料且近期未接受泌尿生殖系统操作以及手术、放化疗等。其中64例经膀胱镜检或经尿道膀胱肿瘤电切术行病理检查证实为膀胱尿路上皮癌患者(肿瘤组),男41例、女23例,年龄(66.4±9.8)岁,TNM分期Ta期10例、T1期47例、T2期7例。依据最新的膀胱癌分级方法,低级别尿路上皮肿瘤20例,高级别尿路上皮肿瘤44例。另外20例诊断为其他非恶性肿瘤性泌尿系统疾病(对照组),男10例、女10例,年龄(65.8±8.0)岁。其中前列腺增生7例,泌尿系统感染7例,泌尿系统结石4例,膀胱良性肿瘤2例。
1.2 尿NMP22、CD44、CK20、CEACAM1、BTA检测
患者入院后,在行导尿、膀胱镜检查术、直肠指诊等泌尿系相关操作之前,留取新鲜的清晨清洁中段尿50~100 mL,离心取上清,-20 ℃保存,用于检测NMP22、CD44、CK20、CEACAM1、BTA。采用ELISA方法,按照ELISA试剂盒(武汉华美生物工程有限公司)操作步骤进行检测,最后使用波长450 nm的酶标仪测定并计算样本中各肿瘤标记物水平。
1.3 统计学方法
2 结果
2.1 两组尿NMP22、CD44、CK20、CEACAM1、BTA水平比较
见表1。肿瘤组尿NMP22、CD44、CK20、CEACAM1、BTA水平均高于对照组(P均<0.05)。

表1 两组尿NMP22、CD44、CK20、CEACAM1、BTA水平比较
注:与对照组比较,*P<0.01。
2.2 各肿瘤标记物检测膀胱癌的敏感度及特异度
见表2。NMP22检测膀胱癌的敏感度最高(84.3%),但特异度仅为55.0%。结合AUC比较,CD44的检测价值最大,当CD44取临界值为348.8 pg/mL时,敏感度为82.8%,特异度为85.0%。
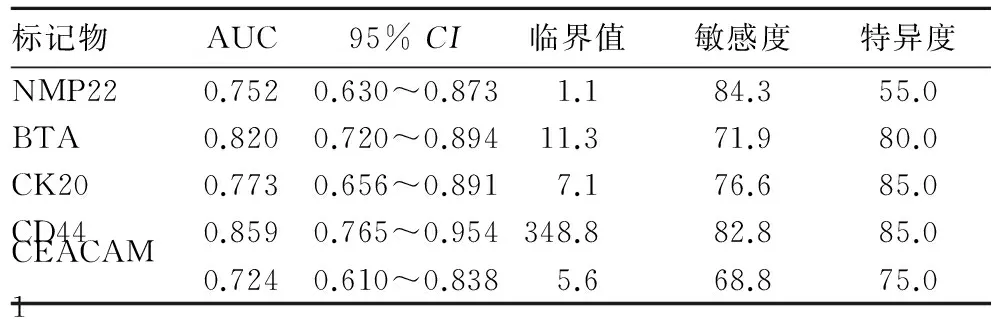
表2 各肿瘤标记物的敏感度和特异度(%)
2.3 不同病理分期患者尿中各肿瘤标记物的敏感度比较
见表3。CEACAM1对高分期膀胱癌的诊断敏感度高于低分期(P均<0.05)。其他4种肿瘤标记物对不同分期膀胱癌诊断的敏感度无统计学差异(P均>0.05)。

表3 不同病理分期患者尿中各肿瘤标记物的敏感度比较(%)
注:与Ta期比较,*P<0.05。
2.4 不同病理分级患者尿中各肿瘤标记物的敏感度比较
见表4。5种肿瘤标记物对不同分级膀胱癌诊断的敏感度无统计学差异(P均>0.05)。

表4 不同病理分级患者尿中各肿瘤标记物的敏感度比较(%)
2.5 5种标记物组合联合检测膀胱癌比较
见表5。NMP22、CD44、CK20、CEACAM1、BTA联合检测诊断膀胱癌的敏感度达98.4%,但特异度却降低为35.0%。CD44、CK20、BTA联合检测具有较高的敏感度和特异度,其AUC为0.905(95%CI为0.822~0.958),诊断效能高于其他组合的诊断效能。

表5 5种肿瘤标记物不同组合联合检测的敏感度及特异度(%)
3 讨论
世界各地每年发生约38万例膀胱癌[1],而且大部分膀胱癌在初次诊断时为非肌层浸润性(NMIBC)[2]。在NMIBC中,约70%的病例表现为pTa,20%为pT1,10%为CIS病变[3]。通常诊断为NMIBC的患者预后良好,但仍有30%~80%的癌症复发,并且10%~15%的患者将在5年内进展到肌肉侵袭[4]。膀胱癌的特点是高复发率,特别是肿瘤直径>3 cm,多发、高级别的膀胱癌,属于高复发风险的患者,因此早发现和积极的随访对膀胱癌患者极为重要。膀胱镜检查术以及尿细胞学检查是临床用来诊断以及膀胱癌随访的主要方法,但仍然存在膀胱癌漏诊的发生,特别是对于早期低级别、低分期的膀胱癌,同时有创的膀胱镜以及低敏感度的尿细胞学这两项检测本身的缺点也造成无法满足日常临床需求。这些问题使得一种新的检测手段成为需求。肿瘤标记物可以用来诊断特定肿瘤,并对肿瘤的治疗及预后进行评估,许多肿瘤标记物试剂盒已经FDA认可应用于临床检测[5],但目前仍然缺少一种敏感且特异的肿瘤标记物来取代现有有创的膀胱镜以及低敏感度的尿细胞学检测方法。本研究通过ELISA法检测NMP22、CD44、CK20、CEACAM1、BTA 5种肿瘤标记物在膀胱癌患者尿液中的表达情况,并探讨5种肿瘤标记物联合检测用于诊断膀胱癌的可行性,结果显示,5种肿瘤标记物在肿瘤组的表达水平均高于对照组,应用ELISA法检测尿中这5种肿瘤标记物对膀胱癌的诊断具有重要意义。
Carpinto等[6]发现,膀胱癌患者尿中NMP22水平高于正常对照组,有临床表现的膀胱癌患者的尿NMP22水平高于没有临床表现的膀胱癌患者。Zippen等[7]报道,当NMP22的临界值取10.0 U/mL时,NMP22的敏感度达100%,特异度达85%,而尿细胞学检测的敏感度却很低,仅为33%;并且尿液中NMP22水平不会随着肿瘤的分期、分级而发生明显变化。本研究结果显示,肿瘤组NMP22水平高于对照组。依据NMP22不同水平绘制ROC曲线,发现当NMP22取临界值为1.125 ng/mL时,敏感度为84.3%,特异度为55.0%。考虑为对照组存在其他非恶性肿瘤性泌尿系统疾病的干扰,使对照组NMP22结果上升导致。同时,比较膀胱癌组不同分期、分级患者NMP22水平时发现,虽然NMP22随着膀胱癌临床分期的升高,其敏感度有升高的趋势,但差异无统计学意义。
Miyanag等[8]研究证实,BTA检测膀胱癌的敏感度显著高于尿细胞学检测的敏感度,尤其是对于体积小的、孤立的、浅表肿瘤,BTA的敏感度比尿细胞学高得多。deVeve White等[9]也发现,BTA检测膀胱癌的敏感度大于尿细胞学检查,并且BTA在正常志愿者中的特异度为95.5%。本研究发现,膀胱癌组BTA水平高于对照组。与尿细胞学对比,BTA敏感度更高,但特异度也更低。同时,比较膀胱癌组不同分期、分级患者BTA水平时发现,BTA水平的变化无统计学差异。
CK20是成熟肠细胞和杯状细胞的主要细胞蛋白,特异性地存在于胃肠黏膜中。在一些腺癌的上皮细胞中发现CK20蛋白的存在,例如结肠直肠癌、尿路上皮细胞癌和默克尔细胞癌,但在肺癌和非黏液性卵巢癌中不存在。利用这个特点,CK20可以作为一类理想的上皮性肿瘤的标记物[10]。Buchumensky等[11]采用RT-PCR方法测定尿液中CK20的表达水平,发现CK20对膀胱癌的诊断阳性率达91%,明显高于尿细胞学;在健康志愿组中,CK20全部阴性,其特异度高达100%。本研究结果显示,肿瘤组CK20水平高于对照组;CK20检测膀胱癌的敏感度为76.6%,特异度为85.0%;比较膀胱癌组不同分期、分级患者CK20检测膀胱癌的敏感度差异无统计学意义。正常人的尿路上皮中CD44少量表达,当尿路上皮发生早期恶变时,CD44水平会逐渐增加,之后又随着肿瘤发展侵袭,CD44表达又逐渐减少[12]。Woodman等[13]采用ELISA试剂检测尿液中CD44水平,发现膀胱肿瘤患者尿液中CD44水平高于健康志愿组,其敏感性可达到81.1%,而特异性接近100%。本研究结果显示,膀胱癌组CD44水平高于对照组。依据CD44的ROC曲线,当CD44取临界值为348.8 ng/mL时,AUC为0.859,与其他标记物比较CD44的AUC最大,说明在单一肿瘤标记物中,CD44检测诊断膀胱癌的准确性最高。
Tilki等[14]比较膀胱癌患者和非肿瘤的对照受试者尿标本中的CEACAM1水平,发现在健康志愿者、NMIBC以及MIBC患者尿中CEACAM1的检出率分别为0、76%、100%。研究者还发现,CEACAM1水平随着膀胱癌的分期、分级增加而增高。本研究结果显示,膀胱癌组CEACAM1水平高于对照组,CEACAM1检测膀胱癌的敏感度为68.8%,特异度为75.0%;CEACAM1检测膀胱癌的敏感度随着膀胱癌分期升高而增加,而对不同分级膀胱癌的诊断敏感度无统计学差异。
目前,仍缺乏一种标记物可以达到较高的敏感度和特异度来检测膀胱癌。肿瘤标记物的联合可以弥补单一标记物的缺陷,能够得到更高的特异度以及敏感度。李扬等[15]将NMP22、UBC、BTA联合来对膀胱癌进行检测,发现3种标记物联合的总阳性率为96.9%,特异度为80.0%,优于单一肿瘤标记物。孙羿等[16]对BTA、NMP22、透明质酸(HA)、生存蛋白、CD44、VEGF和VUC 7种肿瘤标记物进行两项联合检测,发现联合检测敏感度最高的是NMP22+HA和HA+CD44。本研究选用了目前被公认有诊断价值的5项肿瘤标志物来检测膀胱癌,发现当5项肿瘤标记物联合检测时,敏感度为98.4%,但特异度却降至35.0%。不同标记物组合比较,CD44、CK20、BTA 3种标记物组合具有较高的敏感度和特异度,在保证特异度达到80.0%的情况下,敏感度达到96.8%;ROC曲线分析可见,3者联合检测的诊断效能高于其他组合。另外,考虑到经济效益,当CD44与CK20联合时,敏感度为93.7%,特异度为80.0%,在保持较高敏感度以及特异度的前提下,二者联合花费更少。后续的临床应用需要结合肿瘤标记物联合检测的效能、花费和临床实践综合决策选择最佳方案。
参考文献:
[1] Parkin DM, Bray F, Ferlay J, et al. Global cancer statistics, 2002[J]. CA Cancer J Clin, 2005,55(2):74-108.
[2] Babjuk M, Oosterlinck W, Sylvester R, et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder[J]. Eur Urol, 2008,54(2):303-314.
[3] Kirkali Z, Chan T, Manoharan M, et al. Bladder cancer: epidemiology, staging and grading, and diagnosis[J]. Urology, 2005,66(6):4-34.
[4] Sylvester RJ, van der Meijden APM, Oosterlinck W, et al. Predicting recurrence and progression in individual patients with stage Ta T1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials[J]. Eur Urol, 2006,49(3):466-477.
[5] Landman J, Chang YL, Kavaler E, et al. Sensitivity and specificity of NMP22, telomerase and BTA in the detection of human bladder cancer[J]. Urology, 1998,52:398-402.
[6] Carpinto GA, Stadler WM, Briggman JV, et al. Urinary nuclear matrix protein as a marker for transitional cell carcinoma of the urinary tract[J]. J Urol, 1996,156:1280-1285.
[7] Zippen C, Pandrangi L, Agarwal A. NMP22 is a sensitive cost-effctive test in patients at risk for bladdrer cancer[J]. J Urol, 1999,161:62-67.
[8] Miyanaga N, Akaza H, Kameyama S, et al. Significance of the BTA test in bladder cancer: a multicenter trial[J]. Int J Urol, 1997,4(6):557-560.
[9] deVere White RW, Soloway MS, Sheinfeld J, et al. Results of a multicenter trial using the BTA test to monitor for and diagnose recurrent bladder cancer[J]. J Urol, 1995,154(2):379-384.
[10] Moll M, Lowe A, Laufer J, et al. Cytokeratin 20 in human carcinomas: a new histodiagnostic marker detected by monoclonal antibodies[J]. Am J Pathol, 1992,140:427-447.
[11] Buchumensky V, Klein A, Zemer R, et al. Cytokeratin 20: a new marker for early detection of bladder cell carcinoma[J]. J Urol, 1998,160(6):1971-1974.
[12] Stavropoulos NE, Filliadis I, Ioachim E, et al. CD44 standard form expression as a predictor of progression in high risk superficial bladder tumors[J]. Int Urol Nephrol, 2001,33:479-483.
[13] Woodman AC, Goodison S, Drake M, et al. Noninvasive diagnosis of bladder carcinoma by enzyme-linked immunosorbent assay detection of CD44 isoforms in exfoliated urothelia[J]. Clin Cancer Res, 2000,6:2381-2392.
[14] Tilki D, Singer BB, Shariat SF, et al. CEACAM1: a novel urinary marker for bladder cancer detection[J]. Eur Urol, 2010,57(4):648-654.
[15] 李扬,郑衍平,许旭昀,等.尿NMP22、UBC及BTA联合检测在膀胱癌早期诊断中的意义研究[J].国际检验医学杂志,2011,32(11):1187-1188.
[16] 孙羿,何辉,马强,等.膀胱肿瘤抗原和透明质酸等七项肿瘤标志物在膀胱肿瘤诊断中的应用价值[J].中华医学杂志,2005,85(35):2507-2512.

