多重耐药鲍曼不动杆菌耐药基因检测及同源性分析
刘恋,丁银环,向成玉,吴泽才,杨葵,唐敏,刘靳波
(西南医科大学附属医院,四川泸州646000)
鲍曼不动杆菌是医院感染的重要致病菌,它能在无生命的物体表面生存,并通过受感染的物体传播给易感人群[1,2]。此外,鲍曼不动杆菌能通过本身固有的或获得的机制对常用抗菌药物产生耐药性[3]。碳青霉烯类抗菌药物是治疗鲍曼不动杆菌感染的有效药物[4,5];然而,由于全球抗菌药物耐药性的影响,对此类抗菌药物耐药的鲍曼不动杆菌不断增加。在中国,碳青霉烯类耐药鲍曼不动杆菌的感染率从2005年的31%上升到2014年的66.7%[6],并且多重耐药鲍曼不动杆菌(MDR-AB)的感染率也在不断上升。MDR-AB多重耐药的机制十分复杂,几乎涉及了所有的抗菌药物耐药机制。本文就MDR-AB的同源性及其耐药机制进行研究,现报告如下。
1 材料与方法
1.1 菌株来源
收集2015~2016年西南医科大学附属医院各临床科室分离的非重复MDR-AB 63株,标本主要为各科室住院患者送检的痰液及分泌物,按标准方法进行分离和培养。
1.2 菌株对常用抗菌药物的耐药情况观察
采用微量肉汤稀释法测定亚胺培南、美罗培南、头孢他啶、头孢吡肟、左氧氟沙星、环丙沙星、阿米卡星、多黏菌素8种抗菌药物对MDR-AB的最低抑菌浓度(MIC)。以512 μg/mL为起始浓度,倍比稀释法制备11个浓度梯度(分别为512、256、128、64、32、16、8、4、2、1、0.5 μg/mL)的药物,分别加入到灭菌96孔聚苯乙烯板的第1~11孔中,100 μL/孔,第12孔加入无药水解酪蛋白胨(MH)肉汤作为空白对照。将生长良好的目标菌落制备成0.5麦氏浓度的菌悬液,经MH肉汤1∶500稀释后向每孔加入100 μL,加盖后置于37 ℃普通空气孵箱中,孵育16~20 h后判读结果,此时第1~11孔的药物浓度分别为256~0.25 μg/mL,无细菌生长的第1孔为最低抑菌浓度,以铜绿假单胞菌(ATCC27853)、大肠埃希菌(ATCC25922)为质控菌株进行同批次试验。各药物的药敏折点判断标准:以50%细菌被抑制时的MIC为MIC50,90%细菌被抑制时的MIC为MIC90。
1.3 耐药基因TEM、AmpC、OXA-23及外排泵基因adeB、adeJ、adeG表达检测
使用北京天根DNA提取试剂盒(离心柱型)提取63株菌株的全基因组DNA为模板,TaKaRa扩增试剂盒进行PCR扩增,引物由上海生工生物工程股份有限公司合成。引物序列:OXA-23上游5′-GATCGGATTGGAGAACCAGA-3′,下游5′-ATTTCTGACCGCATTTCCAT-3′;AmpC上游5′-CGGGCAATACACCAAAAGAC-3′,下游5′-CCTTAATGCGCTCTTCATTTGG-3′;TEM上游5′-AG-GAAGAGTATGATTCAACA-3′,下游5′-CTCGTCGTT-TGGTATGGC-3′;adeB上游5′-TTAACGATAGCGTTGTAACC-3′,下游5′-TGAGCAGACAATGGAATAGT-3′;adeJ上游5′-ATTGCACCACCAACCGTAAC-3′,下游5′-TAGCTGGATCAAGCCAGATA-3′;adeG上游5′-TTCATCTAGCCAAGCAGAAG-3′,下游5′-ATGTGGGCTAGCTAACGGC-3′。扩增总体系为25 μL:ddH2O 12.875 μL、TaKaRa Taq(5 U/μL)0.125 μL、10×PCR Buffer 2.5 mL、MgCl2(25 mmol/L)1.5 mL、dNTP Mixture(各2.5 mmol/L)2 μL、模板DNA 2 μL、上下游引物(10 μmmoL/L)各1 μL。PCR扩增条件:98 ℃ 10 s,55 ℃ 30 s,72 ℃ 1 min,共30个循环。扩增产物采用1.5%琼脂糖于电泳仪中110 V电泳30 min,使用TaKaRa DL2000 DNA Marker作为分子量标准,凝胶成像系统观察电泳结果并拍照保存,以电泳出现明亮的条带并且该条带与预期产物大小相同判断为基因表达阳性。
1.4 菌株的同源性分析
采用肠杆菌科基因间重复序列-聚合酶链反应(ERIC-PCR)法对63株菌株进行同源性分析。引物序列:ERIC-PCR上游5′-TGTAAGCTCCTGGGGATTCAC-3′,下游5′-AAGTAAGTGACTGGGGTGAGCG-3′。扩增体系为:引物各1 μL,DNA模板2.5 μL,PCR Master Mix 12.5 μL,双蒸水8 μL。反应条件为:94 ℃预变性5 min;94 ℃变性1 min、26 ℃复性1 min、72 ℃延伸1 min,共4个循环;然后94 ℃变性30 s、40 ℃复性30 s、72 ℃延伸1 min,共40个循环;最后72 ℃延伸10 min。扩增产物在含溴化乙锭的2%琼脂糖凝胶仪上进行电泳,电压90 V,时间90 min,以DL2000 DNA Marker作为分子量标准,于凝胶成像系统观察结果并拍照,采用Quantity One软件进行聚类分析,以相似性80%为同一型别判定标准。
2 结果
2.1 菌株耐药情况
63株菌株对亚胺培南、美罗培南、头孢他啶、头孢吡肟、左氧氟沙星、环丙沙星、阿米卡星7种抗菌药物的MIC50、MIC90均属于耐药水平。见表1。
2.2 主要耐药基因检测结果
在63株菌株中,表达TEM基因50株(79.4%),表达AmpC基因58株(92.1%),表达OXA-23基因62株(98.4%),同时表达以上3种耐药基因45株(71.4%)。携带外排泵基因adeB、adeJ、adeG的菌株分别为61株(96.8%)、62株(98.4%)、62株(98.4%)。
2.3 菌株的同源性分析结果
经ERIC-PCR扩增后的DNA片段形成的条带4~10条,63株菌株经基因分型共分为5个型别,分别命名为A~E型,其中A型58株(占92.1%),B型2株,C、D、E型各1株。
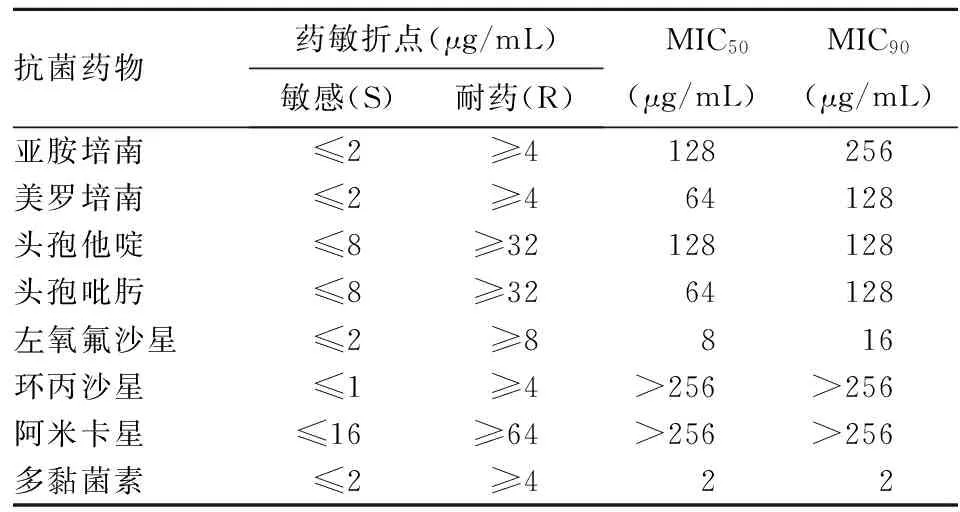
表1 63株多重耐药鲍曼不动杆菌药敏结果
3 讨论
鲍曼不动杆菌是条件致病菌,容易导致患有严重基础疾病、年老及抵抗力弱的患者发生感染。CHINET中国细菌耐药监测网监测结果显示,从2010年到2014年,鲍曼不动杆菌的检出率已超越铜绿假单胞菌,成为排名第3的医院感染致病菌[6],MDR-AB的检出率居高不下[7]。本研究中,63株MDR-AB仅对多黏菌素敏感,对亚胺培南、美罗培南、头孢他啶、头孢吡肟、左氧氟沙星、环丙沙星、阿米卡星的MIC50均属耐药水平,MIC90也远超耐药折点,耐药现象非常严重。MDR-AB的耐药机制十分复杂,包括产生各种β-内酰胺酶、外膜通透性下降、药物作用靶位改变、外排泵的过度表达及产生生物被膜等[8]。
细菌产生的β-内酰胺酶主要分为4类,A类主要是指广谱β-内酰胺酶,包含TEM、SHV、KPC等;B类为金属β-内酰胺酶,包含IMP、VIM和SIM;C类即AmpC酶;D类为苯唑西林酶,又称OXA碳青霉烯酶,其中OXA-23为我国最常见的苯唑西林酶。各类β-内酰胺酶的共同作用可以介导鲍曼不动杆菌对青霉素、碳青霉烯类、单环酰胺类及头孢菌素抗菌药物产生耐药[8]。本研究分析了63株MDR-AB中β-内酰胺酶的携带情况,结果显示,OXA-23基因的阳性率最高,为98.2%,与文献[9]报道一致;TEM基因检出率为79.4%;AmpC基因检出率为92.1%;同时携带以上3种耐药基因的菌株占71.4%。本研究中,63株MDR-AB对碳青霉烯类抗菌药物耐药率高达100%,对头孢类等抗菌药物的耐药率>92.0%,说明产生β-内酰胺酶是导致MDR-AB多重耐药的原因之一。
外排泵的过表达是细菌对抗菌药物耐药的一个重要途径,在能量的参与下可将细菌体内的药物或代谢产物泵出体外,最终导致细菌出现耐药。基因组学研究发现,外排泵系统广泛存在于鲍曼不动杆菌中。在5类外排泵超家族中,与鲍曼不动杆菌耐药相关的主要是耐药结节分化(RND)超家族中的外排泵,由膜转运蛋白、膜融合蛋白、膜通道蛋白3部分组成,RND超家族包括adeABC、adeIJK、adeFGH系统,它们的过度表达可导致氨基糖苷类、喹诺酮类、头孢菌素类、四环素等抗菌药物产生耐药。adeABC于2001年发现,是第一个报道的RND外排泵系统[10],随后于2008年和2010年分别发现adeIJK和adeFGH系统。adeB为adeABC外排系统的膜转运体蛋白,其编码基因adeB是介导adeABC外排系统产生耐药的主要因素。adeJ是adeIJK外排系统中的外排蛋白,adeIJK的过度表达可导致鲍曼不动杆菌对β-内酞胺类、碳青霉烯酶类、氟喹诺酮类、氯霉素、四环素等抗菌药物产生耐药。adeG是典型的RND蛋白。Coyne等[11]研究发现,adeFGH外排系统为鲍曼不动杆菌所固有,但部分细菌中不存在adeFGH,过度表达的adeFGH可介导菌株对磺胺类、氟喹诺酮类及克林霉素等高水平耐药。本研究对MDR-AB进行RND外排泵结构基因adeB、adeG、adeJ检测,结果表明,3种外排泵基因广泛存在于MDR-AB中,adeB、adeG、adeJ的检出率分别为96.8%、98.4%、98.4%;同时检出3种泵基因的菌株占98.4%;有1株MDR-AB 3种基因均未检出,并且其β-内酰胺酶检测也均为阴性,表明存在RND超家族外的其他外排泵发挥作用。
基因分型在医院感染的爆发流行中起重要作用。ERIC-PCR属于基因分型技术的一种,其与脉冲场凝胶电泳技术结果一致性高[12,13],并且具有简便、快捷、重复性好、稳定性高等特点,适用于临床细菌的分型检测。ERIC-PCR是根据肠杆菌科细菌中高度保守的反向重复序列设计引物,通过PCR扩增产生不同的DNA片段,并通过琼脂糖电泳分析条带进行基因分型,可以认为ERIC-PCR是一种半随机扩增PCR[14]。本研究通过ERIC-PCR对63株MDR-AB进行基因分型,结果显示,63株菌株可分为A、B、C、D、E 5型,其中A型占92.1%,B、C、D、E型均为散在菌株。说明本研究中临床分离的MDR-AB大部分为同一菌株克隆进化而来,提示MDR-AB存在小型暴发流行的可能。
综上所述,β-内酰胺酶及主动外排系统在MDR-AB中分布广、存在率高,医院科室之间的克隆播散及临床科室对抗菌药物的不合理使用可能导致鲍曼不动杆菌出现多重耐药。因此临床需合理使用抗菌药物,加强对已有抗菌药物的改进及新型抗菌药物的研发迫在眉睫。
参考文献:
[1] Zhen X, Chen Y, Hu X, et al. The difference in medical costs between carbapenem-resistant Acinetobacter baumannii and non-resistant groups: a case study from a hospital in Zhejiang province, China[J]. Eur J Clin Microbiol Infect Dis, 2017,36(10):1989-1994.
[2] Henig O, Weber G, Hoshen MB, et al. Risk factors for and impact of carbapenem-resistant Acinetobacter baumannii colonization and infection: matched case-control study[J]. Eur J Clin Microbiol Infect Dis, 2015,34(10):2063-2068.
[3] Djordjevic ZM, Folic MM, Folic ND, et al. Risk factors for hospital infections caused by carbapanem-resistant Acinetobacter baumannii[J]. J Infect Dev Ctries, 2016,10(10):1073-1080.
[4] Qureshi ZA, Hittle LE, O′Hara JA, et al. Colistin-resistant Acinetobacter baumannii: beyond carbapenem resistance[J]. Clin Infect Dis, 2015,60(9):1295-1303.
[5] Ozsurekci Y, Aykac K, Cengiz AB, et al. Bloodstream infections in children caused by carbapenem-resistant versus carbapenem-susceptible gram-negative microorganisms: Risk factors and outcome[J]. Diagn Microbiol Infect Dis, 2017,87(4):359-364.
[6] Hu FP, Guo Y, Zhu DM, et al. Resistance trends among clinical isolates in China reported from CHINET surveillance of bacterial resistance, 2005-2014[J]. Clin Microbiol Infect, 2016,22(Suppl 1):S9-14.
[7] 张辉,张小江,徐英春,等.2005~2014年CHINET不动杆菌属细菌耐药性监测[J].中国感染与化疗杂志,2016,16(4):429-436.
[8] 岳明,盛传伦.鲍曼不动杆菌耐药机制的研究进展[J].中国实验诊断学,2015,19(12):2156-2158.
[9] 廖晚珍,杨璐,温桂兰,等.耐碳青霉烯类鲍曼不动杆菌6种基因及ISAbal插入序列的研究[J].检验医学,2012,27(9):749-753.
[10] Magnet S, Courvalin P, Lambert T. Resistance-nodulation-cell division-type efflux pump involved in aminoglycoside resistance in Acinetobacter baumannii strain BM4454[J]. Antimicrob Agents Chemother, 2001,45(12):3375-3380.
[11] Coyne S, Rosenfeld N, Lambert T, et al. Overexpression of resistance-nodulation-cell division pump AdeFGH confers multidrug resistance in Acinetobacter baumannii[J]. Antimicrob Agents Chemother, 2010,54(10):4389-4393.
[12] 李永丽,应春妹,陈艺升.ERIC-PCR技术在鲍曼不动杆菌基因分型中的应用评估[J].检验医学,2013,28(7):621-624.
[13] 郭湘,费樱.耐碳青霉烯酶类抗生素鲍曼不动杆菌的同源性及其对亚胺培南的耐药机制[J].山东医药,2016,56(21):19-21.
[14] 杨柳,张邑帆,郑华,等.ERIC-PCR及其指纹图谱技术的研究[J].中国微生态学杂志,2010,22(9):845-847.

