单磷酸腺苷激活的蛋白激酶(AMPK)调控机制的研究进展
林志忠,叶志云,林圣彩,林舒勇
(厦门大学生命科学学院,福建 厦门 361102)
三磷酸腺苷(ATP)是几乎所有细胞和有机体中最重要的能量载体,ATP水解成二磷酸腺苷(ADP)所释放出的能量直接用于绝大多数生命活动,当能量进一步缺乏时ADP可再转变为单磷酸腺苷(AMP)以提供更多的能量;而当能量充足时,细胞又可将AMP和ADP 重新转化成ATP从而将能量存储起来.在正常情况下,大部分真核细胞中的ATP浓度始终维持在一个非常稳定的水平,因此细胞中必然存在一个可以感知ATP、ADP和AMP水平变化的机制.
AMP激活的蛋白激酶(AMP-activated protein kinase,AMPK)目前已被公认是有机体和细胞内感应能量水平并调节代谢稳态的最重要分子.早期的研究发现,向大鼠的肝脏匀浆中加入AMP或ADP,可以有效地抑制2种脂肪酸合成过程中的关键酶——3-羟基-3-甲基戊二酸单酰辅酶A还原酶(HMG-CoA reductase)和乙酰辅酶A羧化酶(acetyl-CoA carboxy-lase,ACC)的活力从而强烈地抑制肝脏的脂肪合成[1-3].进一步的研究表明,这一抑制作用实际上是由AMP引起的,且依赖于某个未知蛋白激酶的催化反应[4].为了找到这个未知的蛋白激酶,苏格兰邓迪大学的Hardie实验室对大鼠肝脏匀浆进行了分离和纯化,并对能够响应AMP抑制ACC的组分进行了近4年的细致分析,终于在1989年找到了一个由分子质量分别为63,38和35 ku的3个亚基组成的蛋白,并根据该蛋白能被AMP激活的特性将其命名为AMPK[5].
后来的研究表明,当细胞内处于能量缺乏状态时,AMPK被激活,进而直接导致了多条信号通路的抑制或激活并引起一系列的生理变化(图1),包括:促进脂肪细胞中甘油三酯的水解[6],促进肝脏对血液中脂肪酸的摄取和氧化[7],抑制脂肪酸和胆固醇的合成以及甘油三酯的形成[8-9],促进肌肉中脂类氧化以及葡萄糖的摄取和分解[10-11],抑制胰岛β细胞分泌胰岛素以及糖原的合成[12],抑制蛋白质的合成并促进自噬作用[13-15]和酮体的生成[16]等.其中,抑制脂肪酸合成并促进其氧化被认为是AMPK最经典的功能,主要是通过磷酸化并抑制其底物ACC的活力实现的,而ACC又是脂肪酸合成的关键酶[10].这些作用的结果是增加体内的产能代谢,减少体内的耗能代谢,稳定体内能量水平,维持能量稳态,从而保证细胞的正常生命活动.由此可见,AMPK是机体内最重要的能量稳态调节者,它的功能和人类的生存与健康密切相关.
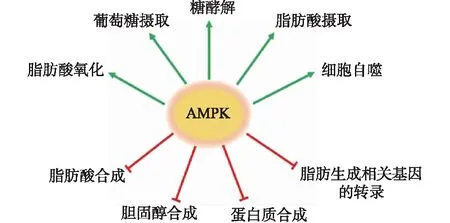
图1 AMPK参与调控的许多重要细胞生物学过程Fig.1 Multiple important cellular biological processes regulated by AMPK
1 AMPK的结构
AMPK是由α、β和γ 3个亚基构成的一个异源三聚体.α亚基的N 端是AMPK催化活性的核心区域,包含一个保守的丝氨酸/苏氨酸激酶结构域(kinase domain,KD)、C端的β亚基相互作用结构域(β-subunit interacting domain,β-SID)和与C端紧邻的自抑制结构域(autoinhibitory domain,AID),其中AID的作用是通过结合KD来抑制α亚基的激酶活性[17-18];β亚基包含一个中等碳水化合物的结合模块(mid-molecule carbohydrate-binding module,CBM)和一段位于C末端的连接α和γ亚基的结合序列(α,γ subunit-binding sequence,SBS);γ亚基含有4个参与结合ATP、AMP等的胱硫醚β-合成酶(cystathionine-β-synthase,CBS)结构域.当AMP结合到γ亚基上的CBS结构域时会引起该亚基发生变构,随后影响AID的构象,使α亚基上的苏氨酸172(T172)位点暴露出来,导致该位点被AMPK的上游激酶磷酸化[18-22];同时由于AMP的结合导致的构象变化还可阻止该位点的去磷酸化,从而使AMPK保持较高的激活水平.相反地,ATP的结合则能够抑制这一过程[23-24].
在哺乳动物细胞中,AMPK的α和β亚基各包含2种不同的亚型(α1、α2和β1、β2),γ亚基包含3种不同的亚型(γ1、γ2和γ3),这些亚型均由不同的基因编码表达,它们可以组合成至少12种不同的AMPK三聚体[25-26].研究发现这些亚型的表达具有组织特异性,γ2在人体的心肌细胞中高度表达,而γ3则集中表达于快速抽动的骨骼肌细胞中;此外,在不同物种之间这些亚型的表达差异很大,如γ2在人的心肌细胞中高表达,但在小鼠的心肌细胞中表达量却很低,而在小鼠的脑组织和脂肪组织中又是高表达的[27-28].因此,AMPK不同亚型之间的关联性及其在不同物种、不同组织细胞中所发挥的功能还有待进一步的深入研究.
2 AMPK的调控机制
如上所述,AMPK的激活依赖于其T172位点的磷酸化,目前已发现2种主要的上游激酶,分别为肝脏激酶B1(liver kinase B1,LKB1)和钙离子/钙调蛋白依赖蛋白激酶β(Ca2+/calmodulin-activated protein kinase β,CaMKKβ)[29-32].LKB1是一个肿瘤抑制因子,自身处于持续激活的状态,当组织缺氧、缺血或运动导致细胞内能量缺乏时,细胞内AMP/ATP比值上升,AMP与AMPK结合时后者的构象发生改变,使得AMPK的T172位点暴露出来,从而使LKB1能够对该位点进行磷酸化,并可使其活性上升100倍以上[29];而CaMKKβ则需要在细胞内钙离子浓度升高时才能被激活,并进而磷酸化AMPK[30,33].另外,早期的研究表明ADP与AMPK结合亦可引发与AMP相同的效应[34-35];但是较新的一项研究证明,只有当AMP与AMPK结合后LKB1才对其T172位点进行磷酸化,而ADP的结合只参与了抑制该位点的去磷酸化[22].然而,这些发现大都基于体外的生化实验,AMPK在体内被激活的机制,以及AMP对AMPK磷酸化的具体作用长期以来一直不为人知.
2013年,本课题组率先揭开了AMPK在体内被激活的“路线图”,发现体轴发育抑制因子(axis inhibitor,AXIN)是LKB1激活AMPK所必需的,其中AXIN是一个多功能的构架蛋白,参与调节许多信号通路,如Wnt、JNK和p53等,对细胞生长起重要的调控作用[36-40].当细胞在饥饿状态下,由于AMP结合至AMPK后增强了后者对AXIN的亲和力,而AXIN自身与LKB1有很强的相互作用,所以此时的AXIN起到了一个桥梁的作用,将AMPK和其上游激酶LKB1连接在一起,三者形成一个复合体,促进了LKB1对AMPK的磷酸化激活,使得AMPK的活性升高[41](图2).以上研究成果完善了AMPK活性调控过程中的关键一环,揭示了AMP促进AMPK磷酸化的分子机制.
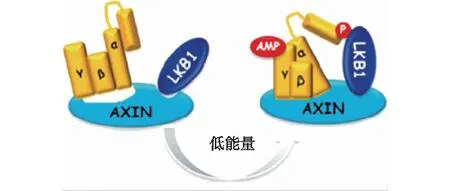
图2 AXIN激活AMPK的机制[41]Fig.2 Mechanism of AMPK activation by AXIN[41]
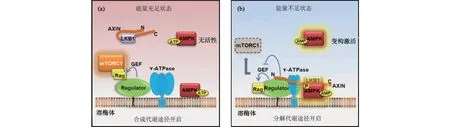
引自参考文献[42],经修改.图3 v-ATPase-Ragulator复合体调控AMPK和mTORC1活化切换的机制Fig.3 Mechanism of switch between AMPK and mTORC1 activation regulated by v-ATPase-Ragulator complex
随后,本课题组又通过酵母双杂交的方式找到了和AXIN相互作用的溶酶体相关膜蛋白LAMTOR1,并且证明该蛋白也是能量缺乏情况下AMPK激活所必需的[42].LAMTOR1是一个锚定在溶酶体膜表面的蛋白复合体Ragulator的重要成员,在缺乏LAMTOR1的小鼠或细胞中,饥饿信号不能引起AMPK的激活.在能量充足的情况下,Ragulator通过其自身的鸟苷酸交换因子(guanine nucleotide exchange factor,GEF)激活鸟苷酸酶Rag,从而使哺乳动物雷帕霉素靶蛋白复合体1(mammalian target of rapamycin complex 1,mTORC1)迁移到溶酶体上并被激活,这时合成代谢途径开启(图3(a));而在能量不足的情况下,溶酶体上的能量感知者空泡型ATP酶(vacuolar-type ATPase,v-ATPase)发生变构,通过与其相互作用的Ragulator复合体共同促进AXIN-LKB1迁移到溶酶体上并与Ragulator结合,最后在此激活AMPK,同时AXIN抑制了Ragulator的GEF活力,进一步促进 mTORC1的解离,从而关闭合成代谢途径,开启分解代谢途径(图3(b)).
综上,本课题组发现细胞内由于葡萄糖缺乏所引起的AMPK激活是在溶酶体膜上进行的,并且揭示了该过程所涉及的蛋白质机器.这一发现不仅揭示了AMPK在体内生理状态下被激活的方式与过程,也解析了细胞在营养物质缺乏的情况下调节合成代谢与分解代谢的切换机制.
此外,除了能量缺乏以外,AMPK还可以响应多种药物的刺激而被激活[43].根据作用机制的不同可以将这些药物分为以下3大类:1) 线粒体复合体抑制剂,通过抑制呼吸链来提高细胞内AMP/ADP水平从而激活AMPK,常见的如二甲双胍(metformin)[44]、黄连素[45]等;2) AMP类似物的前体化合物,如5-氨基-4-甲酰胺咪唑核糖核苷酸(5-aminoimidazole-4-carboxamide ribonucleoside,AICAR)[46]和近几年被发现的一种膦酸类化合物5-(5-hydroxyl-isoxazol-3-yl)-furan-2-phosphonic acid[47],这些化合物可在细胞内转变为AMP类似物,从而直接提高AMP水平使AMPK被激活;3)AMPK激活剂,可直接作用于AMPK使之构象发生变化并随后被激活,包括最早发现的被命名为A769662的化合物[48]以及最近发现的991[49]和MT-63-78[50].在上述这些药物中,二甲双胍是一个重要的代表性药物,已被广泛应用于治疗Ⅱ型糖尿病,它能通过激活AMPK来缓解脂肪肝并降低并发症风险[51].
为了进一步探究Ragulator-AXIN在药理情况下对AMPK激活过程的调控作用,本课题组对缺失了LAMTOR1的小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)进行二甲双胍处理,发现二甲双胍不能在这些细胞中激活AMPK;同样地,对于LAMTOR1肝脏特异性敲除的小鼠,二甲双胍也不能在其肝脏中激活AMPK;进而在缺失了AXIN的细胞和小鼠肝脏中检测了二甲双胍对AMPK的激活作用,发现AXIN是二甲双胍激活AMPK所必需的,且二甲双胍激活AMPK也是通过溶酶体途径进行的,并依赖于上述溶酶体上的v-ATPase-Ragulator感应复合体[52].这一发现不仅解决了二甲双胍如何激活AMPK的重要问题,还为人们了解二甲双胍降低糖尿病人的肿瘤发生机制打开了窗口.
3 AMPK和葡萄糖感应
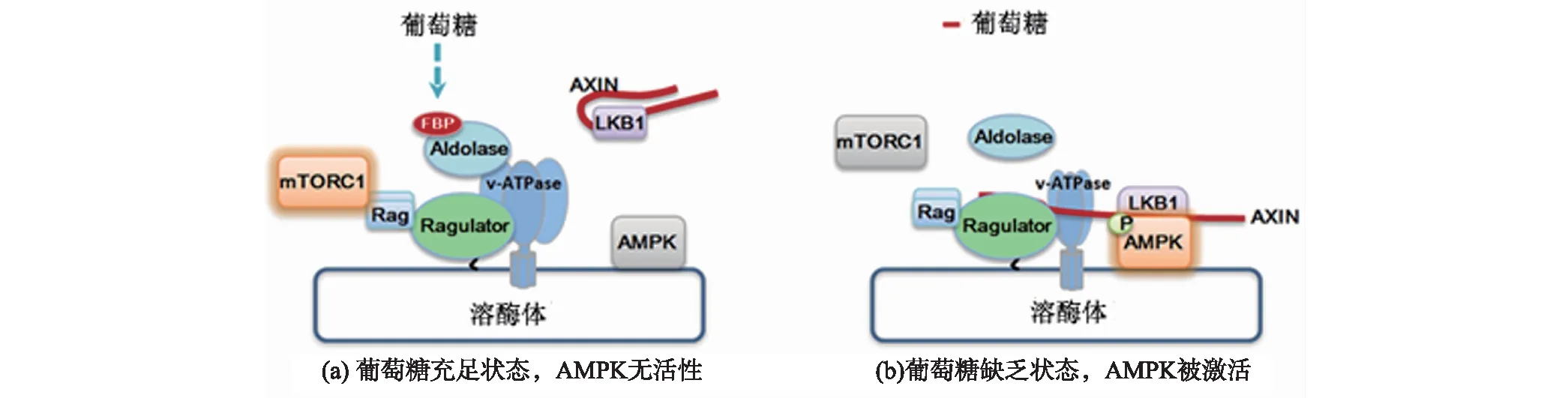
引自参考文献[59],经修改.图4 细胞感知葡萄糖水平的分子机制Fig.4 Molecular mechanism of glucose sensing in cell
葡萄糖是生物界最基本、最主要的供能物质,故其水平和机体的能量代谢状态本身就具有紧密的联系;此外,葡萄糖代谢的中间产物又是几乎所有合成代谢途径最重要的原材料来源.可见,感受葡萄糖的水平并随时作出相应的响应是生物体维持代谢平衡的基本功能.AMPK能够响应机体葡萄糖水平的变化,并在其水平下降的时候被激活,该机制在各种表达有AMPK的真核生物中高度保守,从酵母到哺乳动物中都已被发现[53],是进化上少有的经典表型.
饥饿、运动等生理过程都会导致整体或某个器官的葡萄糖水平变化.在葡萄糖水平下降时,激活的AMPK能够通过一系列方式维持代谢平衡和机体的正常生理功能.例如:饥饿能够引起血液和组织液中葡萄糖水平的下降,AMPK在此时被激活,进而促进肝脏等组织中脂肪酸的β-氧化,使之转换为利用脂肪酸[7];与此同时,AMPK还能促进肝脏生成酮体,通过血液供给脑部等不能利用脂肪酸的器官,以满足这些组织的能量需求.许多生物的生命活动有昼夜节律(circadian rhythms),这种周期性也引起了机体内葡萄糖水平的周期性变化[54],而AMPK能够响应这种变化并维持机体能量稳态[55].近年来,人们利用AMPK和葡萄糖之间的密切联系开发了许多药物,来模拟葡萄糖缺失的情况以激活AMPK,如无法被代谢的葡萄糖类似物2-DG和5-TG等[56-57],这些药物能够通过阻断葡萄糖代谢达到激活AMPK的目的,并已应用于某些肿瘤的前期实验中[58].
因此,葡萄糖水平的感应对于AMPK的激活至关重要,是打开代谢稳态维持机制之门的“钥匙”.然而,AMPK如何感应机体的葡萄糖水平并被激活的机制长期以来并不清楚,甚至存在重大的误区.由于AMP在AMPK激活过程中的重要而经典的地位,它一直以来被认为是AMPK唯一的激活信号;同时,传统的理论把葡萄糖看作一种“能量信号”,它的下降将引起细胞内ATP水平的下降和AMP水平的上升,后者作为激活剂直接激活AMPK.但实际上,并没有一种生理状态能够验证以上理论.
本课题组在对AMPK激活机制的深入研究中发现,无论是在葡萄糖缺乏的细胞培养条件下,还是在饥饿的低血糖动物体内,都不能检测到AMP水平的上升,但与此同时AMPK却处在被激活的状态,这说明葡萄糖水平的降低与“能量缺失”无关,即与AMP水平无关,而是通过一种新的信号和一条独立于能量代谢的通路来调控AMPK的激活.
本课题组之前已经发现了一条响应葡萄糖缺失并激活AMPK的溶酶体途径[42],揭示了内源AMPK的激活过程.在此基础上,进一步研究AMPK感受和响应葡萄糖水平而被激活的机制,成功地鉴定出传递葡萄糖水平的“信使”——果糖1,6-二磷酸(fructose-1,6-bisphosphate,FBP),同时找到了感应这一“信使”的“感受器”——参与糖酵解通路的醛缩酶(aldolase),依靠这一套完整的信号系统,葡萄糖水平就能够作为一种具体的信号调节AMPK的激活乃至整个机体的代谢稳态[59].具体地说,当葡萄糖水平下降时,葡萄糖代谢物FBP的水平也相应地下降,该过程进一步被醛缩酶所感应,后者将启动激活AMPK的溶酶体途径进而介导AMPK的激活(图4).
这一发现改变了人们一直以来认为的AMPK活性只被代表低能量的AMP调节的观点,是对传统AMPK激活机制的一次重新认识;并据此提出,葡萄糖水平是机体的一种“状态信号”,通过调节AMPK的激活从而调节机体代谢的总平衡.这对全面了解细胞代谢稳态维持的分子机制、糖代谢和相关应激反应乃至生理、病理进程有重要意义,且有助于为研发治疗人类重大疾病的药物提供全新、有效的靶点.
4 AMPK和疾病
糖尿病是一种糖脂代谢稳态失调、紊乱的疾病.已有研究发现,在肥胖小鼠和Ⅱ型糖尿病病人的外周组织中,AMPK的活性明显被抑制[60-61].而AMPK的激活能够促进肌肉中的葡萄糖转运蛋白GLUT4转移到细胞膜上[62-63],增加肌肉对血液中葡萄糖的吸收和分解代谢,从而降低血糖[64].在肝脏中,当ATP缺乏引起AMPK的激活后,AMPK可以通过磷酸化转录辅激活因子CRTC2(也称TORC2)促进其出核,或者通过磷酸化去乙酰化酶HDAC4/5/7促进转录因子FOXO1出核,这两种方式的结果都是抑制肝脏的糖异生途径,从而降低血糖[65-67].
除了代谢性疾病,许多肿瘤的发生和代谢紊乱也有着密切的联系.肿瘤以及肿瘤微环境与正常组织相比的一个重要特征就是代谢过程的不同,而代谢紊乱进一步促进了肿瘤的发生和发展[68-69].由于肿瘤组织的快速增殖消耗大量营养,肿瘤微环境是一个营养匮乏的环境,这将引起肿瘤组织中AMPK的激活[70].在细胞水平上,已经有大量的研究表明AMPK的激活可以通过抑制mTORC1复合体而抑制肿瘤细胞的合成代谢,从而阻止其增殖[71];还可以通过促进p53的活性引起肿瘤细胞的生长阻滞和凋亡,从而抑制肿瘤细胞的生长[72-74].因此,在多种肿瘤组织,如黑色素瘤、乳腺癌、结肠癌和肺癌组织中,AMPK的表达或者活性被强烈抑制,进一步打破了这些组织中原有的合成代谢和分解代谢的平衡,加剧了肿瘤的发展[70,75-76].肿瘤微环境对免疫细胞中AMPK的激活则反过来阻止了促炎症免疫细胞的分化和发育以及相关免疫因子的释放,使之处于休眠状态不能被激活并发挥效应,从而抑制了免疫反应对肿瘤组织的识别和杀灭,导致肿瘤的生长更加不受控制[77].
5 结语与展望
作为能量代谢调节的核心分子,AMPK一直是细胞代谢领域研究的重点.虽然近年来人们已经在该领域获得了一系列的新发现,然而对AMPK精细的调控机制还需要更深层次的研究.目前已知AMPK的激活存在以下两条截然不同的途径:1) 依赖于AMP(AMP-dependent)的经典途径;2) 不依赖于AMP(AMP-independent)而通过糖酵解通路中代谢酶aldolase的途径.那么,进一步需要回答的重要问题就是细胞如何根据生理状况对上述两种途径做出选择.另外,本课题组的研究发现细胞中存在两个激活AMPK的位置——溶酶体和细胞质.那么,在这两个位置上激活的AMPK是否有不同的底物及其生理意义也是后续研究中有待解决的问题,这不仅能够帮助人们更深刻地理解AMPK以及代谢稳态的调控机制,还有助于理解和操控相关的重要生理过程和病理过程,最终为战胜威胁人类健康的重大疾病贡献力量.
过去的十几年来,人们也一直在研发以AMPK为靶点用于治疗代谢性疾病的药物,并已筛选出了一些潜在的AMPK激活剂,如国际制药巨头Pfizer公司筛选出的名为991的化合物.然而,这些激活剂虽然在体外实验中可以有效地激活AMPK,但其面临的真正挑战是能否在动物体内以及人体内也发挥同样的功能.随着人们对AMPK激活机制的不断深入研究与解析,或许在不久的将来有望见证以全新的作用机制激活AMPK的药物问世.
参考文献:
[1]GIL G,SITGES M,BOVÉ J,et al.Phosphorylation-dephosphorylation of rat liver 3-hydroxy 3-methylglutaryl coenzyme A reductase associated with changes in activity[J].FEBS Lett,1980,110(2):195-199.
[2]HARWOOD H J,JR,BRANDT K G,RODWELL V W.Allosteric activation of rat liver cytosolic 3-hydroxy-3-methylglutaryl coenzyme A reductase kinase by nucleoside diphosphates[J].J Biol Chem,1984,259(5):2810-2815.
[3]CARLSON C A,KIM K H.Regulation of hepatic acetyl coenzyme A carboxylase by phosphorylation and dephosphorylation[J].J Biol Chem,1973,248(1):378-380.
[4]CARLING D,ZAMMIT V A,HARDIE D G.A common bicyclic protein kinase cascade inactivates the regulatory enzymes of fatty acid and cholesterol biosynthesis[J].FEBS Lett,1987,223(2):217-222.
[5]CARLING D,CLARKE P R,ZAMMIT V A,et al.Purification and characterization of the AMP-activated protein kinase.Copurification of acetyl-CoA carboxylase kinase and 3-hydroxy-3-methylglutaryl-CoA reductase kinase activities[J].Eur J Biochem,1989,186(1/2):129-136.
[6]GAUTHIER M S,MIYOSHI H,SOUZA S C,et al.AMP-activated protein kinase is activated as a consequence of lipolysis in the adipocyte:potential mechanism and physiological relevance[J].J Biol Chem,2008,83(24):16514-16524.
[7]SAVAGE D B,CHOI C S,SAMUEL V T,et al.Reversal of diet-induced hepatic steatosis and hepatic insulin resis-tance by antisense oligonucleotide inhibitors of acetyl-CoA carboxylases 1 and 2[J].J Clin Invest,2006,116(3):817-824.
[8]SMITH B K,MARCINKO K,DESJARDINS E M,et al.Treatment of nonalcoholic fatty liver disease:role of AMPK[J].Am J Physiol Endocrinol Metab,2016,311(4):E730-E740.
[9]LI Y,XU S,MIHAYLOVA M M,et al.AMPK phosphorylates and inhibits SREBP activity to attenuate hepatic steatosis and atherosclerosis in diet-induced insulin-resis-tant mice[J].Cell Metab,2011,13(4):376-388.
[10]MERRILL G F,KURTH E J,HARDIE D G,et al.AICA riboside increases AMP-activated protein kinase,fatty acid oxidation,and glucose uptake in rat muscle[J].Am J Physiol,1997,273(1):E1107-E1112.
[11]O′NEILL H M,MAARBJERG S J,CRANE J D,et al.AMP-activated protein kinase (AMPK) β1β2 muscle null mice reveal an essential role for AMPK in maintaining mitochondrial content and glucose uptake during exercise[J].Proc Natl AcadSci USA,2011,108(38):16092-16097.
[12]SALT I P,JOHNSON G,ASHCROFT S J,et al.AMP-activated protein kinase is activated by low glucose in cell lines derived from pancreatic β cells,and may regulate insulin release[J].Biochem J,1998,335(3):533-539.
[13]INOKI K,ZHU T,GUAN K L.TSC2 mediates cellular energy response to control cell growth and survival[J].Cell,2003,115(5):577-590.
[14]GWINN D M,SHACKELFORD D B,EGAN D F,et al.AMPK phosphorylation of raptor mediates a metabolic checkpoint[J].Mol Cell,2008,30(2):214-226.
[15]EGAN D F,SHACKELFORD D B,MIHAYLOVA M M,et al.Phosphorylation of ULK1 (hATG1) by AMP-activated protein kinase connects energy sensing to mitophagy[J].Science,2011,331(6016):456-461.
[16]WINDER W W,HARDIE D G.AMP-activated protein kinase,a metabolic master switch:possible roles in type 2 diabetes[J].Am J Physiol,1999,277(1):E1-E10.
[17]PANG T,XIONG B,LI J Y,et al.Conserved α-helix acts as autoinhibitory sequence in AMP-activated protein kinase α subunits[J].J Biol Chem,2007,282(1):495-506.
[18]CHEN L,JIAO Z H,ZHENG L S,et al.Structural insight into the autoinhibition mechanism of AMP-activated protein kinase[J].Nature,2009,459(7250):1146-1149.
[19]XIAO B,HEATH R,SAIU P,et al.Structural basis for AMP binding to mammalian AMP-activated protein kinase[J].Nature,2007,449(7161):496-500.
[20]XIN F J,WANG J,ZHAO R Q,et al.Coordinated regulation of AMPK activity by multiple elements in the α-subunit[J].Cell Res,2013,23(10):1237-1240.
[21]OAKHILL J S,CHEN Z P,SCOTT J W,et al.β-Subunit myristoylation is the gatekeeper for initiating metabolic stress sensing by AMP-activated protein kinase (AMPK)[J].Proc Natl Acad Sci USA,2010,107(45):19237-19241.
[22]GOWANS G J,HAWLEY S A,ROSS F A,et al.AMP is a true physiological regulator of AMP-activated protein kinase by both allosteric activation and enhancing net phosphorylation[J].Cell Metab,2013,18(4):556-566.
[23]CARLING D,THORNTON C,WOODS A,et al.AMP-activated protein kinase:new regulation,new roles?[J].Biochem J,2012,445(1):11-27.
[24]OAKHILL J S,SCOTT J W,KEMP B E.AMPK functions as an adenylate charge-regulated protein kinase[J].Trends in Endocrinology and Metabolism,2012,23(3):125-132.
[25]CARLING D,MAYER F V,SANDERS M J,et al.AMP-activated protein kinase:nature′s energy sensor[J].Nat Chem Biol,2011,7(8):512-518.
[26]MILAN D,JEON J T,LOOFT C,et al.A mutation in PRKAG3 associated with excess glycogen content in pig skeletal muscle[J].Science,2000,288(5469):1248-1251.
[27]CHEUNG P C F,SALT I P,DAVIES S P,et al.Characterization of AMP-activated protein kinase g-subunit isoforms and their role in AMP binding[J].Biochem J,2000,346(3):659-669.
[28]HAWLEY S A,BOUDEAU J,REID J L,et al.Complexes between the LKB1 tumor suppressor,STRAD α/β and MO25 α/β are upstream kinases in the AMP-activated protein kinase cascade[J].J Biol,2003,2(4):28.
[29]HAWLEY S A,PAN D A,MUSTARD K J,et al.Calmo-dulin-dependent protein kinase kinase-β is an alternative upstream kinase for AMP-activated protein kinase[J].Cell Metab,2005,2(1):9-19.
[30]WOODS A,DICKERSON K,HEATH R,et al.Ca2+/calmodulin-dependent protein kinase kinase-β acts upstream of AMP-activated protein kinase in mammalian cells[J].Cell Metab,2005,2(1):21-33.
[31]WOODS A,JOHNSTONE S R,DICKERSON K,et al.LKB1 is the upstream kinase in the AMP-activated protein kinase cascade[J].Curr Biol,2003,13(22):2004-2008.
[32]SUTER M,RIEK U,TUERK R,et al.Dissecting the role of 5′-AMP for allosteric stimulation,activation,and deactivation of AMP-activated protein kinase[J].J Biol Chem,2006,281(43):32207-32216.
[33]HURLEY R L,ANDERSON K A,FRANZONE J M,et al.The Ca2+/calmoldulin-dependent protein kinase kinases are AMP-activated protein kinase kinases[J].J Biol Chem,2005,280(32):29060-29066.
[34]XIAO B,SANDERS M J,UNDERWOOD E,et al.Structure of mammalian AMPK and its regulation by ADP[J].Nature,2011,472(7342):230-233.
[35]OAKHILL J S,STEEL R,CHEN Z P,et al.AMPK is a direct adenylate charge-regulated protein kinase[J].Science,2011,332(6036):1433-1440.
[36]ZENG L,FAGOTTO F,ZHANG T,et al.The mouseFusedlocus encodes Axin,an inhibitor of the Wnt signaling pathway that regulates embryonic axis formation[J].Cell,1997,90(1):181-192.
[37]RUI Y,XU Z,LIN S,et al.Axin stimulates p53 functions by activation of HIPK2 kinase through multimeric complex formation[J].EMBO J,2004,23(23):4583-4594.
[38]LI Q,WANG X,WU X,et al.Daxx cooperates with the Axin/HIPK2/p53 complex to induce cell death[J].Cancer Res,2007,67(1):66-74.
[39]LI Q,LIN S,WANG X,et al.Axin determines cell fate by controlling the p53 activation threshold after DNA damage[J].Nat Cell Biol,2009,11(9):1128-1134.
[40]RUI Y,XU Z,XIONG B,et al.Aβ-catenin-independent dorsalization pathway activated by Axin/JNK signaling and antagonized by aida[J].Dev Cell,2007,13(2):268-282.
[41]ZHANG Y L,GUO H,ZHANG C S,et al.AMP as a low-energy charge signal autonomously initiates assembly of AXIN-AMPK-LKB1 complex for AMPK activation[J].Cell Metab,2013,18(4):546-555.
[42]ZHANG C S,JIANG B,LI M,et al.The lysosomal v-ATPase-Ragulator complex is a common activator for AMPK and mTORC1,acting as a switch between cata-bolism and anabolism[J].Cell Metab,2014,20(3):526-540.
[43]HARDIE D G.AMPK:sensing energy while talking to other signaling pathways[J].Cell Metab,2014,20(6):939-952.
[44]HAWLEY S A,FULLERTON M D,ROSS F A,et al.The ancient drug salicylate directly activates AMP-activated protein kinase[J].Science,2012,336(6083):918-922.
[45]HARDIE D G.AMP-activated protein kinase:maintaining energy homeostasisat the cellular and whole-body levels[J].Annu Rev Nutr,2014,34(34):31-55.
[46]GADALLA A E,PEARSON T,CURRIE A J,et al.AICA riboside both activates AMP activated protein kinase and competes with adenosine for the nucleoside transporter in the CA1 region of the rat hippocampus[J].J Neurochem,2004,88(5):1272-1282.
[47]GO′MEZ-GALENO J E,DANG Q,NGUYEN T H,et al.A potent and selective AMPK activator that inhibits de novo lipogenesis[J].ACS Med Chem Lett,2010,1(9):478-482.
[48]COOL B,ZINKER B,CHIOU W,et al.Identification and characterization of a small molecule AMPK activator that treats key components of type 2 diabetes and the metabolic syndrome[J].Cell Metab,2006,3(6):403-416.
[49]XIAO B,SANDERS M J,CARMENA D,et al.Structural basis of AMPK regulation by small molecule activators[J].Nat Commun,2013,4(1):3017.
[50]ZADRA G,PHOTOPOULOS C,TYEKUCHEVA S,et al.A novel direct activator of AMPK inhibits prostate cancer growth by blocking lipogenesis[J].EMBO Mol Med,2014,6(4):519-538.
[51]FORETZ M,GUIGAS B,BERTRAND L,et al.Metformin:from mechanisms of action to therapies[J].Cell Metab,2014,20(6):953-66.
[52]ZHANG C S,LI M,MA T,et al.Metformin activates AMPK through the lysosomal pathway[J].Cell Metab,2016,24(4):521-522.
[53]HARDIE D G,CARLING D.The AMP-activated protein kinase:fuel gauge of the mammalian cell?[J].Eur J Biochem,1997,246(2):259-273.
[54]MARCHEVA B,RAMSEY K M,BUHR E D,et al.Disruption of the clock components CLOCK and BMAL1 leads to hypoinsulinaemia and diabetes[J].Nature,2010,466(7306):627-631.
[55]JORDAN S D,LAMIA K A.AMPK at the crossroads of circadian clocks and metabolism[J].Mol Cell Endocrinol,2013,366(2):163-169.
[56]CRAMER F B,WOODWARD G E.2-Desoxy-D-glucose as an antagonist of glucose in yeast fermentation[J].Journal of the Franklin Institute,1952,253(4):354-360.
[57]ZHANG D,LI J,WANG F,et al.2-Deoxy-D-glucose targeting of glucose metabolism in cancer cells as a potential therapy[J].Cancer Lett,2014,355(2):176-183.
[58]ROWE I,CHIARAVALLI M,MANNELLA V,et al.Defective glucose metabolism in polycystic kidney disease identifies a new therapeutic strategy[J].Nat Med,2013,19(4):488-493.
[59]ZHANG C S,HAWLEY S A,ZONG Y,et al.Fructose-1,6-bisphosphate and aldolase mediate glucose sensing by AMPK[J].Nature,2017,548(7665):112-116.
[60]VIOLLET B,HORMAN S,LECLERC J,et al.AMPK inhibition in health and disease[J].Crit Rev Biochem Mol Biol,2010,45(4):276-295.
[61]WU Y,SONG P,XU J,et al.Activation of protein phosphatase 2A by palmitate inhibits AMP-activated protein kinase[J].J Biol Chem,2007,282(13):9777-9788.
[62]TREEBAK J T,GLUND S,DESHMUKH A,et al.AMPK-mediated AS160 phosphorylation in skeletal muscle is dependent on AMPK catalytic and regulatory subunits[J].Diabetes,2006,55(7):2051-2058.
[63]MCGEE S L,VAN DENDEREN B J,HOWLETT K F,et al.AMP-activated protein kinase regulates GLUT4 transcription by phosphorylating histone deacetylase 5[J].Diabetes,2008,57(4):860-867.
[64]HUANG S,CZECH M P.The GLUT4 glucose transpor-ter[J].Cell Metab,2007,5(4):237-252.
[65]KOO S H,FLECHNER L,QI L,et al.The CREB co-activator TORC2 is a key regulator of fasting glucose metabolism[J].Nature,2005,437(7062):1109-1111.
[66]MIHAYLOVA M M,VASQUEZ D S,RAVNSKJAER K,et al.Class Ⅱ a histone deacetylases are hormone-activated regulators of FOXO and mammalian glucose homeostasis[J].Cell,2011,145(4):607-621.
[67]WANG B,MOYA N,NIESSEN S,et al.A hormone-dependent module regulating energy balance[J].Cell,2011,145(4):596-606.
[68]PAVLOVA N N,THOMPSON C B.The emerging hallmarks of cancer metabolism[J].Cell Metab,2016,23(1):27-47.
[69]CAIRNS R A,HARRIS I S,MAK T W.Regulation of cancer cell metabolism[J].Nat Rev Cancer,2011,11(2):85-95.
[70]INOKI K,KIM J,GUAN K L.AMPK and mTOR in cellular energy homeostasis and drug targets[J].Annu Rev Pharmacol Toxicol,2012,52(1):381-400.
[71]BUDANOV A V,KARIN M.p53 target genes sestrin1 and sestrin2 connect genotoxic stress and mTOR signaling[J].Cell,2008,134(3):451-460.
[72]ADAMOVICH Y,ADLER J,MELTSER V,et al.AMPK couples p73 with p53 in cell fate decision[J].Cell Death Differ,2014,21(9):1451-1459.
[73]JONES R G,PLAS D R,KUBEK S,et al.AMP-activated protein kinase induces a p53-dependent metabolic checkpoint[J].Mol Cell,2005,18(3):283-293.
[74]SHACKELFORD D B,SHAW R J.The LKB1-AMPK pathway:metabolism and growth control in tumour suppression[J].Nat Rev Cancer,2009,9(8):563-575.
[75]PINEDA C T,RAMANATHAN S,FON TACER K,et al.Degradation of AMPK by a cancer-specific ubiquitin ligase[J].Cell,2015,160(4):715-728.
[76]VILA I K,YAO Y,KIM G,et al.A UBE2O-AMPKα2 axis that promotes tumor initiation and progression offers opportunities for therapy[J].Cancer Cell,2017,31(2):208-224.
[77]O′NEILL L A,HARDIE D G.Metabolism of inflammation limited by AMPK and pseudo-starvation[J].Nature,2013,493(7432):346-355.

