2例太岁样品分离菌的初步研究
佟嘉辉,熊向华,汪建华,徐威,张惟材
1.沈阳药科大学,辽宁 沈阳 110016;2.军事医学研究院 生物工程研究所,北京 100071
太岁也称肉芝。明代李时珍著《本草纲目》[1]中对其描述为:“肉芝状如肉,附于大石,头尾具有,乃生物也。赤者如珊瑚、白者如截肪、黑者如泽漆、青者如翠羽、黄者如紫金,皆光明洞彻如坚冰也。”太岁样品多发现于土层中[2],形如肉体,体型较大,表面光滑湿润,颜色多样,至今生物学界对其归类仍未给出明确答案。郑科研等[3]通过研究太岁样本的化学组成,推测其主体为聚乙烯醇,同时含有少量多糖及各种杂菌;朱春玉[4]等则测定了太岁中核酸、多糖、蛋白质等各生物体组成要素含量;西北大学戴璐[5]在对太岁样本的衍生体进行菌分离时共分离得到2种黏菌和18种真菌;王欣[6]从上述同一样本中分离得到35种细菌和1种黏细菌,其优势菌群属β-变性菌纲伯克霍尔德菌目(Burkholderiales);林涧等[7]从2例太岁样品中分离得到假丝酵母(Candida)和黏质红酵母(Rhodotorula mucilaginosa)。本实验室收集了10余例来自不同地区的太岁样本,着重对其中2例样本的分离菌株进行分子生物学鉴定及分析,以期获得对太岁样品的生物学本质及其组成的初步认识。
1 材料与方法
1.1 材料
黄色太岁(编号YF142)、白色太岁(编号ZWG0525)样品由本实验室保存;大肠杆菌DH5α感受态、三氟乙酸(TFA)、7种单糖标准品[葡萄糖(Glc)、甘露糖(Man)、半乳糖(Gal)、鼠李糖(Rha)、阿拉伯糖(Ara)、葡萄糖醛酸(GlcUA)、半乳糖醛酸(GalUA)]、琼脂糖凝胶DNA回收试剂盒购自天根生化科技有限公司;pMD18T载体购自宝生物工程(大连)有限公司;DNA markers、HifiTaqDNA聚合酶购自北京全式金生物技术有限公司;1-苯基-3-甲基-5-吡唑啉酮(PMP)购自生工生物公司;甲醇、磷酸、葡萄糖等试剂购自国药集团化学试剂有限公司;引物合成及测序由北京六合华大基因科技股份有限公司完成。
Olympus BX-51显微镜(WH 10×/22,100×/ 1.35 oil Iris);Waters 600高效液相色谱仪;Wa⁃ters Xbridge-C18(4.6 mm×150 mm)色谱柱。
1.2 太岁样品预处理
太岁样品表面消毒[8]。于超净台中切取块状太岁样品,用75%酒精浸润12 min后用无菌水反复冲洗振荡若干次,回收最后一次冲洗液,取适量涂布于培养基平板上,30℃恒温培养以检测消毒效果。
1.3 太岁样品的菌分离及其分子生物学鉴定
1.3.1 太岁样品分离菌的获取 采用林涧等[7]所述菌株分离法获取分离菌株,涂布于真菌培养基平板上(包括无抗及卡那霉素抗性YPD培养基、无抗及卡那霉素抗性麦芽汁培养基、虎红培养基及沙氏培养基),30℃恒温倒置培养3 d,挑取单菌落平板划线培养。
1.3.2 太岁样品分离菌16S rDNA、18S rDNA、ITS、NS序列测定 50 μL反应体系[7],以1 μL提取的太岁样品总DNA为模板。16S rDNA PCR扩增条件:95℃ 10 min;95℃ 30 s,50℃退火30 s,72℃延伸90 s,循环30次;72℃ 10 min;ITS和18S rDNA扩增条件:95℃ 10 min;95℃ 30 s,55℃退火30 s,72℃延伸 90 s,循环30次;72℃10 min。PCR产物经1%琼脂糖凝胶电泳,用胶回收试剂盒切胶回收目的基因后,一部分直接进行测序,一部分连接pMD18T载体,选取阳性克隆后进行测序。将基因序列与GenBank数据库进行Blast比对,确定分离菌株的分类位置。
1.4 太岁样品分离菌多糖组成分析
1.4.1 鞘氨醇单胞菌属发酵多糖分离 YPD培养基于30℃发酵培养72 h后,沸水浴溶解发酵液,12 000 r/min离心10 min提取上清液,加入2倍量的95%乙醇,4℃过夜醇沉,12 000 r/min离心10 min得到分泌的胞外多糖。
1.4.2 多糖样品水解 取1 mL提取的多糖样品置于具塞试管中,加入2 mol/L TFA 2 mL,涡旋混匀,110℃水解8 h,取出冷却至室温,12 000 r/ min离心5 min,取上清,用0.2 mol/L NaOH溶液调pH值至7,将水解液定容至10 mL。
1.4.3 衍生化 准确称取上述7种单糖标准品,配制100 μg/mL单糖标准品溶液及混糖溶液(葡萄糖、半乳糖、甘露糖、阿拉伯糖终浓度为50 μg /mL,葡萄糖醛酸、半乳糖醛酸、鼠李糖终浓度为5 μg/mL的溶液);取各单糖标准液、混合糖标准液和样品溶液100 μL置于不同试管中,依次加入50 μL 0.5 mol/L PMP甲醇溶液和50 μL 0.2mol/L NaOH溶液,涡旋混匀,70℃水浴反应40 min,冷却至室温,加入100 μL 0.3 mol/L HCl溶液中和,用400 μL氯仿萃取,涡旋4 min混匀,4500 r/min离心5 min,取上层水相,重复3次,上层水相经滤器过滤混匀,待用,20 μL进样分析。1.4.4 HPLC分析条件 Waters Xbridge-C18柱,标准液进样量20 μL,样品进样量50 μL,柱温25℃,检测波长250 nm。流动相A为15%乙腈磷酸盐缓冲液(50 mmol/L,pH6.9),流动相B为40%乙腈磷酸盐缓冲液(50 mmol/L,pH6.9);梯度模式设置:时间为0→10→30→40 min时,相应浓度梯度为0%→10%→30%→0%流动相B。
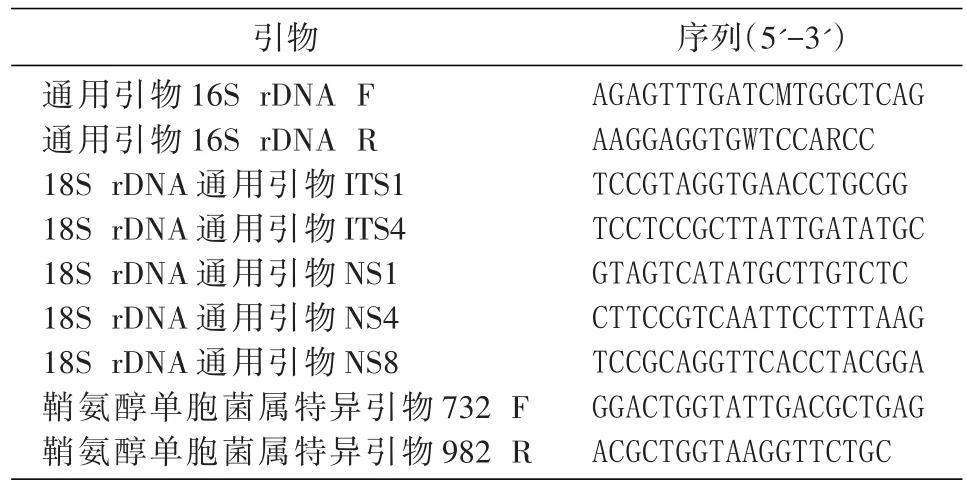
表1 扩增引物及序列
2 结果
2.1 太岁样品的形态学观察
编号YF142的黄色太岁样品外观为黄褐色肉质,有弹性,有条纹带,内部成束状并伴有少量白色硬结,表面光滑湿润;编号ZWG0525的白色太岁样品体型较大,外观为白色,有弹性,表面光滑湿润,有类似蕈菌类的伞盖和薄膜,切割时有韧性。见图1。
2.2 对太岁样品中分离得到的4株共性菌的初步研究
对2例太岁样品进行菌株分离,通过培养观察及Blast比对,结果表明2例太岁样品中均含有以下4种原核菌株:TS-1号菌株为荧光假单胞菌(Pseudomonas fluorescens),TS-2号菌株为地中海短波单胞菌(Brevundimonas mediterranea)(其16S rDNA部分序列上传至GenBank,序列号为MF 668251,长度为1331 bp),TS-3号菌株为红串红球菌(Rhodococcus erythropolis),TS-4号为鞘氨醇单胞菌属(Sphingomonassp.)菌株。见图2、表2。

图1 2例太岁样品
2.3 鞘氨醇单胞菌属分离菌的初步研究

图2 分离菌株在无抗性YPD培养基上的菌落形态及显微照片(×100)

表2 对太岁样品中分离得到的4株共性菌的培养观察
文献调研表明,鞘氨醇单胞菌属在生物降解方面具有优势,与太岁较为类似。同时,鞘氨醇单胞菌属可分泌胞外多糖,推测其可能与太岁的形成有关,因此着重对其进行研究。采用鞘氨醇单胞菌特异引物(732 F/982 R)[9]对提取的太岁总DNA进行PCR扩增,得到一条约250 bp的条带,测序结果表明在提取的太岁总DNA中存在鞘氨醇单胞菌基因,并非污染产生。
采用YPD培养基培养TS-4分离菌,30℃发酵72 h后形成黄色冻状物(图3),沸水浴溶解发酵液后,12 000 r/min离心10 min提取上清液,加入2倍量的95%乙醇于4℃过夜醇沉,12 000 r/min离心10 min得到分泌的胞外多糖(图4),通过HPLC对其单糖组成进行分析。
2.4 HPLC分析多糖的单糖组成
混糖标准品PMP衍生后进样梯度流动相HPLC分离结果见图5。鞘氨醇单胞菌属分离菌发酵多糖PMP衍生后进样梯度流动相HPLC分离结果见图6,确认其由甘露糖、鼠李糖、葡萄糖组成,经标准品峰面积定量后对样品进行分析,其相对摩尔比约为6∶1∶3。
3 讨论
太岁是自然界中存在的一种特殊的未知生命体,至今生物学界对其归类仍未给出明确答案。1992年西北大学对首例太岁样本进行了分析鉴定,认为太岁是一种“特大型罕见黏菌复合体”,并获得一定认可。我们通过微生物学角度研究太岁样本的菌种组成,以期初步了解太岁的生物多样性。采用多种真菌分离培养基对上述2例太岁样品进行菌分离时,从无抗性YPD及麦芽汁培养基平板中分离得到多株相同形态的不同菌株,测序鉴定结果均为细菌,并且2例太岁样品中均含有上述4株菌株。经文献调研,河北师范大学李亮等在NCBI提交的太岁浸液中的29例菌种信息,其中10例为短波单胞菌属,5例为鞘氨醇单胞菌属,3例为假单胞菌属,与我们的结果很相似。结合王朝江[10-11]通过构建16S rDNA文库分析太岁样品细菌多样性的结果,我们认为2例来源地不同的太岁之间可能在生物学组成上存在一定的相似性,也提示不同太岁间存在一定的生物共性。

图3 TS-4分离菌发酵72 h后菌体形成冻状及其显微观察(×100)
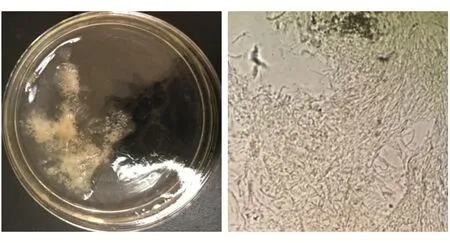
图4 TS-4分离菌发酵72 h后分离得多糖及其显微观察(×100)

图5 混糖标准液HPLC分离结果1:甘露糖;2:鼠李糖;3:葡萄糖醛酸;4:半乳糖醛酸;5:葡萄糖;6:半乳糖;7:阿拉伯糖

图6 鞘氨醇单胞菌属分离菌发酵多糖HPLC分离结果
我们发现上述2例太岁样品菌分离得到的菌株均为细菌,并未从中获得真菌,而在对其他较新鲜的太岁样品进行菌株分离时得到了2株酵母,经鉴定其中一株为汉逊德巴利酵母(Debaryo⁃myces hansenii),推测可能是某些太岁样品的组织层较厚不易破碎、真菌含量相对较低或不易在实验室条件下获得并培养、现有分离手段不完善或样品保存条件等原因所致。因此,获取新鲜的太岁样品,对于太岁的研究非常重要。
志谢:江苏靖江太岁金波生物科技有限公司,上海收藏协会太岁传习所陈建平、张网根、朱跃峰、王莉莉为本研究提供了太岁样本,特此致谢!
[1] 李时珍.本草纲目[M].上海:商务印书馆,1954.
[2] WangChaojiang,WangShiqing.A research ofthe finding and distribution law of Taisui in modern Chi⁃ na[J].Agric Sci,2015,6:407-414.
[3] 郑科研,董兆麟.不明物体太岁的初步研究[J].西北大学学报,2010,40(6):12-17.
[4] 朱春玉,白婷婷,姜秋实,等.“太岁”生物学组分的研究 [J].微生物学杂志,2011,31(1):1-5.
[5] 戴璐.“大型黏菌复合体”黏菌和真菌多样性的初步研究[D].西安:西北大学,2007.
[6] 王欣.“大型粘菌复合体”细菌多样性及抑菌功能初步研究[D].西安:西北大学,2007.
[7] 林涧,熊向华,葛欣,等.2种太岁样品中微生物的分离和鉴定[J].生物技术通讯,2013,24(6):825-827.
[8] 刘宏生,朱春玉.一种从“太岁”中提取基因组的方法[P].中国:200910220112.7.2009-11-24.
[9] 周丽莎,李慧,张颖,等.石油污染土壤鞘氨醇单胞菌遗传多样性16S rDNA-PCR-DGGE分析[J].土壤学报, 2011,48(4):804-812.
[10]王朝江.16S rDNA克隆文库方法分析太岁样品中细菌的多样性[J].微生物学杂志,2017,37(3):95-99.
[11]王朝江,王世清.基于高通量测序技术对三种太岁样品细菌组成的分析[J].湖北农业科学,2017,56(13):2543-2547.

