CXCL1促进内质网应激在肝癌肿瘤微环境中传递
彭雨蒙,陈伟,邹岭,叶甲舟,白涛,陈洁,陈健康,王翠,刘宁,杨晓莉,魏从文,钟辉,吴飞翔,5
1.广西医科大学 附属肿瘤医院肝胆外科,广西 南宁 530021;2.湘南学院 附属医院,湖南 郴州 423000;3.中国人民武装警察部队总医院 检验科,北京 100039;4.军事医学研究院 生物工程研究所,北京 100850;5.广西肝癌诊疗工程技术研究中心,广西 南宁 530021
肿瘤细胞及其相关巨噬细胞等组成的肿瘤微环境与肿瘤从良性转化为恶性密切相关,促进肿瘤在没有生长因子条件下的存活,调控细胞免疫促进肿瘤自身的生长和转移[1-2]。内质网应激(endoplasmic reticulum stress,ERS)是指肿瘤微环境中的各种因素导致内质网中蛋白超负荷或折叠受阻,从而使内质网中未折叠的蛋白堆积[3]。ERS发生时,癌细胞常通过激活未折叠蛋白反应(unfolded protein reaction,UPR)3个相关信号通路IRE1、ATF6、PERK增加蛋白折叠,减少未折叠蛋白的合成,恢复内环境稳态,但当蛋白质错误折叠持续发生,诱导了持久且程度严重的ERS,UPR就会变成促进凋亡的通路[4-5]。近年来的研究表明,ERS不仅可通过肿瘤细胞间的相互激活UPR通路促进肿瘤细胞对ERS的耐受,同时可通过与巨噬细胞间相互作用促进肿瘤生长[6]。我们前期通过衣霉素(tunicamycin,TM)刺激人肝癌HepG2细胞诱导肝癌细胞发生ERS后,上清中趋化因子1(CXC chemokine ligand 1,CXCL1)的表达量显著高于趋化因子家族的其他成员,但在ERS的条件下,CXCL1对于微环境中肝癌细胞及肝癌相关巨噬细胞的作用尚不明确。在本研究中,我们收集发生ERS的人肝癌HepG2细胞上清,作用于未发生ERS的HepG2细胞和分化成熟的巨噬细胞(THP-1),探究CXCL1在ERS条件下对肝癌微环境中肝癌细胞和肿瘤相关巨噬细胞的作用。
1 材料与方法
1.1 材料
THP-1、HepG2细胞(军事医学研究院生物工程所钟辉课题组惠赠);DMEM培养基、1640培养基、胎牛血清(Gibco公司);转染试剂VigoFect(Qbiogene公司);衣霉素、丙二醇甲醚醋酸酯(TPA)、DMSO、人CXCL1 ELISA试剂盒(Sigma-Aldrich公司);TRNzol-A+总RNA提取试剂盒、Su⁃perReal荧光定量预混试剂彩色版(SYBR Green)(天根生化科技有限公司);TransScript Frist-Strand cDNA Synthesis试剂盒(全式金生物技术公司);jetPRIMEin vitroDNA&siRNA transfec⁃tion reagent(Polyplus公司)。
1.2 细胞培养
HepG2细胞用含10%胎牛血清的DMEM高糖培养基常规培养。THP-1细胞用含10%胎牛血清的1640培养基中培养,加入终浓度为200 U/mL的青、链霉素,当细胞长至密度为5×107/皿时,用0.1%TPA分2次诱导48 h,使THP-1分化为成熟巨噬细胞用于后续实验。
1.3 建立ERS时肝癌微环境中细胞间传递模型
收集条件培养基建立不同细胞间ERS传递模型[6]。HepG2细胞长至70%时,换成含10%胎牛血清的新鲜DMEM培养基,分别按未处理、5 mmol/mL DMSO和5 mmol/mL TM处理细胞12 h后换成新鲜培养基,再培养24 h收集培养基,离心后分别加入诱导成熟的THP-1和HepG2细胞中,分别培养12和24 h后收集细胞提取mRNA,实时荧光定量PCR检测HepG2和THP-1细胞IRE1、PERK、ATF6的mRNA表达情况。
1.4 ELISA检测培养基中的CXCL1含量
按照人CXCL1 ELISA试剂盒说明书检测培养基中的CXCL1含量。收集TM刺激后的条件培养基,离心后分别与标准样加入样板中,室温孵育1 h,洗板3次后,加入100 μL链霉亲和素-HRP工作液,室温孵育20 min,再次洗板3次后,TMB显色,终止液终止反应,酶标仪检测,计算CXCL1的含量。
1.5 实时荧光定量PCR检测
TRIzol法提取各组细胞RNA,按照逆转录试剂盒说明书逆转录成cDNA。SYBR Green染料法进行实时荧光定量PCR反应,扩增引物见表1,以β-actin为内参照。反应条件:95℃ 15 min,95℃10 s,根据不同目的基因60~66℃延伸30 s。
1.6 敲低HepG2细胞中CXCL1表达
合成siRNA-CXCL1序列(正义链:5'-CACCC AAACCGAAGUCAUAGCCA-3';反义链:5'-UGGC UAUGACUUCGGUUUGGGUG-3')。当HepG2细胞长至40%~50%时可用于转染。将2 μg质粒与100 μL生理盐水混匀,静置5 min,再将2 μL VigoFect与100 μL生理盐水混匀,将以上两者轻轻混合,室温静置15 min后加到培养基中;为提高敲低效率,于转染24 h后按上述步骤再转染一次;对照组转染空载体质粒;48 h后收集培养液及细胞,RT-PCR检测转染效率,ELISA检测上清中CXCL1的表达情况。
1.7 收集CXCL1敲低的条件培养基用于培养HepG2和TPH-1细胞
当CXCL1敲低的HepG2细胞长至70%时,换成含10%胎牛血清的新鲜DMEM培养基,再分未处理组、5 mmol/mL DMSO组、5 mmol/mL TM组,刺激12 h后换成新鲜培养基,再培养24 h收集培养基,离心后分别加到诱导成熟的THP-1和HepG2细胞中,分别培养12和24 h后收集细胞提取mRNA,RT-PCR检测HepG2和THP-1细胞IRE1、PERK、ATF6的mRNA表达情况。
1.8 数据分析处理
计量资料采用x±s表示,组间比较采用t检验,利用SPSS 22.0软件进行统计学分析,P<0.05为差异有统计学意义。
2 结果
2.1 构建ERS在细胞间传递的模型
收集TM刺激HepG2细胞后的条件培养基培养HepG2和TPH-1细胞12和24 h后,荧光定量PCR检测4组细胞中UPR相关IRE1、PERK、ATF6的mRNA水平。结果提示,2种细胞中3种蛋白的mRNA水平均较空白对照和DMSO对照组升高(图1、2)。

图1 ERS条件培养基刺激人肝癌HepG2细胞后UPR相关蛋白mRNA的表达
2.2 检测si-CXCL1的敲低效率
转染si-CXCL1敲低HepG2细胞的CXCL1水平,RT-PCR技术检测敲低效率,ELISA检测其培养基中分泌的CXCL1含量。结果显示,与对照组相比,si-CXCL的敲低效率达67.89%(图3),敲低后HepG2细胞分泌到培养基中的CXCL1也明显减少(P<0.05)(图4)。
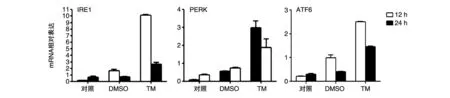
图2 ERS条件培养基刺激人巨噬细胞THP-1后UPR相关蛋白mRNA的表达

图3 RT-PCR检测si-CXCL1对293T细胞中CXCL1的敲低效率
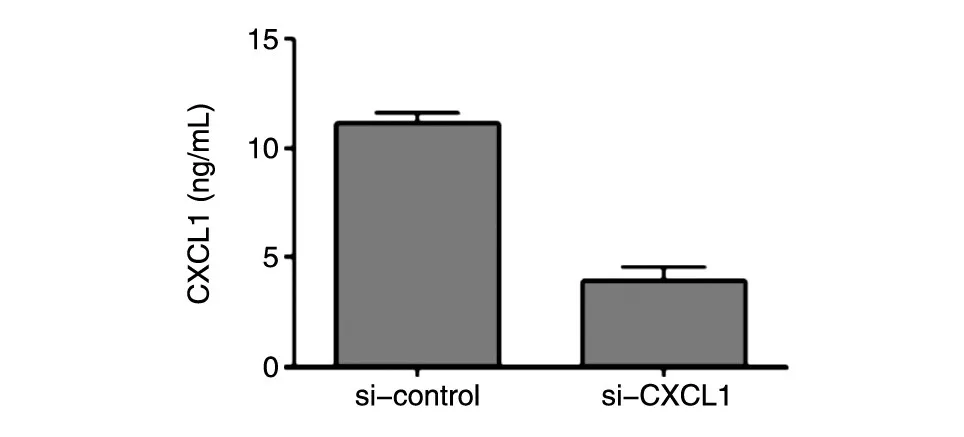
图4 ELISA检测si-CXCL1敲低293T细胞后培养基中CXCL1浓度
2.3 敲低CXCL1后对ERS在细胞间传递的影响
收集TM刺激后si-CXCL1的HepG2细胞的上清,离心后分别用于培养HepG2和TPH-1细胞,分别于12和24 h通过荧光定量PCR检测4组细胞中UPR相关IRE1、PERK、ATF6的mRNA水平。结果提示,HepG2和THP-1细胞中IRE1、PERK、ATF6的mRNA水平均较空白对照和DMSO对照组降低(图5、6)。
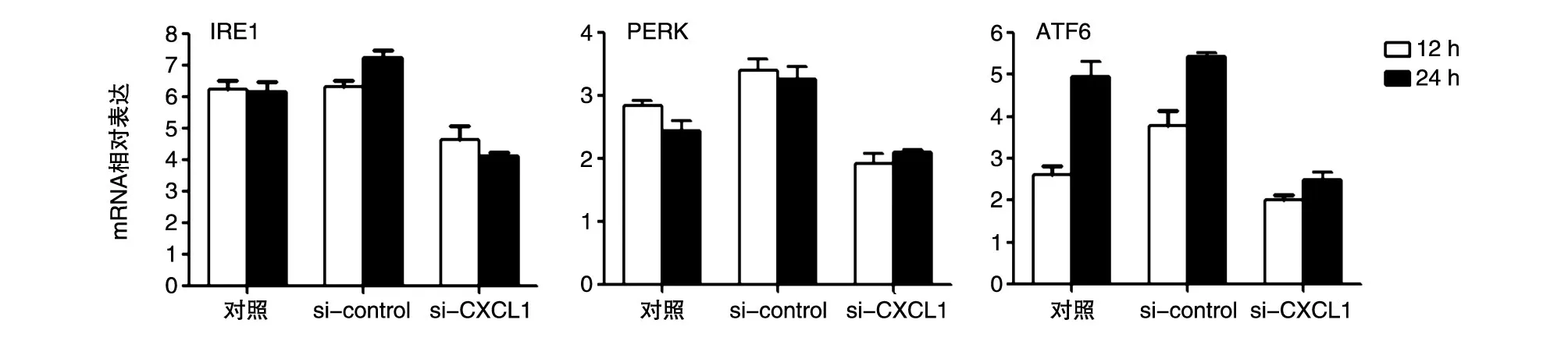
图5 CXCL1敲低的ERS条件培养基刺激人肝癌HepG2细胞后UPR相关蛋白的mRNA表达

图6 CXCL1敲低的ERS条件培养基刺激人巨噬细胞THP-1后UPR相关蛋白的mRNA表达
3 讨论
肝癌是在慢性乙型肝炎肝硬化基础上发展而来的肿瘤,ERS贯穿肝癌发生发展的始终[7]。ERS在不同细胞之间的传递,一方面激活肿瘤微环境中的免疫细胞以及内皮细胞中多种信号通路;另一方面激活肿瘤相关巨噬细胞分泌多种炎症因子,影响肿瘤微环境,促进肿瘤相关巨噬细胞由M1型向M2型转化,从而参与肿瘤的发生发展[8-10]。为了探讨细胞间的相互作用,我们首先收集了ERS时的条件培养基,建立了ERS时细胞间传递的模型,用于后续研究。
趋化因子是炎症刺激下由肿瘤细胞和肿瘤基质细胞分泌的细胞因子,它们一方面通过募集其他免疫细胞促进肿瘤免疫,另一方面导致慢性炎症并促进肿瘤的增殖、侵袭、转移、血管形成并抑制细胞凋亡[11]。研究表明,CXCL1在包括肝癌在内的大部分肿瘤中高表达,这种高表达与肿瘤预后较差密切相关。虽然在肝癌中CXCL1可通过CXCR2-CXCL1轴[12]和CXCL/NF-κB正反馈[13]调控肝癌的发生发展,然而CXCL1在肝癌ERS中的作用研究较少。Lee等[14]通过Tg诱导HepG2细胞发生ERS时,CXCL1的表达增加,而肿瘤微环境中的免疫细胞下调,提示CXCL1可能在ERS中介导细胞间的相互作用。本研究建立的细胞间传递模型,显示在微环境中的ERS可通过CXCL1同时在肿瘤细胞间和肿瘤细胞与分化成熟的巨噬细胞间传递。
UPR是ERS发生后细胞为应对压力、维持内环境稳态做出的反应。UPR通过激活细胞膜上的IRE1、ATF6、PERK促进蛋白折叠,然而ATF6上调也可上调坏死因子CHOP蛋白的表达,促进肿瘤坏死[15]。在多数肿瘤中,UPR通路呈一条或多条激活状态,UPR中不同通路的激活对肿瘤患者预后受益作用往往不同[16]。Kim等[17]研究肺癌时发现,GRP78和CHOP通路激活,患者总体生存降低;而Hetz等[18]通过基因组UPR靶基因指数系统研究雌激素受体α(ERα)阳性乳腺癌患者,发现UPR的3条通路均激活,且激活的UPR通路与患者不良预后密切相关。在本研究中,用条件培养基培养HepG2和分化成熟的THP-1细胞时,UPR的3条通路表达均增加,且同Hetz等研究乳腺癌时UPR的3条通路均被激活导致患者不良预后类似。前期研究表明CXCL1的增加与肝癌的不良预后密切相关,而当下调HepG2细胞中的CXCL1表达后,UPR通路中的PERK、IRE、ATF6均较对照组降低,表明ERS可通过CXCL1在细胞间传递,介导肝癌的发生发展。然而我们还注意到,THP-1细胞中的UPR蛋白与HepG2细胞中的UPR蛋白在CXCL1变化时二者的变化趋势一致。通常来说包括CXCL1在内的趋化因子表达升高可促进巨噬细胞对肿瘤细胞的吞噬作用,本研究中,CXCL1增加时,ERS相关蛋白mRNA水平也增加,这种增加是否有助于促进具有吞噬作用的M1型巨噬细胞向促进肿瘤生长的M2型巨噬细胞转化,有待更多研究[8]。
本研究表明,肝癌肿瘤微环境中细胞间ERS可通过CXCL1进行传递,这种细胞间传递作用可引起UPR相关蛋白的表达变化,进而影响肝癌的发生发展。
[1] Serafini P,Borrello I,Bronte V.Myeloid suppressor cells in cancer:recruitment,phenotype,properties, and mechanismsofimmunesuppression[J].Seminars Cancer Biol,2006,16(1):53-65.
[2] Grivennikov S I,Greten F R,Karin M.Immunity,in⁃flammation,and cancer[J].Cell,2010,140(6):883-899.
[3] Feldman D E,Chauhan V,Koong A C.The unfolded protein response:a novel component of the hypoxic stress response in tumors[J].Mol Cancer Res,2005,3 (11):597-605.
[4] Ron D,Walter P.Signal integration in the endoplas⁃mic reticulum unfolded protein response[J].Nat Rev Mol Cell Biol,2007,8(7):519-529.
[5] Ma Y,Brewer J W,Diehl J A,et al.Two distinct stresssignaling pathwaysconverge upon the CHOP promoter during the mammalian unfolded protein re⁃sponse[J].J Mol Biol,2002,318(5):1351-1365.
[6] Mahadevan N R,Rodvold J,SepulvedaH,etal. Transmission of endoplasmic reticulum stress and proinflammation from tumor cells to myeloid cells[J]. Proc Natl Acad Sci USA,2011,108(16):6561-6566.
[7] Sunami Y,Ringelhan M,Kokai E,et al.Canonical NF-kappaB signaling in hepatocytes acts as a tumorsuppressor in hepatitis B virus surface antigen-driven hepatocellularcarcinoma by controlling the unfolded protein response[J].Hepatology,2016,63(5):1592-1607.
[8] Oh J,Riek A E,Weng S,et al.Endoplasmic reticu⁃lum stress controls M2 macrophage differentiation and foam cellformation[J].J BiolChem,2012,287(15): 11629-11641.
[9] Bi M,Naczki C,Koritzinsky M,et al.ER stress-regu⁃lated translation increases tolerance to extreme hypox⁃ia and promotes tumor growth[J].EMBO J,2005,24 (19):3470-3481.
[10]Mahadevan N R,Zanetti M.Tumor stress inside out: cell-extrinsic effects of the unfolded protein response in tumor cells modulate the immunological landscape of the tumor microenvironment[J].J Immunol,2011,187 (9):4403-4409.
[11]Boissiere-Michot F,Lazennec G,Frugier H,et al. Characterization ofan adaptiveimmune responsein microsatellite-instable colorectal cancer[J].Oncoimmu⁃nology,2014,3:e29256.
[12]Li L,Xu L,Yan J,et al.CXCR2-CXCL1 axis is cor⁃related with neutrophil infiltration and predicts a poor prognosis in hepatocellular carcinoma[J].J Exp Clin Cancer Res,2015,34:129.
[13]Cao Z,Fu B,Deng B,et al.Overexpression of Chemo⁃kine(C-X-C)ligand 1(CXCL1)associated with tumor progression and poor prognosis in hepatocellular carci⁃noma[J].Cancer Cell Int,2014,14(1):86.
[14]Lee B R,Chang S Y,Hong E H,et al.Elevated en⁃doplasmic reticulum stress reinforced immunosuppres⁃sion in the tumor microenvironment via myeloid-de⁃ rived suppressor cells[J].Oncotarget,2014,5(23):12331-12345.
[15]Maurel M,McGrath E P,Mnich K,et al.Controlling the unfolded protein response-mediated life and death decisions in cancer[J].Seminars Cancer Bio,2015,33: 57-66.
[16]Galmiche A,Sauzay C,Chevet E,et al.Role of the unfolded protein response in tumor cell characteristics and cancer outcome[J].Curr Opin Oncol,2017,29(1): 41-47.
[17]Kim K M,Yu T K,Chu H H,et al.Expression of ER stress and autophagy-related molecules in human non-small cell lung cancer and premalignant lesions[J]. Int J Cancer,2012,131(4):E362-E370.
[18]Hetz C,Chevet E,Oakes S A.Proteostasis control by the unfolded protein response[J].Nat Cell Biol,2015, 17(7):829-838.

