利拉鲁肽治疗背景期糖尿病视网膜病变的疗效及对血管内皮生长因子和胰岛素样生长因子-1水平的影响
高丽华,刘旭阳,张红博,朱亚军
(1. 解放军第252医院,河北 保定 071000;2. 河北省人民医院,河北 石家庄 050000)
随着人民生活水平的提高,我国糖尿病患者日渐增多,而糖尿病视网膜病变(DR)是糖尿病最常见的微血管并发症,其发病机制十分复杂。近年来随着分子生物学的发展,许多研究发现血管内皮细胞生长因子(VEGF)和胰岛素样生长因子(IGF-1)在DR的发生发展中发挥重要作用[1],利拉鲁肽是胰升血糖素样肽-1(GLP-1)类似物,具有葡萄糖依赖性的胰岛素促分泌作用,同时也能够抑制胰高血糖素的分泌,近年来被广泛用于2型糖尿病(T2DM)患者的降糖治疗[2]。动物实验表明,GLP-1受体(GLP-1R)的激活可能很好地维持和保护DR的功能[3]。本研究将探讨GLP-1R激动剂利拉鲁肽治疗背景期糖尿病视网膜病变(BDR)的疗效,并且观察利拉鲁肽对此期患者血清VEGF及IGF-1浓度的影响,现报道如下。
1 临床资料
1.1一般资料选择2015年6月—2016年5月解放军第252医院收治的BDR患者80例,其中糖尿病诊断标准参照1999年WHO中的糖尿病标准;DR诊断符合2014年中国糖尿病视网膜病变临床诊疗指南。DR分期标准采用第三届全国眼科学术会议制定的分期标准。排除增殖期糖尿病视网膜病变者、白内障以及其他非糖尿病性视网膜病变者(如视网膜脱离、青光眼、葡萄膜炎、视神经疾病等);急性感染性疾病以及心力衰竭、严重肝肾功能不全者;已行手术治疗者,妊娠或哺乳期妇女,有药物过敏史者,近1个月内参加其他药物临床试验者。将患者随机分为2组:观察组40例,男22例,女18例;年龄43~70(55.4±2.3)岁;病程10~62(38.8±1.2)个月。对照组40例,男21例,女19例;年龄42~70(54.3±1.3)岁;病程12~60(40.2±1.4)个月。2组一般资料比较差异均无统计学意义(P均>0.05),具有可比性。研究获解放军第252医院科学与伦理委员会批准,所有治疗均获得患者或亲属知情同意,签署知情同意书。
1.2治疗方法对照组给予口服降糖药物联合胰岛素皮下注射的方案进行降糖治疗,根据血糖水平调节口服药物及胰岛素的剂量,所用口服降糖药物包括二甲双胍、阿卡波糖,所用胰岛素制剂包括甘精胰岛素注射液、赖脯胰岛素注射液、门冬胰岛素注射液。观察组在常规降糖方案治疗的基础上加用利拉鲁肽,起始剂量0.6 mg/次,1次/d,皮下注射,1周后加量至1.2 mg/次,1次/d,皮下注射,连续治疗24周后评估疗效。
1.3临床指标检测方法采用放射免疫法测定空腹血糖(FPG)、餐后2 h血糖(2hPG)、空腹血胰岛素(FINS)的含量,根据稳态模型计算胰岛素抵抗指数(HOMA-IR);采用酶联免疫吸附试剂盒测定VEGF、IGF-1水平变化。
1.4疗效评定标准参考2014年我国DR临床诊疗指南[4]。显效:微血管瘤及眼底水肿、出血、渗出中≥2项症状明显减轻或消失,视力提高3行以上,眼底荧光血管造影检查显示血管渗漏显著减少或消失。有效:微血管瘤及眼底水肿、出血、渗出中≥1项症状明显减轻或消失,视力提高1行以上, 眼底荧光血管造影检查显示黄斑水肿、血管壁渗漏减轻或消失。无效:上述指标无明显变化甚至出现恶化。总有效率=显效率+有效率。
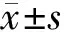
2 结 果
2.12组血糖代谢指标比较2组治疗后FPG、2hPG以及HOMA-IR较治疗前均下降(P均<0.05),观察组血清FPG、2hPG以及HOMA-IR均显著低于对照组(P均<0.05)。见表1。

表1 2组治疗前后代谢指标比较
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
2.22组血清VEGF、IGF-1指标比较2组治疗后血清VEGF、IGF-1水平均较治疗前下降(P均<0.05),且观察组改善情况明显优于对照组(P均<0.05)。见表2。

表2 2组血清VEGF和IGF-1的比较
注:①与治疗前比较,P<0.05;②与对照组比较,P<0.05。
2.32组临床疗效比较治疗后,观察组总有效率显著高于对照组(P<0.05)。见表3。
2.42组不良反应发生情况比较观察组在治疗期间偶有一过性胃肠道不良反应,包括恶心和腹泻,无其他不良反应。对照组出现一过性轻微低血糖反应2例,低血糖反应发作时血糖值为2.9~3.6mmol/L,表现为头晕、心悸、出汗,少量饮食或休息后缓解。

表3 2组临床疗效比较 例(%)
注:①与对照组比较,2=6.885,P<0.05。
3 讨 论
BDR的眼底表现主要是视网膜内屏障遭到破坏,毛细血管闭塞,闭塞区附近产生微血管瘤、视网膜静脉充盈扩张、小片状出血,深层或浅层出血、渗出、棉絮斑,后级部视网膜水肿,进一步发展,视网膜和视乳头上出现广泛的新生血管,并有结缔组织增殖,视网膜反复出血,棉絮状渗出增多,严重损害视力。DR发病与糖尿病病程关系密切[5]。对于BDR患者,临床上主要以控制血糖治疗为主。通过控制患者的血糖水平来预防并发症的发生,并改善机体的高糖环境,消除对血管造成的损伤。但部分患者存在血糖控制不佳或血糖波动等,使得视网膜病变呈进行性发展,因此及早治疗可降低患者的视力损害,提高患者的生活质量。由于其发病机制的复杂性,目前还缺乏有效的防治措施。
GLP-1是肠道L细胞分泌的一种肠促胰素,与胰腺β细胞上GLP-1R特异性结合后,促进胞内胰岛素合成分泌,实现葡萄糖依赖性的血糖调节。研究发现不仅在胰腺β细胞上,而且在神经系统、眼、肾等组织中都有GLP-1R的表达,提示GLP-1可能对糖尿病微血管并发症(如周围神经病变、视网膜病和肾病)有潜在的治疗意义[6-7]。利拉鲁肽是一类新型降糖药物,属于GLP-1R激动剂,能够以葡萄糖浓度依赖性的方式促进胰岛素的释放、抑制胰高血糖素的释放,在有效降低血糖的同时不会加重胰岛素抵抗[8]。本研究发现,在利拉鲁肽作用下,T2DM合并早期DR患者的FPG、2hPG以及HOMA-IR水平显著降低,无低血糖发生,说明应用利拉鲁肽不仅可以良好地控制血糖,增加胰岛素敏感性,而且能够减少血糖的波动性。
动物研究显示,exendin-4可以防止糖尿病大鼠视网膜细胞的损失和维持正常视网膜的厚度[9]。但是,目前关于利拉鲁肽治疗糖尿病视网膜病变的疗效尚未见明确报道。有个案报道应用艾塞那肽注射液有效控制糖代谢的同时,可以逆转DR[10]。与上述研究相似,本研究发现观察组总有效率显著高于对照组,说明利拉鲁肽能够改善早期DR患者的临床症状,提高视力水平。
DR是糖尿病微血管损害的表现,微血管形成是糖尿病视网膜病变发病的中心环节[11]。DR病变时视网膜缺氧缺血,释放出来血管源性因子导致视网膜新生血管生成。VEGF是与血管增殖有关、调控血管生成中重要细胞因子。在正常状态下,VEGF在眼部组织中呈低表达状态。当视网膜缺氧缺血时,视网膜组织中VEGF水平明显升高[12]。VEGF可以增加毛细血管通透性、刺激内皮细胞增生,加速细胞外基质沉积,促进毛细血管生长。IGF-1高表达时可以增加细胞合成 DNA的能力,同时易于趋化单核细胞侵入到眼内和视网膜上,局部IGF-1分泌过量后引起新生血管形成、内皮细胞的广泛增殖和纤维组织的增生[13-14]。T2DM患者血清中 VEGF 及 IGF-1 水平随着 DR 的发生、黄斑水肿以及 DR 的加重而逐渐升高,因此减少VEGF 和IGF-1的表达可以减少新生血管的形成,缓解视网膜病变病情。本研究发现,在GLP-1R激动剂作用下,BDR患者的VEGF 和IGF-1水平显著降低,表明利拉鲁肽可能通过降低血清VEGF 和IGF-1水平来发挥其对于视网膜微血管抑制作用。此外GLP-1可通过减少人视网膜上皮色素细胞(HRPE)上晚期糖基化产物(AGEs)受体及血液循环中黏附因子(ICAM-1和VCAM-1)的表达发挥对视网膜的保护作用[15]。Fu等[16]发现exendin-4可通过影响促凋亡蛋白Bax和抗凋亡蛋白Bcl-2的表达来实现视网膜神经节细胞的保护作用。
综上所述,利拉鲁肽能够有效控制血糖,增加胰岛素敏感性,明显改善临床症状,提高视力水平,降低血清VEGF 和IGF-1水平,延缓DR的进程,无严重的不良反应发生。由于入选本研究的患者例数较少,观察时间短,其对于视网膜微血管抑制作用机制尚待进一步研究深入,可能为其在DR治疗中的应用提供新的思路。
[参考文献]
[1]Leon Fernandez OS,Pantoja M,Diaz Soto MT,et al. Ozone oxidative post-conditioning reduces oxidative protein damage in patients with disc hernia[J]. Neurol Res,2012,34(1):59-67
[2]Gough SC,Jain R,Woo VC. Insulin degludec/liraglutide (IDeg-Lira) for the treatment of type 2 diabetes[J]. Expert Rev Endocrinol Metab,2016,11(1):7-19
[3]金兴倩,李强. 胰高血糖素样肽1与糖尿病微血管病变[J]. 中华糖尿病杂志,2015,7(11):712-714
[4]中华医学会眼科学会眼底病学组. 我国糖尿病视网膜病变临床诊疗指南(2014年)[J]. 中华眼科杂志,2014,50(11):851-865
[5]胡利,李东豪,陈慧. 糖尿病患者血糖控制相关因素与糖尿病视网膜病变发生的关系[J]. 中华眼底病杂志,2011,27(3):210-213
[6]Chilton R,Wyatt J,Nandish S,et al. Cardiovascular comorbidities of type 2 diabetes mellitus:defining the potential of glucagonlike peptide-1-based therapies[J]. Am J Med,2011,124,(Suppl): S35-53
[7]Anagnostis P,Athyros VG,Adamidou F,et al. Glucagon-like peptide-1-based therapies and cardiovascular disease: looking beyond glycaemic control[J]. Diabetes Obes Metab,2011,13(4):302-312
[8]Vanderheiden A,Harrison LB,Warshauer JT,et al. Mechanisms of action of liraglutide in patients with type 2 diabetes treated with high-dose insulin[J]. J Clin Endocrinol Metab,2016,101(4):1798-1806
[9]Zhang Y,Wang Q,Zhang J,et al. Protection of exendin-4 analogue in early experimental diabetic retinopathy[J]. Graefes Arch Clin Exp Ophthalmol,2009,247(5):699-706
[10] 徐静,宋晓燕. 艾塞那肽注射液有效控制代谢同时逆转糖尿病视网膜病变1例报告[J]. 中国实用内科杂志,2012,32(S2):58-59
[11] Soliman AZ,Silva PS,Aiello LP,et al. Ultra-wide field retinal imaging in detection, classification, and management of diabetic retinopathy[J]. Semin Ophthalmol,2012,27(5/6):226-232
[12] Wakabayashi Y,Usui Y,Okunuki Y,et al. Intraocular VEGF level as a risk factor for postoperative complications after vitrectomy for proliferative diabetic retinopathy[J]. Invest Ophthalmol Vis Sci,2012,53(10):6403-6410
[13] 刘波,林海,史纪文. 细胞因子VEGF、IGF-1与2型糖尿病视网膜病变的相关性研究[J]. 中国实验诊断学,2012,16(7):1206-1208
[14] Sengupta N,Afzal A,Caballero S,et al. Paracrine modulation of CXCR4 by IGF-1 and VEGF: implications for choroidal neovascularization[J]. Invest Ophthalmol Vis Sci,2010,51(5):2697-2704
[15] Dorecka M,Siemianowicz K,Franeuz T,et al. Exendin-4 and GLP-1 decreases induced expression of ICAM-1, VCAM-l and RAGE in human retinal pigment epithelial cells[J]. Pharmacol Rep,2013,65(4):884-890
[16] Fu Z,Kuang HY,Hao M,et al. Protection of exenatide for retinal ganglion cells with different glucose concentrations[J]. Peptides,2012,37(1):25-31

