小鼠骨髓源性树突细胞和脾源性树突细胞的形态及生物学性能对比
张兰兰,闫军堂,刘 敏,胡京红,于 雪,范盎然,纪雯婷,任 虹,孙震宇
(北京中医药大学中医学院,北京 100029)
树突状细胞(DCs)是机体最重要的抗原提呈细胞,也是唯一能激活初始T细胞的抗原提呈细胞,是机体免疫的始动者,在免疫抑制和免疫耐受等方面发挥着重要作用。近年来人们已经能在体外应用MCM培养基诱导生成高纯度的DCs并已应用于肿瘤和过敏性疾病的治疗[1],目前基于DCs的免疫治疗也被认为是最具前景的治疗方式[2]。一般来说DCs在体内分布较广,外周血、脾脏、脐带血、骨髓、皮肤等均有分布[3],但大都含量极少且获得困难,如何获取纯度和性能较好的DCs用于更深入的DCs研究已经成为当前实验研究的重点[4]。近年来学者们对DCs体外培养进行了大量积极的探索,小则从培养手法、因子浓度等入手,大则结合现代生物技术如磁珠分选、流式分选等对其进行研究,DCs培养技术已日渐趋于成熟。相比于其他来源的DCs,骨髓来源的DCs因其培养方法简单、来源方便、含量较高等特点,成为应用较多的DCs研究来源,但1只小鼠的骨髓前体细胞经常规诱导后仅可生成(1~2)×107个DCs细胞,经分选后仅可获得前者数量的1/10[5],远远不能满足当前实验对DCs的大量需求,故有必要对DCs进行更深入的探索。一直以来,脾源性DCs因其培养周期长、产量低等特点而较少应用于实验研究[6],其确切的纯度、产量和性能目前尚不明确,基于目前DCs缺乏的现状,本课题组对脾源性DCs展开了研究。本研究通过在体外获得骨髓前体细胞和脾细胞,用GM-CSF和IL-4诱导生成DCs,结合流式细胞术(FCM)和酶联免疫吸附测定(ELISA)技术从两者的形态、细胞表面特异性分子表达、相关因子分泌等方面进行对比,以期明确脾源性DCs的性状和性能,为后期的实验研究筛选合适的细胞。
1 实验资料
1.1材料
1.1.1实验动物C57BL/6雌性小鼠,SPF级5周龄,购于北京维通利华实验动物技术有限公司,合格证号为SCXK(京)2012-0001。实验小鼠均饲养在清洁级环境中统一喂养,取材时遵守人道主义原则,确保小鼠安乐死。
1.1.2主要试剂重组GM-CSF购于R&D(批号:404-ML-010),重组IL-4因子购于R&D(批号:404-ML-010),RPMI-1640购自美国Hy-clone公司(批号:11330032),红细胞裂解液购于康为世纪,澳洲来源胎牛血清(FBS,批号:10099141),双抗(批号:15140122),PE标记的抗小鼠CD83单克隆抗体(货号:558205)及其同型对照(货号:554685)、APC标记的抗小鼠CD11c单克隆抗体(货号:554686)及其同型对照(货号:557400)均购于BD公司,LPS购于Sigma公司,IL-12 ELISA试剂盒(批号: LOT20170321002)购于武汉六合生物有限公司。
1.1.3主要仪器INCO2/108型CO2培养箱,Leica-DM2500 型显微图像系统,ePPendorf离心机(型号:5810),Tecan酶标仪(型号:Safire2),BD流式细胞仪。
1.2方法
1.2.1小鼠骨髓源性DCs的分离与培养处理C57BL/6小鼠脱颈椎处死,无菌条件下分离股骨与胫骨,用无菌纱布将组织剔除干净后用注射器将骨髓冲至培养皿中,收集到离心管中经离心后加入预温37 ℃的红细胞裂解液5 mL,静置5 min后加RPMI-1640 5 mL终止裂解,离心2次后计数,用完全培养基(含10 ng/mL 重组IL-4、20 ng/mL 重组GM-CSF、10%灭活的FBS及1%双抗)调整细胞浓度至1×106mL-1,将细胞种于6孔板,每孔2 mL于37 ℃、 5% CO2温箱中培养,3 h后弃去上清,加入相同因子浓度的完全培养基继续培养,48 h和96 h分别进行半换液处理,第8天部分细胞添加10 μg/mL LPS刺激DCs成熟。
1.2.2小鼠脾源性DCs的分离与培养处理C57BL/6小鼠脱颈椎处死,无菌条件下迅速取脾,研磨于1640培养基中,收集至离心管中经离心后加入预温37 ℃的红细胞裂解液5 mL,静置5 min后加RPMI-1640 5 mL终止裂解,离心2次后计数,用完全培养基(含10 ng/mL 重组IL-4、20 ng/mL 重组GM-CSF、10%灭活的FBS及1%双抗)调整细胞浓度至1×108mL-1,将细胞种于6孔板,每孔2 mL于37 ℃、 5% CO2温箱中培养,3 h后弃去上清,加入相同因子浓度的完全培养基继续培养,48 h和96 h分别进行半换液处理,第8天部分细胞添加10 μg/mL LPS刺激DCs成熟。
1.2.3倒置显微镜下细胞形态观察取培养第5,7,8天骨髓源性DCs和脾源性DCs于倒置显微镜下观察。
1.2.4扫面电镜下细胞形态观察收集培养第8天骨髓源性DCs和脾源性DCs,用3%戊二醛固定,用70%,90%,100%的乙醇进行梯度洗脱,乙酸异戊脂置换后,CO2临界点干燥,扫描电镜观察细胞表面结构。
1.2.5FCM检测收集培养第9天细胞,离心后用PBS重悬计数,取100 μL细胞量约为106的细胞于流式管中,分别加入APC标记的CD11c(小鼠DCs特异性表面标记物)抗体及同型对照抗体,PE-CD83及同型对照,室温避光孵育20 min,离心后流式细胞仪检测CD11c+及CD11c+CD83+的比例。
1.2.6ELISA检测收集细胞上清,按照试剂盒说明书检测IL-12含量。
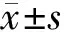
2 结 果
2.1倒置显微镜下DCs形态培养第5天时,骨髓源性DCs和脾源性DCs均有明显的毛刺状突起,悬浮于培养基中,不同的是脾源性DCs开始出现轻微聚集状态,而骨髓源性DCs大多呈散在状态,且底壁有明显的枝状巨噬细胞,见图1和图2。培养第7天时,骨髓源性DCs呈聚集状态,散在细胞较少,毛刺较之前变大,DCs缠绕在一起,见图3;脾源性DCs如葡萄状悬浮于培养基中,其集落大于骨髓源性DCs的集落,见图4。培养第8天时,骨髓源性DCs聚集状态变大,呈葡萄状悬浮于培养基中,细胞周边可见明显的毛刺状突起,见图5;脾源性DCs成簇状悬浮于培养基中,其集落较之前明显变大,而且明显大于骨髓源性DCs的集落,见图6。

图1 培养第5天时骨髓源性DCs形态(×200)

图2 培养第5天时脾源性DCs形态(×200)

图3培养第7天时骨髓源性DCs形态(×200)

图4 培养第7天时脾源性DCs形态(×200)
2.2扫描电镜下DCs形态培养第8天,骨髓源性DCs表面呈云雾状,周边可见明显的毛刺状突起,两个细胞紧紧聚集在一起,见图7;脾源性DCs表面呈薄纱状,周边可见丝状不定向突起或薄纱状圆球形突起,5个细胞紧紧缠绕在一起,其集落明显大于骨髓源性DCs集落,见图8。

图5 培养第8天时骨髓源性DCs形态(×200)

图6 培养第8天时脾源性DCs形态(×200)

图7 培养第8天时扫面电镜下骨髓源性DCs形态(×10 000)

图8 培养第8天时扫面电镜下脾源性DCs形态(×10 000)
2.3DCs纯度收集培养第8天的DCs流式鉴定其纯度,先圈出目标细胞,通过同型对照可得骨髓源性DCs纯度为(81.567±2.902)%,脾源性DCs 纯度为(87.227±4.463)%,脾源性DCs纯度高于骨髓源性DCs(t=1.841,P<0.05)。
2.4LPS刺激前后骨髓源性DCs和脾源性DCs CD11c+CD83+表达情况LPS刺激前,骨髓源性DCs CD11c+CD83+表达比例明显高于脾源性DCs CD11c+CD83+表达比例(P<0.05);LPS刺激后,骨髓源性DCs和脾源性DCs CD11c+CD83+表达比例均明显高于刺激前(P均<0.05),脾源性DCs CD11c+CD83+表达比例与骨髓源性DCs比较差异无统计学意义(P>0.05)。见表1及图9、图10。

表1 LPS刺激前后骨髓源性和脾源性DCs CD11c+CD83+表达情况
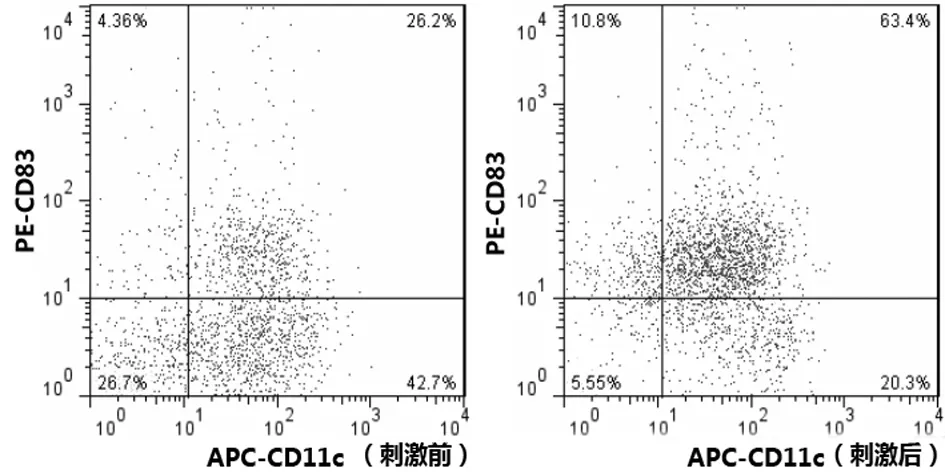
图9 骨髓源性DCs LPS刺激前后CD11c+CD83+表达情况

图10 脾源性DCs LPS刺激前后CD11c+CD83+表达情况
2.5LPS刺激前后骨髓源性DCs和脾源性DCs分泌IL-12情况LPS刺激前,骨髓源性DCs和脾源性DCs分泌IL-12量比较差异无统计学意义(P>0.05);LPS刺激后,骨髓源性DCs和脾源性DCs分泌IL-12量均明显高于刺激前(P均<0.05),脾源性DCs分泌IL-12量与骨髓源性DCs分泌量比较差异无统计学意义(P>0.05)。见表2。
3 讨 论
DCs是Steinman和Cohn于1973年发现的一群外形奇特、具有强大的活化初始T细胞能力的细胞,它是免疫反应的启动者,具有很强的迁移能力。它起源于机体内的多功能造血干细胞,分为DCs前体细胞、未成熟DCs、成熟DCs 3个成长阶段,一般来说未成熟DCs可以通过其TLR直接感知病原体组分(如LPS)而诱导成熟,表现为膜表面共刺激分子上调[7],分泌因子与趋化因子增加[8],抗原提呈能力增强[9],通过JAK/STAT通路使Th1、Th2细胞极化等[10]。研究发现LPS可通过提高iDC表面CD83、CD86的表达,分泌因子能力和刺激T细胞增殖能力的增强等来诱导iDCs的成熟[11],成熟后的DCs可以更有效地发挥免疫调节作用[12],但目前DCs尚无特定的表面分子标志及明确的生物学性能,需要结合细胞形态、生物学性能和表面特异性分子3个方面对DCs进行鉴别。
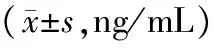
表2 LPS刺激前后骨髓源性和脾源性DCs分泌IL-12情况
人们已经能在体外用多种因子如GM-CSF、IL-4、IFN-α、Flt3配体、IL-10、IL-6、TPO和IL-13等诱导出纯度较高及性能较好的DCs[13],但DCs的产量仍不能满足当前DCs的实验需要。面对目前DCs短缺的问题,本课题组对脾源性DCs展开了探索。结果显示,经LPS诱导DCs成熟后,骨髓和脾脏均可获得有明显DCs生物学特性的细胞,纯度均为80%以上,且脾源性DCs纯度较高,形成的细胞集落也较大。FCM结果显示LPS刺激前骨髓源性DCs的CD11c+CD83+表达比例明显高于脾源性DCs 的CD11c+CD83+表达比例,CD83是DCs的表面特异性分子,一般来说低表达于未成熟DCs表面,高表达于成熟DCs表面,LPS是革兰阴性菌的组成部分,它可以与DCs表面的TLR4结合并通过MyD88依赖性途径或MyD88非依赖性途径活化NF-κB分子,继而介导诱导DCs的成熟[14],结果说明骨髓源性DCs早于后者成熟,与文献[15]结果一致;LPS刺激后,骨髓源性DCs和脾源性DCs CD11c+CD83+的表达均增加,且脾源性DCs 的CD11c+CD83+表达比例与骨髓源性DCs比较差异无统计学意义,提示两者经LPS刺激后CD11c+CD83+表达情况相似。ELISA结果显示,骨髓源性DCs和脾源性DCs IL-12分泌量比较差异无统计学意义,提示两者分泌IL-12的性能相似;经LPS刺激后,两者分泌IL-12量均明显升高,可能是经LPS诱导后DCs的转录因子IRF-3和NF-κB被激活[16],继而分泌更多的IL-12来更好地发挥免疫调节作用,且脾源性DCs 分泌IL-12量与骨髓源性DCs比较差异无统计学意义,两者DCs生物学特性相似。
实验过程中发现尚有很多问题有待解决:①在脾源性DCs培养3~5 d时镜下可见大量的暗色溶出物,笔者推测这部分溶出物可能是在因子选择下大量的非DCs前体细胞裂解死亡,但未进行深入研究。②关于骨髓前体细胞和脾细胞的种板密度仍需要探讨,笔者发现骨髓源性DCs生长后期密度过大,脾源性DCs生长后期密度过小。③由于时间原因,实验中笔者未对所培养细胞进行MLR(刺激T淋巴细胞增殖实验)和抗原吞噬能力检测,关于其特性尚需进一步研究。④脾源性DCs产量仅为骨髓源性DCs的1/7左右,但其纯度稍大于骨髓源性DCs,应当在脾源性DCs产量问题上进行深入研究,或许可以采取将脾源性DCs进行体外扩增再继续诱导培养的方法,但尚不能明确是否可行。
[参考文献]
[1]赵园园,张淑敏. 树突状细胞体外培养各阶段作用因子研究进展[J]. 天津医药,2017,35(12):956-958
[2]刘俊峰,何志旭,沈冬,等. 小鼠骨髓树突状细胞体外扩增与培养[J]. 中华肿瘤防治杂志,2009,16(4):256-258
[3]王宏伟,陆江阳,覃家剑,等. 小鼠骨髓源性树突状细胞的体外诱导培养及功能分析[J]. 感染、炎症、修复,2014,15(4):199-203
[4]翁霞,邓晓辉,马静秋,等. 不同来源树突状细胞的培养研究[J]. 上海第二医科大学学报,2004,24(5):331-333
[5]Ardavin C. Origin precursors and differentiation of mouse dendritic cells[J]. Nat Rev Immunol,2003,3(7):582-590
[6]Barillé-Nion S,Barlogie B,Bataille R,et al. Advances in biology and therapy of multiple myeloma[M]. Hematology Am Soc Hematol Educ Program,2003:248-278
[7]Parlato S,De Ninno A,Molfetta R,et al. 3D Microfluidic model for evaluating immunotherapy efficacy by tracking dendritic cell behaviour toward tumor cells[J]. Sci Rep,2017,7(1):1093
[8]Lyons-Cohen MR,Thomas SY,Cook DN,et al. Precision-cut Mouse Lung Slices to Visualize Live Pulmonary Dendritic Cells[J]. J Vis Exp,2017(122):55465
[9]龚非力,沈关心. 医学免疫学[M]. 3版. 北京:科学出版社,2009:110-111
[10]ZhaoHM,XuR,HuangXY,etal.CurcuminsuppressedactivationofdendriticcellsviaJAK/STAT/SOCSsignalinmicewithexperimentalcolitis[J].FrontPharmacol,2016,7(455):1-9
[11] Maus RLG,Jakub JW,Nevala WK,et al. Human melanoma-derived extracellular vesicles regulate dendritic cell maturation[J]. Front Immunol,2017,8:358
[12] 王全楚, 冯志华, 周永兴,等. 小鼠骨髓树突状细胞改良培养及体外生物学特性的比较[J]. 世界华人消化杂志,2003,11(2):219-223
[13] 顾春瑜,王前,郑磊,等. 小鼠骨髓耐受性树突状细胞的体外培养与鉴定[J]. 第一军医大学学报,2005,25(8):959-962
[14] 杨洪艳,张义国,董子明,等. 小鼠骨髓和脾来源树突状细胞的分离与扩增培养[J]. 河南医科大学学报,1999,34(1):19-22
[15] 李宗辉,黄军华,刘俊峰,等. 小鼠脾脏来源树突状细胞的体外扩增培养[J]. 疑难病杂志,2009,8(9):520-521
[16] Hirsch I,Janovec V,Stranska R,et al. Cross talk between inhibitory immunereceptor tyrosine-based activation motif-signaling and toll-like receptor pathways in macrophages and dendritic cells[J]. Front Immunol, 2017,8(10):394

