清肺益气方对肺癌干细胞样细胞增殖的抑制作用及其机制研究
陈 鑫
(河北省廊坊市人民医院,河北 廊坊 065000)
近年来,肺癌的发病率和病死率呈不断增高趋势,且趋向年轻化。研究表明,肿瘤干细胞或肿瘤起始细胞(CICs)存在于多种类型的肿瘤组织中,具备表达胚胎干细胞的部分生物学标志物,并具有强大的增殖和侵袭能力,可使化疗药物发生耐药[1]。由于肺癌细胞中的CICs可高表达CD44+和CD133+蛋白[2],同时具备较强的化疗药物耐受性。因此,寻找有效抑制肺癌CICs增殖的药物成为肺癌研究的热点。清肺益气方是我院的协定处方,临床应用于肺癌患者的治疗中,可显著提高肺癌患者的生存率和生活质量,但其作用机制尚不明确。本研究以肺癌CICs作为研究模型,探讨清肺益气方对肺癌干细胞样细胞增殖的抑制作用及其可能的作用机制,旨在为清肺益气方的临床治疗提供理论依据。
1 实验资料
1.1细胞及主要试剂人肺癌细胞株A549从中国科学院细胞库选购。清肺益气方免煎颗粒剂主要由人参、黄芪、黄芩(酒炒)、百合、北梗(炒)、贝母、薏苡仁、升麻、甘草等单味中药免煎颗粒组成,从深圳三九医药股份有限公司选购。四甲基偶氮唑蓝(MTT)、二甲基亚砜(DMSO)、核糖核酸酶A(RNase A)均从美国Sigma公司选购。DMEM细胞培养基、胎牛血清(FBS)均从美国Sigma公司选购。兔抗人CD44-异硫氰酸荧光素(FITC)抗体、兔抗人CD133-藻红蛋白(PE)抗体、兔抗人p53抗体、兔抗人Caspase-3抗体及兔抗人GAPDH抗体均从美国Sigma公司选购。
1.2实验动物SPF级健康雄性日本大耳白兔6只,购自河北医科大学实验动物中心,体质量1.7~2.5 kg。所有动物在清洁、采光通风良好的动物房中,适应性喂养2 d,自由饮食水,温度保持在20~26 ℃,环境湿度保持在(56±2)%。
1.3方法
1.3.1含药血清的制备将6只大耳白兔随机分为清肺益气方高剂量组及空白对照组,每组3只。每组早晚灌胃给药1 次,给药体积为 10 mL/kg,清肺益气方高剂量相当于成人临床生物等效剂量的10倍;空白对照组给予等体积生理盐水。连续用药3 d后,于末次给药后2 h处死白兔,进行心脏取血,1 500 r/min 离心10 min后留取血清,56 ℃30 min灭活后,0.22 μm微孔滤膜过滤除菌,-20 ℃保存备用。进行指标检测时,将含药血清溶于无血清的RPMI-1640 培养液中进行稀释,确定终浓度后进行后续实验。
1.3.2肺癌CICs筛选及培养采用含有10%的FBS、100 IU/mL青霉素及100 IU/mL链霉素的DMEM培养基对A549细胞进行培养,在37 ℃,5%CO2孵箱中进行传代培养。当细胞处于稳定生长状态,即处于对数生长期时进行后续实验。采用0.25%胰蛋白酶-EDTA对A549细胞进行预处理,离心后留取细胞沉淀,分别吸取兔抗人CD44-FITC、CD133-PE抗体各2 μL,在4 ℃条件下与细胞沉淀进行孵育,30 min后PBS清洗并重悬细胞,并调整细胞浓度至2×107mL-1。取500 μL调整浓度的细胞悬液在流式细胞仪上对细胞进行分选,采用肺癌CICs表达CD44+/CD133+的细胞进行实验。
1.3.3肺癌细胞增殖情况检测采用MTT比色法检测。将处理后的细胞接种于密度为2×103/孔的96孔细胞培养板中,在37 ℃、5%CO2条件的孵箱中培养至细胞生长呈现指数期时,将浓度为0,5,10,20,40,60,80,100 μmol/mL的清肺益气方含药血清加入至培养板中,空白对照组给予1 mL的PBS作为对照,阴性对照组只加细胞和培养液而不做其他干预,均加入20 μL浓度为5 mg/L的MTT,继续培养4 h后,离心留取上清,DMSO处理后留取沉淀,采用酶标仪检测对应OD490值,每组设3个复孔,所得的OD取平均值作为最终结果,并参照文献方法,计算出清肺益气方对肺癌CICs的IC50浓度。计算细胞生长抑制率(%)=(1-观察组OD值/对照组OD值)×100%。
1.3.4细胞凋亡情况检测采用流式细胞术检测。选择对数生长期的细胞并将细胞密度调整至1×105mL-1,设置空白对照组、阴性对照组和清肺益气方组,空白对照组细胞使用1 mL的PBS;阴性对照组只加细胞和培养液;清肺益气方组给予1 mL IC50浓度的含药血清处理。于给药后培养24 h,1 000 r/min离心5 min,弃去上清留取沉淀,PBS清洗后,给予Annexin V-FITC 5 μL,4 ℃条件下进行避光染色,持续约5 min,加入PI 避光染,持续15 min后加入缓冲液,调整至500 μL进行过滤,取过滤后的细胞液进行上样,采用流式细胞仪检测细胞凋亡情况,计算凋亡率。每份标本共计数10 000个细胞以上,若为死细胞则显示红色荧光。
1.3.5肺癌增殖相关基因表达检测采用实时荧光定量PCR检测。采用Trizol法抽提1.3.4项中各组细胞的总RNA并通过逆转录得到cDNA,采用Primer Premier 5.0及Oligo6软件完成Caspase-3、p53及18S rRNA的引物设计,以cDNA为模板进行PCR扩增,每个样本均进行3次的重复实验,以18S rRNA为内参照。引物序列:Caspase-3上游5’- CTGCCTCTTCCCCCATTCT -3’,下游5’-CGCTTCCATGTATGATCTTTG-3’; p53上游5’- GCTTTCCACGACGGTGAC -3’, p53下游5’-GCTCGACGCTAGGATCTGAC-3’; 18S rRNA上游5’- CGTTGATTAAGTCCCTGCCCTT -3’, 18S rRNA下游5’- TCAAGTTCGACCGTCTTCTCAG -3’。反应条件设置为95 ℃ 预变性30 s,94 ℃ 5 s,60 ℃ 30 s,共进行40个循环。采用2-ΔΔCt法计算相关基因的相对表达量。
1.3.6肺癌增殖相关蛋白表达检测采用Western blot法检测。将处理后的1.3.4项各组细胞收集后抽提总蛋白,采用BCA法进行各组总蛋白浓度的测定,吸取20 μg总蛋白进行上样,经过预处理变性后,进行SDS-PAGE凝胶电泳后,然后半干电转化法将蛋白转移PVDF膜上,5%脱脂奶粉室温下封闭2 h,加入1∶1 000稀释后的一抗, 4 ℃孵育过夜,TBST液洗涤,加入HRP标记的1∶500稀释后的二抗,室温孵育2 h, TBST液洗涤后,ECL化学发光法进行显色,ChemiDocXRS进行曝光,显影,得到目的条带后,Image软件分析各目的条带的灰度值。
1.3.7VEGF和HIF-1α表达检测收集1.3.4项各组处理完成后细胞培养的上清液,采用ELISA法检测各组细胞VEGF和HIF-1α的表达水平。
1.3.8肺癌CICs体外侵袭能力检测各组Transwell小室侵袭实验法检测1.3.4项各组变化。
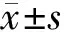
2 结 果
2.1肺癌CICs体外增殖情况不同浓度清肺益气方组细胞增殖抑制率均显著高于阴性对照组和空白对照组(P均<0.05),且随着含药血清浓度的增加其抑制肺癌细胞增殖的作用逐渐增强,即抑制作用呈浓度依赖性,见表1。根据公式计算得到清肺益气方的IC50为80.12 μmol/mL。以此浓度观察细胞的形态变化,可见随着给药时间的延长,肺癌细胞形态逐渐皱缩变形,坏死脱落。见图1~5。

表1 清肺益气方对肺癌CICs体外增殖的抑制作用
注:①与阴性对照组比较,P<0.05。

图1 空白对照组肺癌细胞形态

图2 阴性对照组肺癌细胞形态
2.2细胞凋亡情况空白对照组细胞凋亡率为(0.08±0.01)%,阴性对照组细胞凋亡率为(0.02±0.01)%,清肺益气方组为(17.22±0.55)%,清肺益气方组细胞凋亡率明显高于空白对照组和阴性对照组(P<0.05),空白对照组和阴性对照组细胞凋亡率比较差异无统计学意义(P>0.05)。流式细胞仪的散点图上可见,清肺益气方组给药后,体现活细胞的左下象限的活细胞数目逐渐减少,而体现早期和晚期凋亡细胞的右下象限及右上象限凋亡细胞数目增加。见图6。

图3 清肺益气方作用12 h肺癌细胞形态
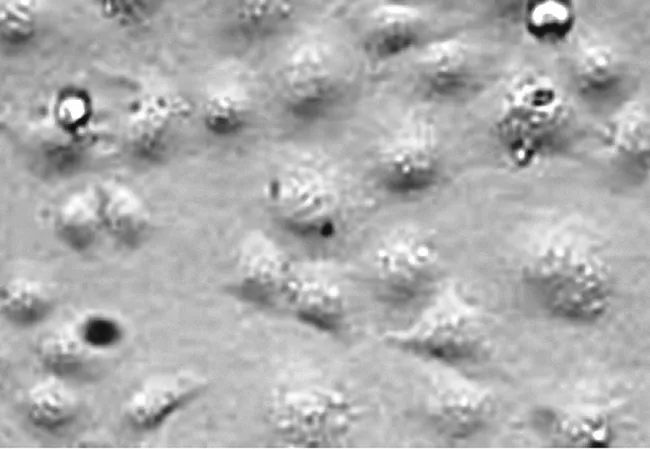
图4 清肺益气方作用24 h肺癌细胞形态
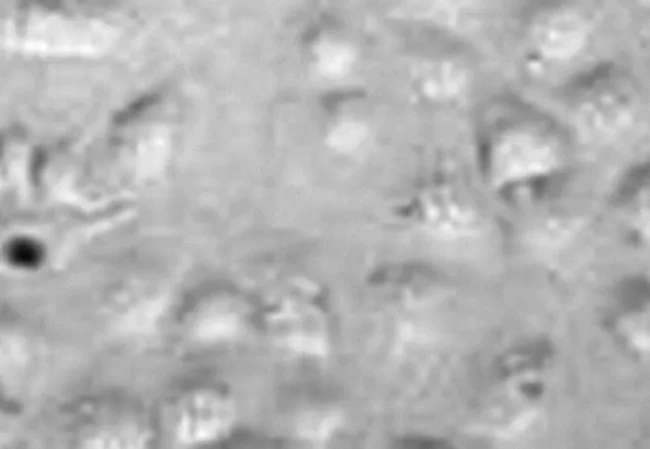
图5 清肺益气方作用48 h肺癌细胞形态
2.3肺癌增殖相关基因表达情况清肺益气方组细胞中Caspase-3和p53 mRNA表达水平均显著高于阴性对照组和空白对照组(P均<0.05),而阴性对照组和空白对照组比较差异无统计学意义(P>0.05)。见表2。
2.4肺癌增殖相关蛋白表达情况清肺益气方组细胞中Caspase-3和p53蛋白表达水平均显著高于阴性对照组和空白对照组(P均<0.05),而阴性对照组和空白对照组比较差异无统计学意义(P>0.05)。见表3和图7。

图6 各组细胞凋亡情况

组别Caspase-3p53阴性对照组1.02±0.09①0.98±0.06①空白对照组0.95±0.06①1.01±0.22①清肺益气方组3.79±0.645.09±0.77
注:①与清肺益气方组比较,P<0.05。

表3 各组肺癌增殖相关蛋白表达灰度值比较
注:①与清肺益气方组比较,P<0.05。
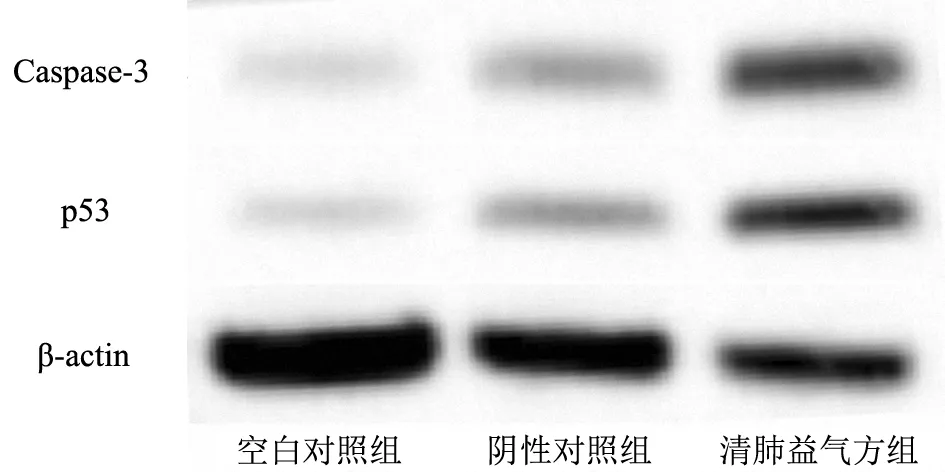
图7 各组肺癌增殖相关蛋白表达情况
2.5肺癌细胞上清液中VEGF和HIF-1α表达情况清肺益气方组细胞上清液中VEGF和HIF-1α的表达水平均显著低于阴性对照组和空白对照组(P均<0.05),而阴性对照组和空白对照组比较差异无统计学意义(P>0.05)。见表4。

表4 各组肺癌细胞上清液中VEGF和HIF-1α表达情况
注:①与清肺益气方组比较,P<0.05。
2.6肺癌CICs的侵袭抑制情况清肺益气方组侵袭细胞数为(25.07±15.06)个,阴性对照组为(84.09±15.21)个,空白对照组为(80.33±14.77)个,清肺益气方组侵袭细胞数显著低于阴性对照组和空白对照组(P均<0.05),而阴性对照组与空白对照组比较差异无统计学意义(P>0.05)。
3 讨 论
近年来,肺癌的发病率和病死率呈逐年增高趋势,已居于我国城市人口肿瘤发病率的第1位。在众多确诊的肺癌患者中约80%为非小细胞肺癌[3],约60%是存在远处转移的晚期肺癌[4]。大多数患者即使给予积极有效的抗肿瘤治疗,5 年生存率仍非常低,大部分患者因肿瘤复发或远处转移而死亡。近年传统中医药在肺癌的治疗中显示出了突出的优势,成为肺癌综合疗法的重要组成部分[5-6]。
传统中医学认为,晚期肺癌多属肺肾亏虚、精血不足、癌毒蕴结之证[7],故动则气喘,腰酸膝软,食欲不振,治当益气清肺、润燥止咳[8]。清肺益气方出自《活人心统》卷下,主治肺痿叶焦,人形憔悴,具有清肺益气、化痰止咳之效。方中黄芪为主药,同人参合用,大补元气,补脾益肺,提高免疫系统功能;黄芩、百合、北梗清肺润燥、化痰止咳,贝母清肺化痰、散结消肿,薏苡仁补益肺脾之气、化湿祛痰,升麻升举阳气、解毒宣肺,甘草补益肺气。该方具有控制肺癌进展和复发转移的作用,可延长患者的生存期,提高机体免疫功能,有效改善患者憋气、咳嗽、胸痛等症状,配合化疗药物可达到减毒增效的目的。本实验结果显示,清肺益气方组的细胞增殖抑制率显著高于阴性对照组和空白对照组,提示清肺益气方对肺癌CICs有显著的细胞毒作用,且随着含药血清浓度的增加,其抑制肺癌细胞增殖的作用逐渐增强,呈浓度依赖性,且在80.12 μmol/mL的剂量下随着给药时间的延长,肺癌细胞形态逐渐皱缩变形,坏死脱落。而采用Tran-swell小室侵袭实验检测结果显示,清肺益气方处理组的侵袭细胞数显著低于阴性对照组和空白对照组,提示清肺益气方可显著削弱肺癌CICs在体外基质中的迁移与侵袭能力,抑制肿瘤细胞的增殖与生长。流式细胞术检测结果显示,清肺益气方组细胞凋亡率明显高于空白对照组及阴性对照组,说明清肺益气方可有效促进肺癌细胞的凋亡,抑制肿瘤的生长。
Caspase-3是诱导细胞凋亡并抑制其增殖的重要因子,在死亡受体介导的凋亡途径中发挥关键作用,Caspase-3可通过自身切割而被活化,使下游半胱氨酸蛋白酶激活,诱导细胞的凋亡过程[9]。而p53蛋白是作用较为广泛的肿瘤抑制因子[10],可通过负向调节细胞生长周期来调节细胞增殖与凋亡。本研究结果显示,清肺益气方组细胞中Caspase-3和p53基因和蛋白表达水平显著高于阴性对照组和空白对照组,说明清肺益气方可通过上调p53和Caspase蛋白的表达,促进肺癌CICs的凋亡,从而达到抑制肺癌CICs体外增殖的目的。
VEGF是血管内皮细胞生成过程中的最重要的细胞因子,在多种肿瘤的血管生成、肿瘤生长及转移中发挥重要作用[11-12]。有研究显示,在肺癌患者中VEGF可呈现高表达,参与了肺癌的病理进程,是反应肺癌恶性程度、淋巴结转移及预后不良的敏感指标[13-14]。HIF-1α是在缺氧应激反应过程中的重要转录因子,当机体组织环境中的氧浓度下降时,其表达可显著增高,在调控细胞的生长、糖代谢、氧的转运和利用等多个方面发挥重要作用[15-16]。其可上调VEGF的mRNA和蛋白水平。有研究证实,当肿瘤发生转移时,HIF-1α可上调VEGF的表达,从而促进肿瘤血管的生成,促进肿瘤细胞的增殖[15,17]。本研究结果显示,清肺益气方组细胞上清液中VEGF和HIF-1α的表达水平显著低于阴性对照组和空白对照组,说明清肺益气方可能通过抑制VEGF和HIF-1α的表达,从而抑制肿瘤血管生成,达到抗肿瘤作用的目的。
综上所述,清肺益气方对肺癌CICs具有显著的抑制作用,其机制可能通过上调凋亡抑制基因和蛋白p53和Caspase-3的表达,促进肺癌CICs的凋亡,削弱肺癌CICs的迁移与侵袭能力,并抑制VEGF和HIF-1α的表达,抑制肿瘤血管的生成等多个靶点发挥抗肿瘤增殖的作用。
[参考文献]
[1]宋东颖,王毅,孙岚,等. 肿瘤干细胞理论及肿瘤干细胞分离和鉴定研究进展[J]. 中国药理学与毒理学杂志,2012,26(5):674-679
[2]任涟萍,王佳,郭雪君,等. CD133+A549肺癌细胞的分选及其肿瘤干细胞和间质化相关基因的表达[J]. 上海交通大学学报:医学版,2012,32(6):736-740
[3]蒋晓岚,王佳. 非小细胞肺癌骨转移患者预后影响因素分析[J]. 山东医药,2016,56(35):88-90
[4]田界勇,魏大中,马冬春,等. 非小细胞肺癌淋巴结转移规律分析[J]. 中国癌症杂志,2012,22(5):385-388
[5]钱彦方. 中医药对肺癌临床干预的思考[J]. 现代中西医结合杂志,2011,20(33):4301-4304;4309
[6]吴大英,王淑冰,吴志海,等. 中医联合介入化疗对老年晚期肺癌患者免疫功能的影响[J]. 现代中西医结合杂志,2013,22(33):3722-3723
[7]李燕巍,潘战宇,岳振松,等. 肺癌治疗中辨证论治与循证医学的矛盾与统一[J]. 医学与哲学,2014,13(16):91-93
[8]潘慧丽,曹焱. 中医药内治法治疗肺癌的研究进展[J]. 中国生化药物杂志,2015,35(12):183-185
[9]张黎黎,张洁,张林,等. p53、bcl-2、caspase-3在非小细胞肺癌组织中的表达及相关性分析[J]. 天津医药,2014,42(7):670-673
[10] 姜爱英,孙迎燕,王松,等. 老年晚期非小细胞肺癌组织 p53,bcl-2,caspase-3表达变化及其与预后关系[J]. 中国老年学杂志,2016,36(15):3735-3736
[11] 秦跃红,王功朝,刘滨,等. 星形细胞肿瘤组织中 VEGF-A、VEGF-C的表达变化及其与肿瘤血管生成的关系[J]. 山东医药,2014,54(15):1-3
[12] 宋冀东,闫继东. Smad4和VEGF在人非小细胞肺癌组织中的表达及其相关性分析[J]. 中国实验诊断学,2014,18(11):1781-1784
[13] 梁晶,贾新凤,韩福才,等. 肺癌患者外周血中MMP-7 mRNA、sMICA、VEGF的表达及其与侵袭转移的关系[J]. 肿瘤防治研究,2016,43(6):508-512
[14] 张冉,木合塔江·吐尔逊,马晓梅,等. 原发性肺癌组织中 VEGF、HIF-1α、EGFR 的表达及其相关性研究[J]. 新疆医科大学学报,2016,39(8):992-996
[15] 高峰,陈丽霞,常福厚,等. CYP1A1、CYP1B1、VEGF、CAⅨ基因与肺癌关系的研究进展[J]. 中国生化药物杂志,2014,34(2):151-152;156
[16] 祁蕾,苑博,傅强,等. 缺氧/再复氧与脂多糖激活肠上皮细胞核转录因子-κB和低氧诱导因子-1α信号通路以及大黄素对其的干预作用[J]. 中华危重病急救医学,2014,26(6):409-414

