纳米技术提高抗菌药物治疗胞内菌感染的研究进展
周凯翔,李 超,王晓芳,谢书宇*
(1.国家兽药残留基准实验室(HZAU)/国家兽药安全评价实验室/农业部畜禽产品质量安全风险评估实验室,华中农业大学,武汉 430070;2.河北省畜牧兽医研究所,河北保定 071000)
目前,专性和兼性胞内病原菌(立克次体、衣原体、金黄色葡萄球菌、胞内劳森菌、布氏杆菌、沙门氏菌、结核分枝杆菌、麻风杆菌、嗜肺军团菌)能通过自身特定的生存策略或者毒素透化细胞膜进入细胞,引起慢性和持续性感染,给畜牧业生产造成了巨大的经济损失,严重阻碍了畜牧业经济的健康发展。据不完全统计,在世界范围内每年约有5000万头牛感染结核,年均直接经济损失达30亿美元[1]。奶牛乳腺炎在我国的发病率为20%~70%左右,其中隐性乳腺炎的发病率高达70%,以金黄色葡萄球菌奶牛乳腺炎的发病率和危害最为严重。据权威统计,胞内劳森菌引起的猪增生性肠炎(PPE)在美国每年造成的损失高达2000万美元。
常规抗菌药物因不能有效进入宿主细胞、胞内蓄积能力弱、活性降低或丧失等原因在胞内感染靶位达不到有效的治疗浓度和时间[2-4],造成胞内感染性疾病治疗面临具大的难题和挑战。且长时间的亚治疗剂量还易诱导细菌耐药性的产生。因此,胞内感染疾病的治疗难题成为了药物学和兽医工作者的研究焦点和热点。近些年来,研究发现纳米抗菌药物可以通过淋巴转运和炎性部位毛细血管的渗透增强作用输送到感染的靶部位和靶细胞[5]。纳米药物到达感染部位后,可以通过膜融合、内吞、膜裂缝通道等多种途径和方式被摄入感染细胞[6-7],从而提高抗菌药物在细胞内的浓度和维持有效浓度的时间,显著提高了胞内感染的治疗效果,为突破畜禽胞内感染性疾病的治疗难题提供新的途径。本文就纳米抗菌药物治疗胞内感染性疾病的有效性、优效性、治疗研究进展和面临的挑战进行了系统的总结和分析,以便为未来的研究提供思路,加快纳米技术在胞内感染性疾病治疗的应用研究进程,为畜禽胞内菌感染性疾病治疗提供高效的兽药产品。
1 胞内感染性疾病治疗面临的难题
专性和兼性胞内菌能通过特定的侵袭机制或者毒素透化细胞膜进入细胞。如图1所示,金黄色葡萄球菌可以先通过β-毒素将细胞膜外层亲水性磷酸胆碱水解暴露出疏水性神经酰胺结构,再由δ-毒素透化疏水部分从而穿透细胞膜进入细胞;沙门氏菌在被细胞吞噬体吞噬后,其可以在吞噬小泡中存活下来,从而在细胞内定居。此外,某些专性或兼性胞内病原菌产生细菌毒素和靶向于宿主细胞膜的表面蛋白,或者合成效应蛋白进入宿主细胞的细胞核并改变“组蛋白密码”,诱导宿主细胞DNA甲基化模式的改变,引起宿主细胞的表观遗传变化和基因表达模式的改变,抑制抗菌免疫反应并为细菌定植、增长、传播创造有利条件[8],引起急性和持续性感染。
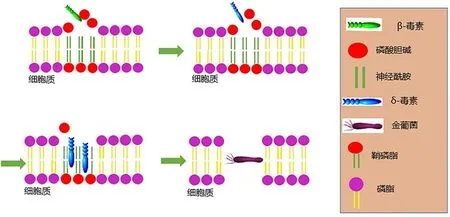
图1 金葡菌入胞机制Fig 1 The entrance cell mechanism of S.aureus
目前,兽医临床上胞内菌感染性疾病的治疗主要依赖于抗生素,而抗生素要起到抗菌效果首要前提是在胞内感染靶位达到抑菌浓度,但常规的抗菌药多难以透过细胞膜屏障进入细胞起到高效的抑菌或杀菌作用。例如,β-内酰胺类因其抗菌谱广和抗菌活性强是兽药临床细菌感染首选药物之一,但其多数成员与细胞膜的亲和力不高,不能有效进入细胞内,且易被胞内溶酶体酶所降解。又如,四环素类透膜能力差,在胞内浓度往往达不到抑菌水平,不仅无法起到有效的治疗作用,而且长时间的亚治疗剂量还极易诱导细菌耐药的产生。氨基糖苷类抗生素分子极性强,透膜速率非常缓慢,进入细胞后也主要分布在溶酶体,无法充分的发挥药理学作用。研究报道,氨基糖苷类特别是庆大霉素对金葡菌的SCVs表型几乎无效[9]。尽管,氟喹诺酮类抗菌药物对细胞膜有很强的渗透性且跨膜速率较快,但当胞外的浓度比胞内的浓度低时,可在有机阴离子载体的作用下快速被转运到胞外,导致其在胞内不能有效蓄积而达不到有效抑菌时间[10],常造成临床治疗的失败。大环内酯类抗生素多与生物膜的亲和力较高,进入细胞内的速率和效率优于大多数抗菌药物,常被用来治疗胞内劳森菌等畜禽胞内菌感染性疾病,但其在胞内蓄积性能较弱,并且在酸性条件活性较差或变异较大。由此可见,多数常规抗菌药物不能有效和高效的治疗畜禽胞内感染性疾病,从而导致胞内菌感染性疾病严重危害了畜牧业的健康发展。
因此,如何利用制剂技术提高抗菌药物对被感染细胞的传递效率、胞内蓄积能力、维持和改善细胞内药物的活性是解决畜禽胞内感染性疾病治疗难题的有效策略。
2 纳米抗菌药物治疗胞内感染的有效性和优效性
纳米载药技术是指将药物溶解、包裹于固体脂质基质、高分子等载体材料中形成纳米粒,常用载体有相嵌段共聚物、聚酯类、聚氰基丙烯酸烷酯类、磷脂、长链脂肪酸、三酰甘油酯、蜂蜡和胆固醇等。常见的纳米载药系统包括固体脂质纳米(SLNs)、脂质体、聚合物纳米、树状大分子和囊泡等。将药物制成纳米粒后,体内过程依赖于载体的理化特性、粒径、电位等理化性质,所以药物经纳米载药系统搭载后与机体有良好的亲和性,易于透过机体的生物屏障,在胞内菌的治疗中具有优越的发展前景。大量研究表明,上述纳米载药系统可以改善药物对机体生物膜屏障的透过能力,提高药物在胞内的蓄积能力,延长药物的作用时间。研究报道(表1),利用明胶纳米系统和纳米乳化技术分别延长了利福平和多西环素、氟苯尼考有效血药浓度的维持时间[11]和体外释放时间[12]。Pothayee等制备的聚合物胶束显著增强了庆大霉素对胞内布鲁氏菌的抗菌活性[13]。Zaki等制备的壳聚糖纳米粒有效提高了头孢曲松钠抗胞内鼠伤寒沙门氏菌的效力[14]。利用聚乳酸-羟基乙酸共聚物(PLGA)纳米来提高庆大霉素的胞内浓度也有报道[15]。

表1 纳米技术提高抗菌药物性能的研究实例Tab 1 The examples of nanotechnologies improving the effect of antimicrobial
3 纳米抗菌药物在畜禽胞内感染性疾病治疗的研究
3.1结核分枝杆菌病的治疗众所周知,结核分枝杆菌感染的治疗一直以来在医学方面都是一项严峻的挑战。结核分枝杆菌导致的结核病是以肉芽肿的发展为特点的慢性传染病,而且是牛结核病的主要病原菌。2012年结核病被列入贫困国家死亡原因的前十,为这些国家的经济与医疗保障系统施加了巨大的压力[16]。结核分枝杆菌不仅具有良好的细胞适应性,且在进化过程中学会了通过抵御宿主环境去平衡宿主的免疫防御策略而生存繁殖[17]。如表2所示,目前研究的用于治疗肺结核的纳米药物,其易被内化,优先进入细胞组织与器官,同时具有较高的稳定性与生物利用度,比如PLGA纳米可提高抗结核药物(利福平、吡嗪酰胺、异烟肼)在肺和感染肺泡巨噬细胞中的生物利用度[18]。Gaspar等制备的利福布丁-SLNs延长了利福布丁在THP1细胞内对结核杆菌的抗菌时间[19]。与莫西杀星相比莫西杀星聚氰基丙烯酸正丁酯(PBCA)纳米粒在巨噬细胞的蓄积能力提高了3倍,蓄积时间延长了6倍[20]。

表2 纳米技术提高抗菌药物治疗结核分枝杆菌病的研究实例Tab 2 The examples of nanotechnologies improving effect of antimicrobial treatment infection of M.tuberculosis
3.2金黄色葡萄球菌感染的治疗金黄色葡萄球菌既可以侵入专业吞噬细胞如单核细胞、巨噬细胞、多核性白细胞等细胞内,也可侵入非专业吞噬细胞如内皮细胞与上皮细胞等细胞内[21-22]。侵入细胞后,金葡菌能通过从吞噬体中逃逸、阻止溶酶体和吞噬体结合形成吞噬溶酶体、颠覆细胞自噬等多种特定的生存策略在胞内生存并增殖,最后使被感染细胞裂解,子代从细胞内释放出来,再次感染其他易感细胞。且金葡菌的突变表型SCVs表型对多种抗生素和环境压力存在耐性,这也是金葡菌感染难以根治的重要原因之一。纳米技术提高抗菌药物对金葡菌及其耐药型(MARS)的抗菌效果均有报道(表3),Rassouli等制备的替米考星纳米结构脂质载体(NLC)和脂质核心纳米胶囊(LCN)与替米考星比较,对金葡菌的最小抑菌浓度(MIC)和最低杀菌浓度(MBC)值都降低[23]。也有研究表明利用脂质体技术可以提高达托霉素和克拉霉素对耐甲氧西林金葡菌(MARS)的抗菌活性[24]。Kalhapure等利用固体脂质纳米载药系统延长了盐酸万古霉素和克拉唑银的有效抑菌时间,提高了其对MARS的治疗效果[25-26]。

表3 纳米技术提高抗菌药物治疗金葡菌感染的研究实例Tab 3 The examples of nanotechnologies improving effect of antimicrobial treatment infection of S.aureus
3.3沙门氏菌感染的治疗沙门氏菌引起的疾病是细菌性人畜共患病之一[27],其在宿主细胞内具有很强的适应性,主要引起畜禽副伤寒,死亡率很高,给畜牧生产造成了巨大的损失。它可以感染多种类型的细胞,包括巨噬细胞、树突状细胞和上皮细胞[28],也可进入非吞噬细胞[29]。组织培养实验发现,鼠伤寒沙门氏菌能够生存在巨噬细胞内,这表明在宿主细胞内存活是鼠伤寒沙门氏菌致病的一个基本特征[30]。而且在细胞水平上,沙门氏菌在细胞内的定位面临着独特的困难[31],因此,目前有必要采取新的治疗措施。据报道,替米考星纳米乳、庆大霉素聚合物胶束分别增强了药物对沙门氏菌抑制作用[32]和在巨噬细胞内的抗菌活性[33]。Xie等制备的恩诺沙星-山萮酸固体脂质纳米显著提高了恩诺沙星在小鼠RAW264.7单核巨噬细胞的蓄积能力,有效延长了抗胞内沙门氏菌的抗菌时间[34](表4)。

表4 纳米技术提高抗菌药物治疗沙门氏菌感染的研究实例Tab 4 The examples of nanotechnologies improving effect of antimicrobial treatment infection of Salmonella
3.4单核细胞增生性李斯特菌感染的治疗李斯特菌包括十个菌株,其中,单核细胞增生性李斯特菌是唯一能够引起人类疾病且一种短小的革兰氏阳性无芽胞杆菌,被列为20世纪90年代四大食源性疾病致病菌之一,是一种人畜共患病的致病菌,具有潜在的危害性[35-36]。随着纳米药物的研究不断深入,如表5所示,有学者研究表明纳米铂颗粒具有优秀的进入单核细胞增生性李斯特菌细胞内的能力[37]。聚氰基丙烯酸异己基酯(PIHCA)纳米粒能显著增强氨苄西林对单核细胞增生性李斯特菌的抗菌活性[38]。Imbuluzqueta等制备的PLGA纳米改善了庆大霉素在胞内的积聚能力,从而提高了抗胞内李斯特杆菌的能力[39]。也有报道称青霉素G脂质体可以有效抑制李斯特菌在胞内的增殖[40]。

表5 纳米技术提高抗菌药物治疗李斯特菌感染研究实例Tab 5 The examples of nanotechnologies improving effect of antimicrobial treatment infection of L. monocytogenes
4 纳米药物跨膜和胞内转运及其影响因素
4.1纳米粒跨膜和胞内转运的研究纳米药物的传递是一个极其多样复杂、动态的过程,涉及方面较多,如内吞作用,细胞内交付,生物降解,药物释放和胞外分泌等。因此,综合全面了解纳米药物入胞机制是发展纳米药物治疗胞内菌感染性疾病的前提条件。根据细胞种类不同,纳米药物摄入细胞的途径主要分为吞噬作用和吞饮两种,其中巨噬细胞、嗜中性粒细胞、单核细胞和树突状细胞等专业吞噬细胞一般以拉链样和触发式的吞噬为主,非专业吞噬细胞以巨胞饮、脂伐介导和网格蛋白介导的吞饮为主[41]。
纳米药物进入细胞的途径不同,其在胞内的转运方式也不同,大致可分为溶酶体途径和非溶酶体途径。据报道,巨胞饮和网格蛋白介导的内吞通常为溶酶体介导的途径,该途径中,携带药物的晚期内吞体和溶酶体结合形成吞噬溶酶体,溶酶体将纳米材料降解而释放出药物;而脂伐介导的内吞常为非溶酶体途径,纳米药物结合到细胞膜表面后,沿着细胞膜移动到不含有溶酶体的脂伐囊泡中,并最终在胞质中释放。可见不同纳米药物跨膜和胞内转运途径不同,而不同胞内菌入胞侵袭机制和胞内定位也不同,深入研究纳米药物跨膜和胞内转运途径,将有助于增加抗菌药物与胞内菌接触的机会,提高抗菌的效果。
4.2纳米理化性质对其胞内转运的影响临床上对于纳米药物的理化性质的研究主要集中在形态结构、粒径、Zeta电位、材料、表面亲疏水性等方面。起初认为粒径大小与表面电荷是决定细胞摄取和胞内命运的主要因素,随着研究的深入,发现纳米粒正负电荷的种类、材料的强度、表面亲疏水性等都可能会影响其与细菌细胞壁的亲和力,从而影响其在胞内的转运。因此,粒径、电位、表面亲疏水性等理化性质是纳米药物的重要特性,它们对于纳米药物治疗胞内感染性疾病的效果起着重要的作用。由于细胞膜带负电荷,通常认为带正电荷的纳米药物与细胞的亲和力更高,但有研究表明带负电荷的纳米药物与细胞膜亲和力也很高,如Straubinger等证明随着表面负电荷的增加,环丙沙星脂质体和阿奇霉素脂质体的胞内蓄积能力和对结核分枝杆菌的抗菌活性显著提高[42]。Gasparm等试验也表明带有负电荷的纳米脂质体更有利于其被细胞摄取[43]。Xie等的研究表明同等粒径的恩诺沙星-山萮酸固体脂质纳米粒,表面电荷的绝对值越大,其细胞摄取率也越高,而电荷的绝对值相近的情况下,纳米粒径越大,越易被细胞摄取[34]。可见纳米粒的理化性质与其性能有着重要联系,对于不同的纳米药物,影响其胞内转运的决定因素也不一样,因此,建立能高效胞内传递的纳米药物制备理论,将为胞内菌感染的治疗提供新模式。
5 纳米药物在胞内感染性疾病治疗中面临的挑战
综上所述,纳米载药系统搭载的药物可经过多种转运途径进入细胞,为解决常规抗生素治疗胞内菌感染面临的难题提供了新思路。但是,纳米载药系统要在兽药领域推广开来,还面临着生产成本、系统自身缺陷、安全性等的多重考验。考虑到药物分子的理化性质,纳米载药系统有时必须要采用合成高分子载体材料,但达到理想药效的同时,生产成本和制备技术等问题也给其在兽药领域的应用提出了挑战。同时,纳米载药系统还面临着技术自身缺陷的挑战。聚合物胶束纳米的毒性、有机溶剂的残留,规模化生产工艺的缺乏等问题制约着其推广应用。固体脂质纳米载药系统对某些亲水性药物的载药量过低,脂质状态的复杂性,储存过程中的晶型和粒径的变化是影响其临床开发的重要瓶颈。脂质体制剂的物理稳定性差、载药量低、存储渗漏性和体内的不可控性是其临床推广应用亟待突破的关键科学和技术难题[44]。安全性是药物推广使用的前提,通常认为生理相容的脂质材料是无毒的,但是,有学者提出其纳米化后由于粒径减小和表面能的增加,其毒性可能会发生变化,纳米药物的在体毒性的研究还有待进一步深入。
6 纳米抗菌药物在畜禽胞内感染疾病治疗中的发展策略
为解决纳米载药系统面临的挑战,减小畜牧生产中因胞内菌感染造成的巨大损失,未来的发展可以从以下几个发面入手:①现有纳米载药技术的完善和改进,改善现有载药系统自身面临的安全性、稳定性、载药量低等问题,同时加强载体材料修饰的研究,使药物在体内的过程更符合人类的意愿。②目前理化因素对纳米药物在胞内转运的影响还尚未有定论,各学者的结论并未统一,进一步深入研究什么范围内的粒径、电荷更有利于纳米药物被细胞摄取,这对指导纳米载药系统的制备与优化显得尤为重要,建立起纳米药物高效胞内靶向传递理论,也有利于减小其开发和生产的成本。③利用特定胞内菌的生存策略,开发相应的载药系统,如图2所示,Zhang等用红细胞膜包被抗菌药物,制备出了红细胞膜包被的纳米凝胶系统,与常规抗菌药相比该系统显著提高了抗菌药对MARS的治疗效果,该系统巧妙地利用了金葡菌的生存策略,当金葡菌识别载药细胞的膜上受体,释放毒素透化细胞膜进入细胞后,正好暴露在抗生素环境中,整个释药系统对金葡菌来说成为了一个陷阱[45]。该技术的提出为解决常规抗菌药物难以透过细胞膜的难题提供了新思路。④研究表明,成本低廉、安全性好的萜类化合物不仅可以增加药物的透膜能力[46],而且可以破坏细菌细胞膜,萜类化合物与抗菌药物联合使用来治疗胞内菌感染的研究,有待进一步深入。⑤两亲性的树状大分子材料因其分子表面较多种类的原子基团,能与多种亲水性药物的原子团共价结合,从而增加药物与组织细胞的亲和力,增加亲水性药物的入胞能力和胞内停留时间[47],改善药物的口服生物利用度。大量研究也表明带有季铵盐阳离子的树状大分子本身也具有抗菌活性,其与抗菌药物的联合使用也有利于减缓细菌耐药性的产生。相信随着科学技术的不断发展,研究的不断深入,纳米载药技术将会更加成熟,更多的纳米载药技术将会运用到解决胞内菌感染的难题上来,为我国畜牧产业的健康发展保驾护航。
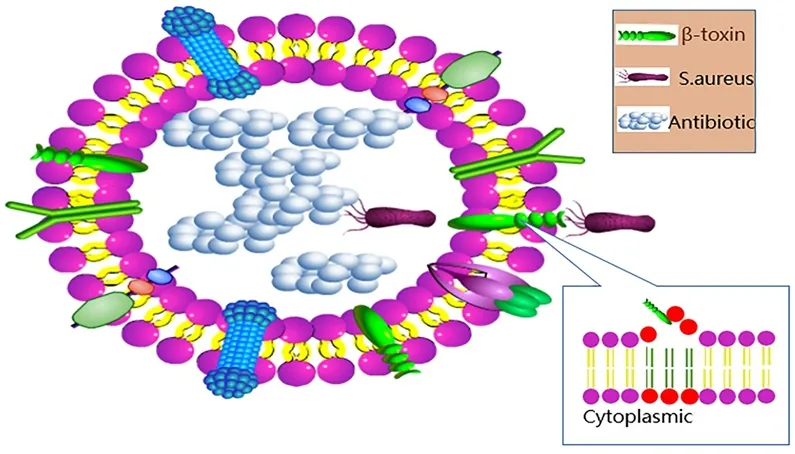
图2 细胞膜包被的纳米胶束抗菌机制Fig 2 The mechanism of cell membrane-coated nanoparticles against bacteria
参考文献:
[1]Steele, J.H.Regional and Country Status Report. In:Thoen, C.O.and J.H.Steele(Eds).Mycobacterium bovis infection in animals and humans[A].1995, 169-172.
[2]H.Hillaireau, P.Couvreur.Nanocarriers'entry into the cell:relevance to drug delivery[J], Cellular and Molecular Life Sciences, 2009, 66:2873-2896.
[3]J.Panyam, V.Labhasetwar.Sustained cytoplasmic delivery of drugs with intracellular receptors using biodegradable nanoparticles[J].Molecular Pharmaceutics, 2004, 1:77-84.
[4]P.Sendi, R.A.Proctor.Staphylococcusaureusas an intracellular pathogen:the role of small colony variants[J].Trends Microbiology, 2009, 17:54-58.
[5]Dwivedi G R, Sanchita, Singh D P,etal. Nano particles:emerging warheads against bacterial superbugs[J].Current Topics in Medicinal Chemistry, 2016, 16(18):1963-1975.
[6]Jain S, Sharma J M, Agrawal A K,etal. Surface stabilized efavirenz nanoparticles for oral bioavailability enhancement[J]. Journal of Biomedical Nanotechnology, 2013, 9(11):1862-1874.
[7]Akhtar N, Talegaonkar S, Khar R K,etal. Self-nanoemulsifying lipid carrier system for enhancement of oral bioavailability of etoposide by P-glycoprotein modulation:invitrocell line andinvivopharmacokinetic investigation[J].Journal of Biomedical Nanotechnology, 2013, 9(7):1216-1229.
[8]Hans Helmut Niller, Janos Minarovits. Patho-epigenetics of infectious diseases caused by intracellular bacteria[J].Advance Experiment Medicine and Biology, 2016, 879:107-130.
[9]Martin Vestergaard, Wilhelm Paulander, Bingfeng Leng,etal. Novel pathways for ameliorating the fitness cost of gentamicin resistant small colony variants[J].Frontiers in Microbiology, 2016, 7:1-12.
[10] A.H.Pinto-Alphandary, P.Couvreur.Targeted delivery of antibiotics using liposomes and nanoparticles:research and applications[J].International Journal Antimicrobial Agents, 2000, 13:155-168.
[11] Gaurav Kant Saraogi, Puspa Gupta, U.D.Gupta,etal. Gelatin nanocarriers as potential vectors for effective management of tuberculosis[J].International Journal of Pharmaceutics, 2010, 385:143-149.
[12] Li X Q, Xie Sh Y, Pan Y H,etal. Preparation, characterization and pharmacokinetics of doxycycline hydrochloride andorfenicol polyvinylpyrroliddone microparticle entrapped with hydroxypropyl-cyclodextrin inclusion complexes suspension[J].Colloids and Surfaces B:Biointerfaces, 2016, 141:634-642.
[13] N.Pothayee, N.Jain, T.P.Vadala,etal. Block ionomer complexes containing cationic antibiotics to kill intracellular brucella melitensisinvitro[J].Polymers for Advanced Technologies, 2012, 23:1484-1493.
[14] N.M.Zaki, M.M.Hafez.Enhanced antibacterial effect of ceftriaxone sodium-loaded chitosan nanoparticles against intracellularSalmonellatyphimurium[J].AAPS Pharm Sci Tech, 2012, 13:411-421.
[15] C.Lecaroz, C.Gamazo, M.J.BlancoPrieto.Nanocarriers with gentamicin to treat intracellular pathogens[J].Journal of Nanoscience and Nanotechnology, 2006, 6:3296-3302.
[16] Merchant Z, Buckton G, Taylor R M,etal. A new era of pulmonary delivery of nano-antimicrobial therapeutics to treat chronic pulmonary infections[J].Current Pharmaceutical Design, 2016, 22(17):2577-2598.
[17] Weiss G, Schaible U E.Macrophage defense mechanisms against intracellular bacteria[J].Immunological Reviews, 2015, 264:182-203.
[18] Sukhithasri V, Vinod V, Varma S,etal. Mycobacterium tuberculosis treatment modalities and recent insights[J].Current Drug Delivery, 2014, 11(6):744-752.
[19] Diana P.Gaspar, Vasco Faria, Lídia, M.D,etal. Rifabutin-loaded solid lipid nanoparticles for inhaled antitubercular therapy:Physicochemical andinvitrostudies[J].International Journal of Pharmaceutical, 2016, 497:199-209.
[20] K.O.Kisich, S.Gelperina, M.P.Higgins,etal. Encapsulation of moxioxacin within poly(butyl cyanoacrylate) nanoparticles enhances efcacy against intracellular mycobacterium tuberculosis[J].International Journal of Pharmaceutics, 2007, 345:154-162.
[21] Marjorie Bardiau, Johann Detilleux, Isabelle Ote,etal. Associations between properties linked with persistence in a collection ofStaphylococcusaureusisolates from bovine mastitis[J].Veterinary Microbiology, 2014, 169:74-79.
[22] Matteo Bonazzi, Pascale Cossart.Bacterial entry into cells:a role for the endocytic machinery[J].FEBS Letters, 2006, 580:2962-2967.
[23] Alwan Al-Qushawi, Ali Rassouli, Fatemeh Atyabi,etal. Preparation and characterization of three tilmicosin-loaded lipid nanoparticles:physicochemical properties andinvitroantibacterial activities[J].Iranian Journal of Pharmaceutical Research, 2016, 15(4):663-676.
[24] Li Y H, Su T T, Zhang Y,etal. Liposomal co-delivery of daptomycin and clarithromycin at an optimized ratio for treatment of methicillin-resistant staphylococcus aureus infection[J].Drug Delivery, 2015, 22(5):627-637.
[25] Rahul S.Kalhapure, Sandeep J.Sonawane, Dhiraj R.Sikwal,etal. Solid lipid nanoparticles of clotrimazole silver complex:An efficient nano antibacterial againstStaphylococcusaureusand MRSA[J].Colloids and Surfaces B:Biointerfaces, 2015, 136:651-658.
[26] Rahul S.Kalhapure, Chunderika Mocktar, Dhiraj R.Sikwal,etal. Ion pairing with linoleic acid simultaneously enhances encapsulation efficiency and antibacterial activity of vancomycin in solid lipid nanoparticles[J].Colloids and Surfaces B:Biointerfaces, 2014, 117:303-311.
[27] 赵志伟, 莫国东, 韦 平. 畜禽生产中沙门氏菌病的防控意义[J].广西畜牧兽医, 2011, 27(2):75-77.
Zhao Z W, Mo G D, Wei P. The significance of prevention and control to salmonella in livestock and poultry production[J].Guangxi Journal of Animal Husbandry & Veterinary Medicine, 2011, 27(2):75-77.
[28] Fink S L, Cookson B T. Pyroptosis and host cell death responses during salmonella infection[J].Cellular Microbiology, 2007, 9(11):2562-2570.
[29] Liu Y H, Zhang Q F, Hu M,etal. Proteomic analyses of intracellular salmonella enterica serovar typhimurium reveal extensive bacterial adaptations to infected host epithelial cells[J].Infection and Immunity, 2015, 83:2897-2906.
[30] Richter-Dahlfors A, Buchan A M, Finlay B B.Murine Salmonellosis studied by confocal microscopy:Salmonellatyphimuriumresides intracellularly inside macrophages and exerts a cytotoxic effect on phagocytesinvivo[J].Biotechnology Laboratory and Department of Physiology, 1997, 186(4):569-580.
[31] Pasmans F, Baert K, Martel A,etal. Induction of the carrier state in pigeons infected withSalmonellaenterica subspecies enterica serovar typhimurium PT99 by treatment with florfenicol:a matter of pharmacokinetics[J].Antimicrobial Agents and Chemotherapy, 2008, 52(3):954-961.
[32] 李向辉, 欧阳五庆, 杨雪峰, 等. 替米考星纳米乳的制备及其质量评价[J].西北农林科技大学学报, 2009, 37(4):42-46.Li X H, Ouyang W Q, Yang X F,etal. Preparation and quality evaluation of tilmicosin nanoemulsion[J].Journal of Northwest A&F University, 2009, 37(4):42-46.
[33] A.Ranjan, N.Pothayee, M.N.Seleem,etal.invitrotrafficking and efficacy of core-shell nanostructures for treating intracellularSalmonellainfections[J].Antimicrobial Agents and Chemotherapy, 2009, 53:3985-3988.
[34] Xie Sh Y, Yang F, Tao Y F,etal. Enhanced intracellular delivery and antibacterial efficacy of enrofloxacin-loaded docosanoic acid solid lipid nanoparticles against intracellularsalmonella[J].Scientific Reporter, 2017.
[35] Silk B J, Mahon B E.Comment on"Listeriosis in human pregnancy:a systematic review"[J].Journal of Perinatal Medicine, 2011, 39(6):749-750.
[36] 郭宏华, 贾芙蓉, 韩晓英, 等.单核细胞增生性李斯特菌研究进展[J].中国实验诊断学, 2013, 17(1):197-199.
Guo H H, Jia F R, Han X Y,etal. Research progress of monocyte proliferativeListeriamonocytogenes[J].Chinese Journal of Laboratory Diagnosis, 2013, 17(1), 197-199.
[37] Sawosz E, Chwalibog A, Szeliga J,etal. Visualization of gold and platinum nanoparticles interacting withsalmonellaenteritidis andListeriamonocytogenes[J].International Journal of Nanomedicine, 2010, 5:631-637.
[38] F.Forestier, P.Gerrier, C.Chaumard,etal. Effect of nanoparticle-bound ampicillin on the survival ofListeriamonocytogenesin mouse peritoneal macrophages[J].Journal of Antimicrobial Chemotherap.1992, 30:173-179.
[39] E.Imbuluzqueta, C.Gamazo, J.Ariza,etal. Drug delivery systems for potential treatment of intracellular bacterial infections[J].Frontiers in Bioscience(Landmark Edition), 2010, 15:397-417.
[40] M.Ito, E.Ishida, F.Tanabe,etal. Inhibitory effect of liposome-encapsulated penicillin G on growth ofListeriamonocytogenesin mouse macro-phages[J].tohoku journal of experimental medicine, 1986, 150:281-286.
[41] Shuyu Xie, Yanfei Tao, Yuanhu Pan,etal. Biodegradable nanoparticles for intracellular delivery of antimicrobial agents[J].Journal of Controlled Release, 2014, 187:101-107.
[42] Oh Y K, Nix D E, Straubinger R M,etal. Formulation and efficacy of liposome-encapsulated antibiotics for therapy of intracellular mycobacterium avium infection[J].Antimicrob Agents Chemother, 1995, 39(9):2104-2111.
[43] Gasparm M, Calado S, Pereira J,etal. Targeted delivery of paromomycin in murine infectious diseases through association to nano lipid systems.Nanomedicine:Nanotechnology, Biology and Medicine[J].2015, 11:1851-1860.
[44] Allen T M, Chonn A.Large unilamellar liposomes with low uptake into the reticuloendothelial system[J].Federation of the European Biochemical Societies, 1987, 223:42-46.
[45] Yue Zhang, Jianhua Zhang, Wansong Chen,etal. Erythrocyte membrane-coated nanogel for combinatorial antivirulence and responsive antimicrobial delivery againstStaphylococcusaureusinfection[J].Journal of Controlled Release, 2017.
[46] Kunta, J.R, Goskonda, V.R, Brotherton, H.O.etal. Effect of menthol and related terpenes on the percutaneous absorption of propranolol across excised hairless mouse skin[J].Journal of Pharmaceutical Sciences, 1997, 86:1369-1373.
[47] Zanini SF1, Silva-Angulo AB, Rosenthal A,etal. Effect of citral and carvacrol on the susceptibility ofListeriamonocytogenesandListeriainnocuato antibiotics[J].Letters in Applied Microbiology, 2014, 58:486-492.

