螺旋霉素高产菌株的选育
李春玲,丁亚莲,谢文静,牛 春,张 萍
(宁夏泰瑞制药股份有限公司,银川 750101)
螺旋霉素(Spiramycin,SPM)是一种16元大环内酯类广谱抗生素,主要由螺旋霉素链霉菌(Streptomycesspiramyceticus)发酵产生,用于治疗革兰氏阳性菌、部分革兰氏阴性菌、立克次氏体及大型病毒所引起的耳、鼻、喉和呼吸道感染,对青霉素、新霉素、四环素、链霉素等的耐受菌也具有显著的抑制作用。螺旋霉素在体内分布广泛且组织细胞内浓度较高,不良反应和毒副作用明显低于红霉素等,在国内外用途极其广泛,市场前景十分广阔[1-3]。经过多年的研究,目前国内螺旋霉素发酵生产水平处于4000 μg/mL左右,不足国外生产水平的1/2,菌种的生产性能是主要制约因素之一。因此,为了提高国内螺旋霉素生产的竞争力,必须对生产菌种进行选育。螺旋霉素生产菌种选育主要是利用物理、化学等因素诱导菌种产生突变,获得突变菌株,从中筛选出稳定、高产的优良菌株[4-7]。酰基激酶和酰基CoA合成酶是螺旋霉素内酯环生物合成的关键酶,而Co2+对酰基激酶和酰基CoA合成酶有较强的激活作用,通过选育耐受高浓度Co2+的突变株,可显著增加酰基激酶和酰基CoA合成酶活力,进而提高螺旋霉素生产水平[8-9]。本研究利用常压室温等离子体(ARTP)诱变、紫外线(UV)诱变和亚硝基胍(NTG)诱变的方法,结合螺旋霉素发酵生产过程的调控机制,定向选育出具有Co2+、豆油耐受性、噬菌体抗性的高产稳定性菌株,以期为进一步提高螺旋霉素的生产效率和产品品质奠定一定基础。
1 材料与方法
1.1材料出发菌株为螺旋霉素链霉菌SPM-14078菌株,由宁夏泰瑞制药股份有限公司技术中心保存。试剂均为国产分析纯;恒温大幅振荡摇床(HQL150C,武汉科学仪器厂)、恒温培养箱(LHP160,江苏杰瑞尔电器有限公司)、ARTP常压室温等离子体生物育种机(ARTP-Ⅱ型,北京思清源生物科技有限公司),分光光度计(BECKMANDU-600)、高效液相色谱系统(Waters)。
1.2培养基及培养条件斜面/分离培养基: 含葡萄糖、黄豆饼粉、CaCO3、MgSO4、NaCl、玉米浆、琼脂,纯水配制成1000 mL,pH调为6.9,121 ℃灭菌15 min,温度28 ℃,相对湿度40%,培养7 d。
种子培养基:精糊、黄豆饼粉、NaCl、KH2PO4、玉米浆、CaCO3,纯水配制成1000 mL,pH调为6.9,121 ℃灭菌15 min,培养温度28 ℃,相对湿度40%,转速220 r/min,培养时间30 h。
发酵摇瓶培养基:精糊、黄豆饼粉、玉米浆、MgSO4、KH2PO4、(NH4)2SO4、酵母粉、CaCO3、豆油,纯水配制成1000 mL,pH调为6.9,121 ℃灭菌15 min,培养温度28 ℃,相对湿度40%,转速220 r/min,培养时间6 d。
发酵罐(500 L)培养基:淀粉、鱼粉、葡萄糖、酵母粉、NaCl、KH2PO4、CaCO3、玉米浆、MgSO4、NH4NO3、豆油、正丙醇(发酵24 h后加入),pH调为6.9,培养温度28 ℃,相对湿度40%,培养时间6 d。
1.3方法
1.3.1孢子悬浮液的制备按文献[10]的方法,并作适当改进。利用接种环刮取成熟新鲜斜面孢子,然后用5 mL pH 6.86的无菌磷酸缓冲液冲洗,将洗下的孢子液倒入装有10粒玻璃珠的50 mL三角锥形瓶中,再反复冲洗2次,所得菌液全部倒入三角锥形瓶,28 ℃,220 r/min震荡30 min,以脱脂棉过滤,稀释至10-5备用。
1.3.2常压室温等离子体(ARTP)诱变按文献[6,11]的方法,并作适当改进。采用纯度为99.99%的氦气作为ARTP的工作气体,处理功率80 W,等离子体发生器出口与待处理样品之间的距离为4 mm,气体流量9.0 L/min。将制备好的50 μL孢子悬液均匀涂布于不锈钢载片上,然后对其进行照射处理,照射时间分别为0 s(对照)、40 s、80 s、120 s、160 s,用50 μL pH 6.86的无菌磷酸缓冲液冲洗,将照射后的菌悬液洗脱至平板中,重复洗脱3次,均匀涂布于平板,在28 ℃培养箱中倒置培养7 d,统计致死率。
1.3.3紫外线(UV)诱变按文献[5,10]的方法,并作适当改进。吸取3 mL制备好的孢子悬浮液于带磁力针的平皿内(直径9 cm),15W紫外灯(波长253.7 nm)打开预热25 min,然后将盛有孢子悬液的平皿放到磁力搅拌器上,距离紫外灯管30 cm,然后打开平皿盖,分别照射0 s(对照)、15 s、30 s、60 s、90 s,盖上平皿盖,整个诱变过程尽量在黑暗环境下进行,防止光修复作用。诱变结束后,在黑暗中放置1 h,吸取处理过的孢子悬浮液,均匀涂布于平板,在28 ℃培养箱中倒置培养7 d,统计致死率。
1.3.4亚硝基胍(NTG)诱变按文献[12]的方法,并作适当改进。吸取5 mL孢子悬浮液于50 mL的三角瓶中,加入150 μL NTG溶液(浓度10 g/L),放置于28 ℃,220 r/min的摇床间分别震荡30、60、90、120、180、240 min,诱变处理后菌液倒入10 mL离心管, 6000 r/min离心10 min,弃上清液,用5 mL pH 6.86的无菌磷酸缓冲液洗涤菌体,反复3次,然后再加入5 mL pH 6.86的无菌磷酸缓冲液将菌体制备成菌悬液,取150 μL涂布平板,以未处理的孢子悬浮液作为对照,在28 ℃培养箱中倒置培养7 d,统计致死率。
1.3.5HPLC测定按文献[13]的方法,并作适当改进。首先过滤发酵液,滤液经10000 r/min离心10 min,取上清液,再经0.22 μm的水相滤膜过滤至液相进样瓶中。色谱柱为岛津shim-pack CLC-ODS柱,柱温室温,流动相为体积比1:1的乙腈和醋酸铵(0.1 moL/L),流速为1 mL/min,检测波长为232 nm,进样量为10 μL;待测效价=(标准品的单位×待测样品的峰面积×待测样品的稀释倍数)/标准品的峰面积。
1.3.6致死率和正突变率每个处理30皿,重复3次,以未做诱变处理的孢子悬浮液作为对照,致死率=(对照处理平板菌落-诱变处理平板菌落)/对照处理平板菌落×100%。正突变率=诱变处理后效价高于对照5%的菌株数/诱变处理后菌株总数×100%。
1.3.7菌株遗传稳定性测定将筛选出的高产菌株先进行斜面保存,产生孢子后取少许孢子转入另一斜面,此为一代,连续传代 4次,采用摇瓶发酵法测定每一代螺旋霉素效价,分析螺旋霉素链霉菌的遗传稳定性。
1.3.8Co2+耐受性的检测孢子悬液稀释后涂布于含有1.2 mmol/L Co2+的平板上,于28 ℃培养箱倒置培养7 d,检测菌株的Co2+耐受性。
1.3.9噬菌体抗性的检测按文献[14]的方法,作适当改进。将孢子悬液稀释后涂布于含有噬菌体的平板上,以不含噬菌体的平板为对照,于28 ℃培养箱倒置培养7 d,检测菌株的噬菌体抗性。
1.3.10豆油耐受性的检测将孢子悬液稀释后均匀涂布在含有2.0%豆油的平板上,于28 ℃培养箱倒置培养7 d,检测菌株的豆油耐受性。
2 结果与分析
2.1出发菌株确定将原始菌株复壮培养后,有8个单菌落的发酵效价较高,经平板划线分离并进行三次转接后,结果发现编号SPM-14078的菌株发酵效价最高,为3551 μg/mL,且遗传性稳定,作为出发菌株(图1)。

图1 复壮菌株的效价及遗传稳定性Fig 1 Potency and inheritance stability of the rejuvenation strains
2.2使用ARTP处理菌株SPM-14078的诱变效果
SPM-14078菌株孢子悬液经ARTP照射处理40、80、120、160 s后,分别涂板,每个处理涂10个板,以未经照射处理的作为对照。培养后,统计每板存活菌落数,计算致死率和正突变率、测定正突变菌株的效价。结果发现,随着ARTP处理时间增加,菌体致死率显著升高,当处理时间为160 s时,致死率最高,达到97.3%,处理时间为120 s时,致死率为88.5%(表1)。结合已有的研究报道,确定处理时间120 s为适宜的诱变时间。SPM-14078菌株孢子悬液经ARTP处理120 s后,涂布平板。通过琼脂柱法进行初筛,得到16株正突变株。将正突变株连续传代3次,用发酵摇瓶法进行复筛,得到3株编号分别为SPMAR-1601、SPMAR-1602、SPMAR-1603的菌株,其效价分别为11037、9626、11291 μg/mL。

表1 ARTP诱变结果分析Tab 1 Mutagenic results of ARTP
同列数据上标不同字母表示组间差异显著(P<0.05)
2.3使用UV处理菌株SPM-14078的诱变效果SPM-14078菌株孢子悬液经UV照射15、30、60、90 s后,分别涂板,每个处理涂10个板,以未经UV处理的作为对照。培养后,统计每板存活菌落数,计算致死率和正突变率,测定正突变菌株的效价。结果发现,随着UV处理时间增加,菌体致死率显著升高,当处理时间为90 s时,致死率最高,达到91.4%,处理时间为60 s时,致死率为78.6%(表2)。结合已有的研究报道,确定处理时间60 s为适宜的诱变时间。SPM-14078菌株孢子悬液经UV处理60 s后,涂布平板。通过琼脂柱法进行初筛,得到22株正突变株。将正突变株连续传代3次,用发酵摇瓶法进行复筛,得到4株编号分别为SPMU-1601、SPMU-1602、SPMU-1603、SPMU-1604的菌株,其效价分别为9779、10285、10154、9374 μg/mL。
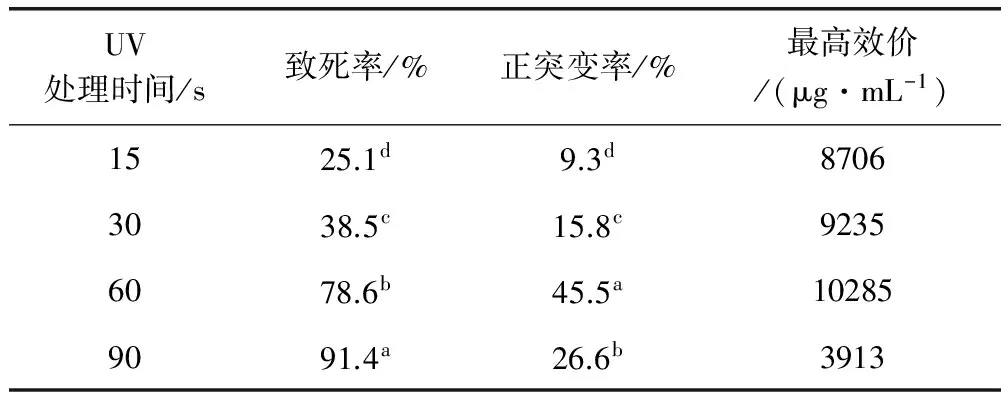
表2 UV诱变结果分析Tab 2 Mutagenic results of UV
同列数据上标不同字母表示组间差异显著(P<0.05)
2.4使用NTG处理菌株SPM-14078的诱变效果
SPM-14078菌株孢子悬液经NTG处理30、60、90、120、180、240 min后,分别涂板,每个处理涂10个板,以未经NTG处理的作为对照。培养后,统计每板存活菌落数,计算致死率和正突变率,测定正突变菌株的效价。结果发现,随着NTG处理时间增加,菌体致死率显著升高,当处理时间为240 min时,致死率最高,达到95.8%,处理时间为180 min时,致死率为80.4%。结合已有的研究报道,确定处理时间180 min为适宜的诱变时间(表3)。SPM-14078菌株孢子悬液经NTG处理180 min后,稀释涂布于平板上。通过琼脂柱法进行初筛,得到19株正突变株。将上述19株正突变株连续传代3次后,用发酵摇瓶法进行复筛,得到3株编号为SPMN-1601、SPMN-1602、SPMN-1603的优良菌株,其发酵效价分别为12361、9661、10046 μg/mL。

表3 NTG诱变结果分析Tab 3 Mutagenic results of NTG
同列数据上标不同字母表示组间差异显著(P<0.05)
2.5优良菌株遗传稳定性检测对不同诱变方法获得优良菌种进行进一步复筛,测定其遗传稳定性,结果发现,菌株SPMAR-1601、SPMAR-1603、SPMU-1602、SPMN-1603遗传稳定性好(图2)。

图2 优良菌种遗传稳定性分析Fig 2 Inheritance stability analysis of the fine strains
2.6优良菌株Co2+耐受性的检测将菌株SPMAR-1601、SPMAR-1603、SPMU-1602、SPMN-1603的菌株孢子悬液稀释10-5,然后分别涂布于含有1.2 mmoL/L Co2+的培养基平板上,培养后,观察菌落的生长情况,结果发现,SPMAR-1603、SPMU-1602、SPMN-1603菌株的生长情况好,而SPMAR-1601菌株的生长情况一般(表4)。结果表明,SPMAR-1603、SPMU-1602、SPMN-1603具有较好的Co2+耐受性。

表4 优良菌株Co2+耐受性检测Tab 4 Co2+ tolerance test of the fine strains
+++表示菌落生长好,++表示菌落生长一般
2.7优良菌株噬菌体抗性的检测将菌株SPMAR-1603、SPMU-1602、SPMN-1603的菌株孢子悬液稀释10-5,然后分别涂布于含有噬菌体的培养基平板上,培养后,观察菌落的生长情况,结果发现,SPMAR-1603、SPMN-1603菌株的生长情况好,SPMU-1602菌株的生长情况一般(表5)。结果表明,SPMAR-1603、SPMN-1603具有较好的噬菌体抗性。

表5 优良菌株噬菌体抗性的检测Tab 5 Phage resistance test of the fine strains
+++表示菌落生长好,++表示菌落生长一般
2.8优良菌株豆油抗性检测将菌株SPMAR-1603、SPMN-1603的菌株孢子悬液稀释为1×10-5,然后分别涂布于含有2.0%豆油的平板上,以不含豆油的平板为对照。培养后,观察菌落的生长情况,结果发现,含豆油的培养基上SPMAR-1603、SPMN-1603的菌落比不含豆油的培养基上的菌落明显大,且未见孢子(表6)。结果表明,SPMAR-1603、SPMN-1603菌株均具有较好的豆油抗性。

表6 豆油对优良菌株生长的影响Tab 6 Phage resistance test of the fine strains
2.9优良菌株发酵特性分析将选育出的优良菌株SPMAR-1603、SPMN-1603以及原始菌株SPM-14078进行发酵罐发酵,发酵后,分别测定效价、组分、菌丝浓度、残糖量、残油量,结果发现,SPMAR-1603菌种发酵液中效价和菌丝浓度最高,残糖和残油量最低(表7)。
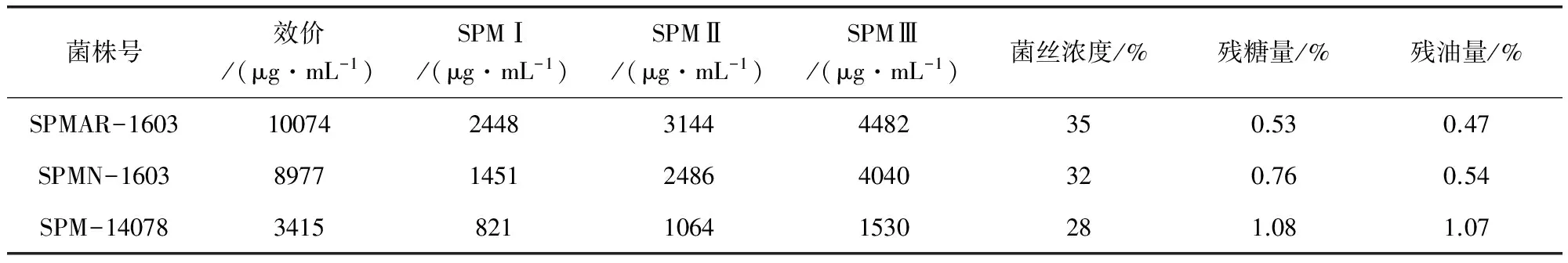
表7 优良菌株发酵特性分析Tab 7 Fermentation characteristic analysis of the fine strains
3 讨论与小结
菌种对螺旋霉素发酵生产起着关键性作用,刘守强等[5]、周德龙等[6]、王建国[7]等分别采用UV、ARTP、NTG诱变方法,对螺旋霉素发酵菌种进行了诱变选育,所选育出菌株的效价均有大幅提高,其中周德龙等[6]利用ARTP诱变方法选育出菌株的效价提高幅度最大。本研究运用ARTP、UV、NTG三种诱变方法,分别对螺旋霉素链霉菌进行诱变处理,结果表明这三种方法均可诱导菌株产生有效的突变,其中ARTP诱变效果最佳。这与上述三位研究者的研究结论相一致。
酰基激酶和酰基CoA合成酶是螺旋霉素生物合成过程中的限速酶,短链脂肪酸可诱导这两个酶的合成。发酵液中的豆油一方面可以满足菌体的生长,更重要的是豆油被菌体分解产生乙酸、丙酸、丁酸等短链脂肪酸,这些短链脂肪酸可促进酰基激酶和酰基CoA合成酶的合成,从而促进螺旋霉素的生物合成,有利于提高其产量。Co2+可增强酰基激酶和酰基CoA合成酶的活性,在发酵液中添加Co2+可激发这两个酶的活性,促进螺旋霉素的生物合成,也有利于提高其产量。本研究筛选出的优良菌株SPMAR-1603具有较好豆油耐受性和Co2+耐受性,这很可能是其效价得以大幅度提高的主要原因。螺旋霉素发酵生产易受噬菌体污染的影响,选育噬菌体抗性的菌株是防治噬菌体污染行之有效的办法。本研究筛选出的优良菌株SPMAR-1603具有较好的噬菌体抗性,可有效抑制发酵生产过程中噬菌体的污染,有助于提高生产效率。有关SPMAR-1603的生产试验正在进行之中,菌株的优良特性在规模化生产中的实际表现还有待进一步验证。
参考文献:
[1]朱 峰, 王尔健. 螺旋霉素的再评价[J]. 中国抗生素杂志, 1991, 46(3): 231-236.
Zhu F, Wang E J. Spiramycin reassessed[J]. Chinese Journal of Antibiotics, 1991, 46(3): 231-236.
[2]王 松, 罗 猛, 李 楠, 等. 螺旋霉素的体外抗菌、抗炎活性研究[J]. 黑龙江医药, 2011, 24(5): 696-699.
Wang S, Luo M, Li N,etal. Study on antibacterial and anti-inflammatory activity of spiramycin in vitro[J]. Heilongjiang Medicine Journal, 2011, 24(5): 696-699.
[3]Colombie V, Bideaux C, Goma G,etal. Effects of glucose limitation on biomass and spiramycin production by Streptomyces ambofaciens[J]. Bioprocess and Biosystems engineering, 2005, 28: 55-61.
[4]Jin Z H, Cen P L. Improved production of spiramycin by mutant Streptomyces ambofaciens[J]. Journal of Zhejiang University Science, 2004, 5(6): 689-695.
[5]刘守强, 赵 中, 刘 果, 等. 紫外诱变复合重金属离子抗性突变选育螺旋霉素高产菌株[J]. 化学与生物工程, 2016, 33(5): 26-40.
Liu S Q, Zhang Z, Liu G,etal. Screening spiramycin high-producing strain with UV and heavy metal ion resistance mutation[J]. Chemistry & Bioengineering, 2016, 33(5): 26-40.
[6]周德龙, 牛 春, 张 萍. 常压室温等离子体(ARTP)诱变及工艺优化筛选螺旋霉素高产菌株[J].内蒙古科技与经济, 2016, 24: 96-101.
Zhou D L, Niu C, Zhang P. Screening spiramycin high-producing strain with ARTP mutagenesis and process optimization[J]. Inner Mongolia Science Technology & Economy, 2016, 24: 96-101.
[7]王建国, 张 立, 李 华, 等. 亚硝基胍诱变螺旋霉素高产菌株的选育[J]. 山东化工, 2016, 45(9): 87-88.
Wang J G, Zhang L, Li H,etal. Breeding of NTG mutagenesis of spiranmycin producing strain[J]. ShangDong Chemical industry, 2016, 45(9): 87-88.
[8]Karray F, Darbon E, Oestreicher N,etal. Organization of the biosynthetic gene cluster for the macrolide antibiotic spiramycin in Streptomycesambofaciens[J]. Microbiology, 2007, 153: 4111-4122.
[9]Karray F, Darbon E, Nguyen H C. Regulation of the Biosynthesis of the Macrolide Antibiotic Spiramycin in Streptomyces ambofaciens[J]. Journal of Bacteriology, 2010, 192(21):5813-5821.
[10] 李春玲, 丁亚莲, 谢文静, 等. 不同诱变方法对TL-15028菌株产泰乐菌素相关性能的影响[J]. 中国兽药杂志, 2016, 50(12): 29-33.
Li C L, Ding Y L, Xie W J,etal. The effect of different induction mutation method on production performance for tylosin in TL-15028 strain[J]. Chinese journal of veterin drug, 2016, 50(12): 29-33.
[11] 沈小静, 张 萍, 石彦鹏. 常压室温等离子体结合紫外诱变筛选红霉素高产菌株[J]. 中国兽药杂志, 2015, 49(1) : 19-23.
Shen X J, Zhang P, Shi Y P. A mutant strain with high erythromycin yield obtained by using novel atmosphheric and room temperature plasmas and UV mutation[J]. Chinese journal of veterin drug, 2015, 49(1) : 19-23.
[12] 刘文玉, 史应武, 王杏芹, 等. 亚硝基胍诱变选育低温β-半乳糖苷酶高产菌[J]. 生物技术通报, 2008, 4: 185-187.
Liu W Y, Shi Y W, Wang X Q,etal. Screening of High-producing cold-adapted β-D-Galactosidase strain by NTG Mutagenesis[J]. Biotechnology Bulletin, 2008, 4: 185-187.
[13] 杨丽桃, 何家俊. HPLC法测定复方螺旋霉素片中螺旋霉素和甲硝唑的含量[J]. 广东药学院学报, 1998, 14(1): 39-40.
Yang L T, He J J. The content determination of spiramycin and metronidazole in compound spiramycin tablets with HPLC[J]. Journal of Guangdong Pharmaceutical University, 1998, 14(1): 39-40.
[14] 叶蕊芳, 郑 黎, 谢志梅, 等. 螺旋霉素产生菌抗噬菌体菌株的选育[J]. 华东理工大学学报, 1997, 23(10): 545-549.
Ye R F, Zheng L, Xie Z M,etal. Screening ofStreptomycesspiramyceticusfor phage-resistant strain [J]. Journal of East China University of Science and Technology, 1997, 23(10): 545-549.

