共免疫对跳蚤叮咬引起的猫过敏性皮炎保护效果评价
赵 兵,温良海,刘正伟,王 瀚,张爱国,李慧敏,李延鹏,陈瑞爱,*
(1.华南农业大学兽医学院,广州 510642;2.广东温氏大华农生物科技有限公司,广东新兴 527400)
猫桎首蚤分布很广,寄生于动物体表,以吸血为生,是对犬猫造成严重危害的蚤类。跳蚤过敏性皮炎(Flea allergy dermatitis, FAD)是由跳蚤叮咬吸血时引起动物的皮炎、剧烈瘙痒以及抓挠导致的二次感染的过敏性皮肤病[1]。因此,对猫桎首蚤的防控及其导致的过敏性皮炎的防治显得尤为重要。
人们针对跳蚤叮咬引起犬猫过敏性皮炎的防治方法有多种。首先利用杀虫剂、宠物香波等进行动物除蚤,然后采用药浴、涂抹激素类药物等对症治疗,虽能取得一定的疗效,但是这种方法存在疗效差、激素类药物副作用大等缺点,而且当跳蚤侵扰时不能阻止跳蚤过敏性皮炎再次发生[2]。也有人尝试免疫脱敏疗法,该方法通过反复接种过敏原,提高患病动物对变应原的耐受性,当动物再次接触过敏原时,机体会大大减少炎症介质的释放,从而减轻过敏性皮炎的发病程度,但该方法缺点是疗程长,可能会造成动物皮肤损伤甚至导致过敏性休克,效率也不稳定,重复性低[3-4]。
研究表明,过敏性疾病的发生与Th1向Th2漂移,Th2处于优势地位有关[5]。调节性T细胞可以通过细胞因子网络影响Th1、Th2的平衡[6],对防止自身免疫性疾病发生,限制慢性炎症等具有重要作用[7]。共免疫rFSA1和与之编码相匹配的质粒可以诱导一群诱导性调节性T细胞(iduced Treg, iTreg),能够改善鼠和猫FAD的症状[8-9]。为了解共免疫能否有效预防过敏性疾病,研究评价了共免疫对猫FAD的预防保护效果。
1 材料与方法
1.1猫和跳蚤45只年龄大于12个月、体重超过2 kg的同一品种家猫,购自北京市兴隆实验动物养殖厂;猫桎首蚤,由中国疾病预防控制中心提供。
1.2试剂与仪器pET28a载体、pVAX1载体购自淼灵生物科技(武汉)有限公司;E.coliDH5α、E.coliBL21(DE3)感受态细胞购自天根生化科技(北京)有限公司;限制性内切酶EcoRⅠ、XhoⅠ、XbaⅠ,DNA连接酶, DL2000 DNA Marker,DL15000 DNA Marker蛋白质分子质量标准,质粒抽提试剂盒等均购自宝生物工程(大连)有限公司;BCA蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;脂质体转染试剂购自北京雷根生物技术有限公司;Ni-NTA亲合层析柱填料购自北京诺博莱德科技有限公司;Biosafer150-96超声波细胞破碎仪购自赛飞(中国)有限公司;NanoDrop®Lite紫外分光光度计购自北京兰博康斯科技有限公司;诺普星购自诺华动物保健(上海)有限公司;鲎试剂购自湛江博康海洋生物有限公司;其他试剂均为国产分析纯。
1.3FSA1基因与引物的设计合成FSA1基因与引物均由上海生工生物工程有限公司合成。参照GenBank数据库发表的FSA1基因序列(登录号为AF102502),设计扩增FSA1基因的引物P1、P2和P3,核酸序列如下P1:5'-CGGGAATTCATGGAAGATATTTGG-3';P2:5'-CGGCTCGAGTTATTTATTTTTTGG-3';P3:5'-GCCTCTAGATTATTTATTTTTTGG-3'。P1为上游引物,带有EcoRⅠ酶切位点;P2、P3为下游引物,分别带有XhoⅠ、XbaⅠ酶切位点。
1.4FSA1基因的克隆
1.4.1原核表达质粒的构建及鉴定以人工合成的FSA1基因为模板,以P1、P2为引物,PCR扩增基因片段,克隆至原核表达载体pET28a,并转化E.coliBL21(DE3)感受态细胞,涂布于LB卡那抗性平板,挑取单菌落,EcoRⅠ、XhoⅠ双酶切并测序鉴定,将鉴定正确的原核表达质粒命名为pET28a- FSA1,重组菌命名为BL-FSA1。
1.4.2真核表达质粒的构建及鉴定以P1、P3为引物,PCR扩增基因片段,克隆至真核表达载体pVAX1,并转化E.coliDH5α感受态细胞,涂布于LB卡那抗性平板,挑取单菌落,EcoRⅠ、XbaⅠ双酶切并测序鉴定,将鉴定正确的重组菌命名为DH-FSA1。鉴定成功的pVAX1-FSA1参照脂质体转染试剂盒说明书转染BHK细胞,72 h后收集细胞,提取细胞总RNA,RT-PCR鉴定pVAX1-FSA1在真核细胞中的表达。
1.5共免疫疫苗的制备
1.5.1rFSA1蛋白制备与纯化将重组菌BL-FSA1接种于含有卡那霉素的LB液中培养,待OD600值达到0.6~0.8时,将菌液分为4组,其中3组分别以0.1、0.5、1.0 mmol/L IPTG浓度诱导,另一组不诱导作为对照,用SDS-PAGE法分析4 h后重组蛋白表达量。收集诱导表达的菌体,冰浴条件下进行超声波破碎,以10000 r/min离心包涵体15 min,取上清液和沉淀进行SDS-PAGE分析。
收集包涵体,用8 mol/L脲过夜搅拌溶解包涵体,离心取上清液,通过Ni-NTA亲和层析柱分离目的蛋白,洗脱液(8 mol/L脲、300 mmol/L KCl、50 mmol/L KH2PO4、500 mmol/L咪唑、pH8.0)洗脱目的蛋白FSA1,重组蛋白:0.5 mol/L精氨酸以1∶20(V∶V)比例稀释复性,置于透析袋中透析36 h,每12 h更换一次透析液(PBS)。利用曲拉通去除内毒素,将10%曲拉通X-114按1∶4体积比与rFSA1/PBS混匀,冰浴10 min,然后37 ℃水浴15 min,10000 r/min离心15 min,吸出上层液,重复以上步骤3次,按照鲎试剂使用说明书检测溶液内毒素。按照BCA蛋白浓度测定试剂盒说明书测定蛋白浓度后,于-70 ℃保存。
1.5.2真核表达质粒pVAX1-FSA1的制备将重组菌DH-FSA1接种于含有卡那霉素的LB液中,37 ℃过夜培养,按照文献[7]所述方法制备质粒pVAX1-FSA1。去除质粒溶液内毒素并检测内毒素含量。用紫外分光光度计测定浓度,于-70 ℃保存。
1.6免疫效力评价45只猫随机分为5组。共免疫组每只免疫500 μg rFSA1蛋白+500 μg pVAX1-FSA1质粒,载体对照组每只免疫500 μg rFSA1蛋白+500 μg pVAX1空载体;蛋白对照组每只免疫500 μg BSA蛋白+500 μg pVAX1-FSA1质粒,于腿部肌肉注射。二免后14 d开始攻跳蚤,每只猫每轮攻100只跳蚤(新羽化未吸血的成蚤),每次攻跳蚤48 h后,饲喂诺普星(有效成分:烯啶虫胺)除蚤,间隔12 d后开始下一轮攻蚤,总共攻4轮(攻4轮跳蚤后猫FAD皮炎评分能达到最高值,额外的轮数并不会增加皮炎评分分值)[6]。FAD对照组不免疫,采用相同的步骤攻4轮跳蚤和饲喂除蚤药。空白对照组既不免疫也不攻跳蚤,但是饲喂诺普星作为阴性对照。由专业的兽医人员给猫皮炎症状打分,评价共免疫对猫FAD的保护效果。实验在跳蚤活跃季节夏、秋季实施,所有猫饲养在铁笼里,笼具长90 cm、宽63 cm、高82 cm,每日打扫猫的排泄物,给予干净的水和猫粮,以提供舒适的环境。空白对照组猫在隔壁笼舍饲养,所有笼舍通风良好。猫实验分组情况见表1。

表1 猫实验免疫分组Tab 1 Dividing cats into five groups
“-”代表不操作
"-" on behalf of not operating
FAD症状主要包括丘疹、结痂、脱毛。每种皮损评分从0分至3分:0分-没有发病症状;1分-发病程度轻微;2分-中等程度的发病;3分-发病程度严重。各种皮损计分标准:丘疹1~3个计1分,4~6个计2分,7个及以上计3分;脱毛面积大于或等于1 cm2且小于4 cm2计1分,大于或等于4 cm2且小于9 cm2计2分,大于或等于9 cm2计3分;结痂1个计1分,2个计2分,3个及以上计3分。有3个部位的症状需要被观察:(1)颈背部,从头顶到尾部的区域;(2)胸腔侧:从近肘部的胸腔到最后一根肋骨出的区域;(3)跳蚤三角区,动物下腹部和两条后肢根部组成的一个三角区。
关于皮炎计分标准是依据文献[9]所述方法进一步细化得出的量化计分标准,有助于方便、准确评估FAD发病程度。
2 结 果
2.1FSA1基因的克隆及鉴定结果FSA1基因与原核表达载体pET28a连接后构建pET28a-FSA1,质粒经EcoRⅠ+XhoⅠ双酶切可产生5400 bp左右的空载体条带和一条480 bp的目的条带(图1);FSA1基因与真核表达载体pVAX1连接构建pVAX1- FSA1,质粒经EcoRⅠ+XbaⅠ双酶切可产生3000 bp左右的空载体条带和一条480 bp的目的条带(图2)。pET28a-FSA1与pVAX1-FSA1测序鉴定结果与预期相符。将pVAX1-FSA1转染BHK细胞,采用RT-PCR法测定重组质粒在BHK细胞中的表达,结果表明重组质粒pVAX1-FSA1转染后能在BHK细胞中稳定表达(图3)。
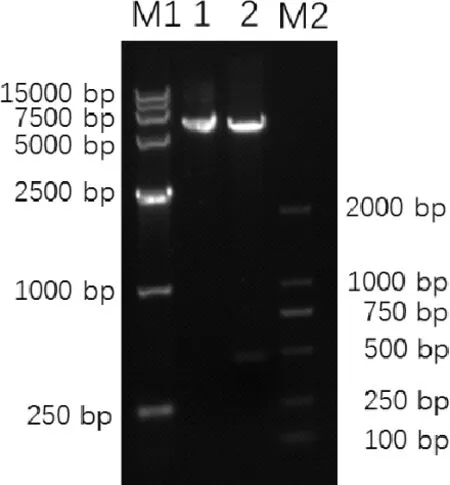
M1: DL15000 bp DNA Marker;M2: DL2000 bp DNA Marker;1:重组质粒pET28a-FAS1;2:重组质粒 EcoRⅠ+XhoⅠ双酶切产物M1: DL15000bp DNA Marker; M2: DL2000bp DNA Marker;1: recombinant plasmid pET28a-FSA1; 2: The product from recombinant plasmid pET28a-FSA1 digested with EcoRⅠ+XhoⅠ图1 重组表达质粒pET28a-FSA1的双酶切鉴定Fig 1 Double restriction enzyme digestion analysis of the recombinant plasmid pVAX1-FSA1
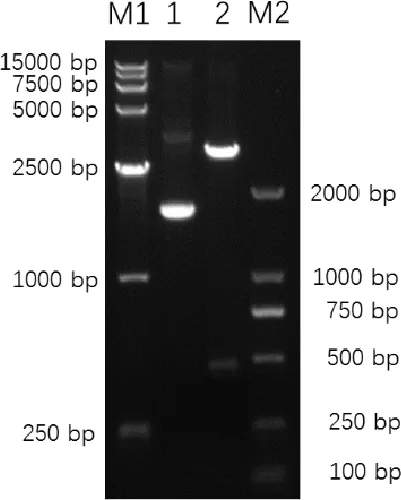
M1: DL15000 bp DNA Marker; M2: DL2000 bp DNA Marker;1:重组质粒pVAX1-FAS1;2:重组质粒EcoRⅠ+XbaⅠ双酶切产物M1: DL15000bp DNA Marker; M2: DL2000bp DNA Marker;1: recombinant plasmid pVAX1-FSA1; 2: The product from recombinant plasmid pET28a-FSA1 digested with EcoRⅠ+XbaⅠ图2 重组表达质粒pVAX1-FAS1的双酶切鉴定Fig 2 Double restriction enzyme digestion analysis of recombinant plasmid pVAX1-FSA1
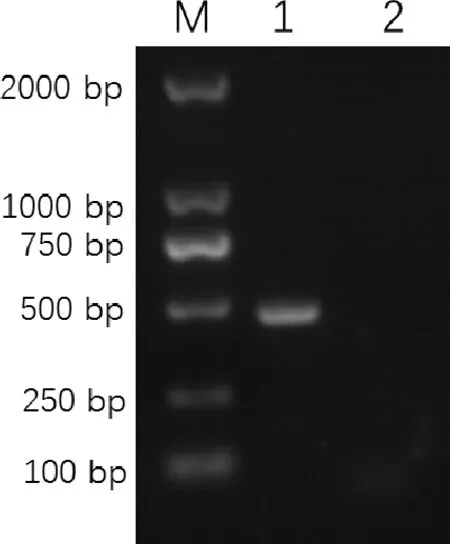
M: DL2000 DNA Marker;1:转染的BHK细胞中表达的FSA1基因;2:未转染的BHK细胞M: DL2000 DNA Marker; 1: Transfected BHK cells express the FSA1 gene;2: untransfected BHK cells图3 FSA1基因的RT-PCR鉴定Fig 3 Identification of FSA1 gene by RT-PCR
2.2共免疫疫苗的制备
2.2.1蛋白制备重组菌BL-FSA1经IPTG诱导后用SDS-PAGE检测,结果表明在37 ℃、0.1 mmol/L IPTG的条件下诱导4 h能大量表达重组蛋白rFSA1,更高浓度的IPTG并不会增加目的蛋白的表达量(图4)。

M:未预染的蛋白质分子质量标准;1:pET28a未经IPTG诱导;2:pET28a-FSA1未经IPTG诱导;3:pET28a-FSA1经0.1 mmol/L IPTG诱导;4:pET28a-FSA1经0.5 mmol/L IPTG诱导;5:pET28a-FSA1经1.0 mmol/L IPTG诱导M: Unstained protein molecular weight Marker; 1: pET28a without induction with IPTG; 2: pET28a-FSA1 without induction with IPTG;3: pET28a-FSA1 induction with IPTG at 0.1 mmol/L;4: pET28a-FSA1 induction with IPTG at 0.5 mmol/L;5: pET28a-FSA1 induction with IPTG at 1.0 mmol/L图4 FSA1基因诱导表达IPTG浓度的优化Fig 4 Determination of induction IPTG concerntration for FSA1 gene
收集裂解菌离心后的上清液和沉淀分别进行SDS-PAGE,可溶性分析表明rFSA1主要以包涵体形式存在;重组蛋白溶液通过曲拉通去除内毒素后,经鲎试剂检测内毒素含量<1.25 EU/mL;重组蛋白溶液经BCA蛋白浓度测定试剂盒测定浓度为0.5 mg/mL。
2.2.2质粒制备将按照文献[10]中方法提取的质粒通过曲拉通去内毒素后,鲎试剂检测其内毒素含量<1.25 EU/mL,质粒溶液经紫外分光光度计测定浓度为1.5 mg/mL。
2.3皮炎评分结果对各组猫每次攻跳蚤后第3天给猫进行FAD症状打分,计算丘疹、脱毛、结痂各种皮炎总分。随着各组攻跳蚤的次数增多,猫出现多处丘疹,结痂,脱毛等临床病症,引起了严重的过敏性皮炎。FAD对照组(5.5分)在第4次攻跳蚤后皮炎评分达到最高值,它与载体对照组(5.7分)和蛋白对照组(5.3分)得分接近。共免疫组第4次攻跳蚤后皮炎评分为1.9分,与FAD对照组、载体对照组和蛋白对照组相比分值明显减小(图5)。以上结果说明对照组rFSA1+pVAX1和BSA+pVAX1-FSA1对猫FAD没有影响或影响较小。而共免疫rFSA1+pVAX1-FSA1能显著抑制猫FAD,因此可以成为预防猫FAD的候选疫苗。图6为猫FAD发病的典型症状。
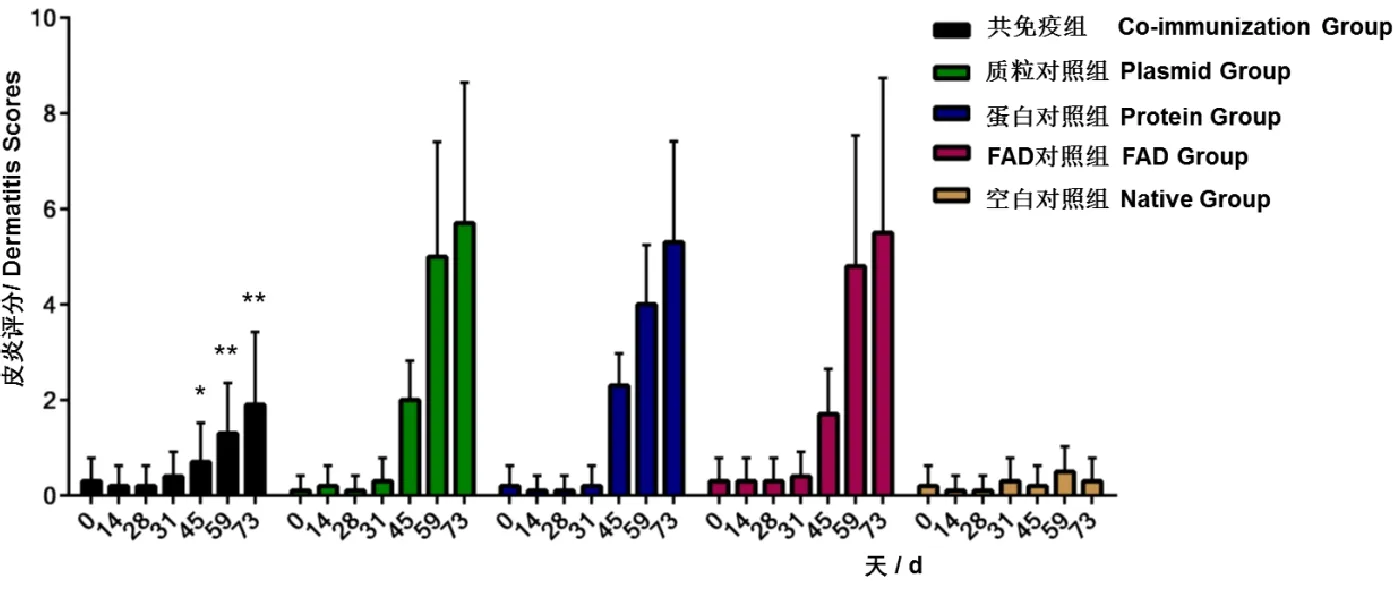
图5 各组实验猫皮炎总评分Fig 5 The total dermatology scores of five groups

图6 猫FAD的典型症状Fig 6 Typical symptoms of FAD in cats
3 讨 论
调节性T细胞是一类具有调节其他免疫细胞功能的T细胞亚群。调节性T细胞有多种免疫调节机制,其中最重要的一种是通过分泌细胞因子发挥调节作用。研究人员发现共免疫可以诱导机体产生一群CD4+CD25-Foxp3+Treg,这群iTreg具有对特异性抗原的反应性,分泌IL-10和TGF-β等抑制性细胞因子,抑制炎症T细胞[8]。靳津在治疗猫FAD的实验中进一步证明了共免疫可以减弱猫对跳蚤提取物皮试反应、减少组织中肥大细胞的聚集和抑制T细胞增殖,这与机体中过敏相关细胞因子IL-5的分泌减少,抑制性细胞因子IL-10的分泌增加有关,从而改善了跳蚤过敏性皮炎的症状[9]。除了细胞因子途径以外,Treg还可以通过细胞溶解、代谢阻断、调节树突状细胞的成熟或功能发挥抑制作用。但目前尚不清楚共免疫诱导的iTreg调节免疫抑制是否有多种机制共同作用。据此推测,利用共免疫预防保护猫FAD具有上述类似的抑制机理。
在观察猫FAD发病情况时发现,即使在相同的环境下诱导FAD,猫FAD的发病程度也会存在差异。为了说明试验中猫的发病程度,将FAD对照组皮炎评分分值划为4个档次:0分为不发病;1~3分为发病轻微;4~6分为中度发病;6~9分为严重发病。FAD对照组在攻完4轮跳蚤后有6只猫严重发病,有1只中度发病,有2只发病轻微,甚至还有1只没有任何症状,说明FAD组猫发病程度的差异较大与猫对跳蚤的敏感性存在个体差异有关,即有的猫被少量跳蚤叮咬就能引起剧烈瘙痒,产生明显的病症,但有的猫即使感染了大量跳蚤只表现出轻微病症甚至不发病。因此,人为诱导猫FAD发病是存在个体差异的,这与Wilkerson诱导犬FAD的发病程度存在差异的情况类似[11]。
攻跳蚤和皮炎评分方法首先是由Wilkerson等[11]建立并用于评价犬FAD发病程度,后来靳津等[9]将这种方法优化后用于评价共免疫对猫FAD的治疗效果。试验证明按照同样的方法能成功诱导猫FAD并进行皮炎评分,通过四轮攻跳蚤后皮炎评分达到最高值,该模型可以对共免疫预防猫FAD的效果进行客观评定。靳津通过建立猫FAD模型后,利用共免疫治疗猫FAD,皮炎评分迅速下降,取得了显著治疗效果。通过预先共免疫,再进行诱导猫FAD,皮炎评分只是略微增加,远远小于FAD对照组的皮炎评分,证明了共免疫重组蛋白rFSA1+质粒pVAX1-FSA1对猫FAD具有显著的预防保护效果。为了排除其他DNA和蛋白质组合诱导非特异性免疫抑制的可能性,试验增加了免疫rFSA1+pVAX1、BSA+pVAX1-FSA1的猫作为载体对照组和蛋白对照组,结果表明免疫非相关组合rFSA1+pVAX1、BSA+pVAX1-FSA1对猫FAD没有保护效果,只有共免疫rFSA1+pVAX1-FSA1才能对猫FAD起到保护作用,体现了该候选疫苗的特异性。然而共免疫组(1.9分)与空白对照组(0.4分)相比,仍有轻微的皮炎症状,这可能与免疫方式或免疫剂量有关。此次试验中,猫是每14 d免疫1次,共免疫2次,每次500 μg BSA+500 μg pVAX1-FSA1于腿部肌肉注射,下一步可通过改进免疫方式、免疫剂量以期得到更好的保护效果。
试验表明利用共免疫生物制剂预防跳蚤过敏性皮炎能取得较好的预防效果,具有操作方便、疗程短的优点,且无副作用,是一个安全性高、具有抗原特异性的方法,作为候选疫苗具有良好的开发应用前景,但如何提高共免疫的预防保护效果还需进一步研究。
参考文献:
[1]麻 毅, 姜志宽, 韩招久. 跳蚤的危害及防治研究进展[J]. 中华卫生杀虫药械, 2004, 10(6): 385-388.
Ma Y, Jiang Z K, Han Z J. Harm of fleas and its control develop ̄ment[J]. Chinese Journal of Hygienic Insecticides of Equipments, 2004, 10(6): 385-388.
[2]林德贵. 犬猫皮肤病[C]// 第十一届全国养犬学术研讨会论文集. 南昌:公安部南昌警犬基地. 2005.
Lin D G. Skin disease in cats and dogs[C]//Proceedings of the 11th National Kennel Symposium. Nanchang:Ministry of Public Security Nanchang Police Dog Base. 2005.
[3]早崎峰夫,王振杰. 犬过敏性皮炎的自制蚤变应原脱敏疗法[J]. 国外兽医学(畜禽疾病), 1995, 16(1): 20-23.
Zaoqi F F, Wang Z J. The desensitization therapy for home-made fleas allergen on allergic dermatitis in dogs[J]. Progress In Veterinary Medicine, 1995, 16(1): 20-23.
[4]魏 琼. 脱敏疗法的机制研究[J]. 大家健康, 2013,(17): 206.
Wei Q. The mechanism study of desensitization therapy[J]. For Our Health, 2013, (17): 206.
[5]姚金晶, 陈宜涛. Th1/Th2平衡调节与疾病发生的研究进展[J]. 生物磁学, 2009, 9(13): 2597-2600.
Yao J J, Chen Y T. Advances of regulation Th1/Th2 type cytokines balance in human diseases[J]. Biomagnetism, 2009, 9(13): 2597-2600.
[6]肖玲莉,杨 毅. Th1/Th2免疫应答失衡及其影响因素[J]. 国际儿科学杂志, 2006, 33(6): 399-402.
Xiao L L, Yang Y. The development of Th1/Th2 immune response disequilibrium and the influential factors[J]. International Journal of Pediatrics, 2006, 33(6): 399-402.
[7]程爱荣, 程 焱, 孙保亮. 调节性T细胞及其免疫抑制机制[J]. 中国临床神经科学, 2014, 22(4): 438-444.
Cheng A R, Cheng Y, Sun B L. Regulatory T cells and its mechanism of immunosuppression[J]. Chinese Journal of Clinical Neurosciences, 2014, 22(4): 438-444.
[8]Jin H, Kang Y, Zhao L,etal. Induction of adaptive T regulatory cells that suppress the allergic response by coimmunization of DNA and protein Vaccines[J]. The Journal of Immunology, 2008, 180: 5360-5372.
[9]Jin J, Ding Z, Meng F X,etal. An immunotherapeutic treatment against flea allergy dermatitis in cats by co-immunization of DNA and protein vaccines[J]. Vaccine, 2010, 28(8): 1997-2004.
[10] 谢振华, 史小军, 蔡国平. 用于哺乳动物细胞转染的高纯度质粒DNA的制备[J]. 生物技术通讯, 2007, 18(5): 803-805.
Xie Z H, Shi X J, Cai G P. The preparation of highly purified plasmid DNA for mammalian cell transfections[J]. Letters In Biotechnology, 2007, 18(5): 803-805.
[11] Wilkerson Melinda J, Bagladi-Swanson Mary, Wheeler David W,etal. The immunopathogenesis of flea allergy dermatitis in dogs, an experimental study[ J]. Veterinary Immunology and Immunopathology, 2004, 99(3/4): 179-192.

