输液泵/注射泵质量评价与分析
张克,陈甜甜,范书健,刘铮
山东省医疗器械产品质量检验中心 医用电器检验室,山东 济南 250101
引言
输液泵/注射泵作为输液辅助装置,既可以保证输注精度,又有效降低了医护人员的负担,已成为现代医院必不可少的医疗护理设备,在ICU、手术室、急救室、儿科、妇产科和肿瘤科等科室得到广泛应用[1-3]。据统计,该类产品在2012~2015年国家医疗器械不良事件监测年度报告中,连续4年可疑医疗器械不良事件报告数量在有源医疗器械中排名前三[4-7]。在国家医疗器械抽验中,抽验合格率连续多年处于较低水平。为督促企业提高产品质量,减少该类产品的不良事件数,及时发现和控制风险,2016年国家食品药品监督管理总局指定山东省医疗器械产品质量检验中心牵头承担输液泵/注射泵的监督抽验工作,以全面评价该类产品的质量及使用情况。本文根据此次国家监督抽验结果,对该类产品进行质量评价与分析,以反馈该类产品的质量现状。
1 产品简介
输液泵/注射泵可精确控制流入患者体内的液体流量,常用于精密输注某些特殊药物,主要由微机系统、泵装置、检测装置、报警系统和显示装置组成[8-10]。工作原理上,输液泵是预期通过泵产生的正压来控制流入患者体内的液体流量的设备[11],一般通过蠕动泵以波动方式连续挤压输液管路,推动管内液体向前流动[12]。注射泵以步进电机为动力,通过推动注射器的活塞,来控制注入患者体内的液体流量[13]。目前这类产品生产技术日益成熟,已逐步实现基于数字化技术的输注精度控制,采用各类传感器进行智能反馈控制,使产品的有效性和安全性得到不断提高[14-15]。但国内产品在整体技术水平和质量稳定性上,与进口产品尚有一定差距。
2 抽验概况
2.1 检验依据
根据《2016年国家医疗器械抽验(中央补助地方项目)产品检验方案》30280.输液泵/注射泵的规定,输液泵/注射泵的检验依据为注册产品标准/产品技术要求、GB9706.1-2007[16]、GB 9706.27-2005[9]和YY0709-2009[17],覆盖目前该类产品所有国内现行有效标准,共有法定检验项目19项,涉及性能和安全要求。适用的检验项目以注册产品标准/产品技术要求中的规定为判定依据,均应符合标准要求。
2.2 抽样情况
本次抽验计划抽样43批次,收到有效样品30批次,涉及9个省(市)、27家生产企业和29张注册证。抽样均在生产环节(含进口总代理单位)进行,涉及12个省(市),被抽样生产企业总覆盖率为44.3%,被抽样生产企业各省(市)覆盖情况,见图1。
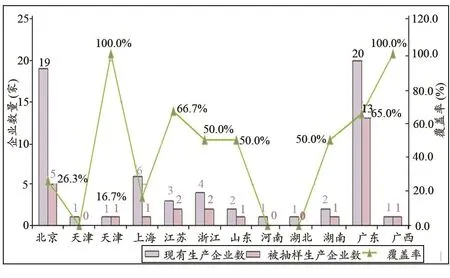
图1 被抽样生产企业各省(市)覆盖情况
2.3 检验结果
本次抽验合格样品22批次,抽验合格率为73.3%;不合格样品8批次,抽验不合格率为26.7%。法定检验项目共有19项,其中有6个检验项目出现不合格产品。GB9706.27-2005标准条款第49.2条“供电电源的中断”在总有效样品中的不合格率最高,达到20.0%;在不合格产品中的出现率最高,达到75.0%,详见表1和图2。
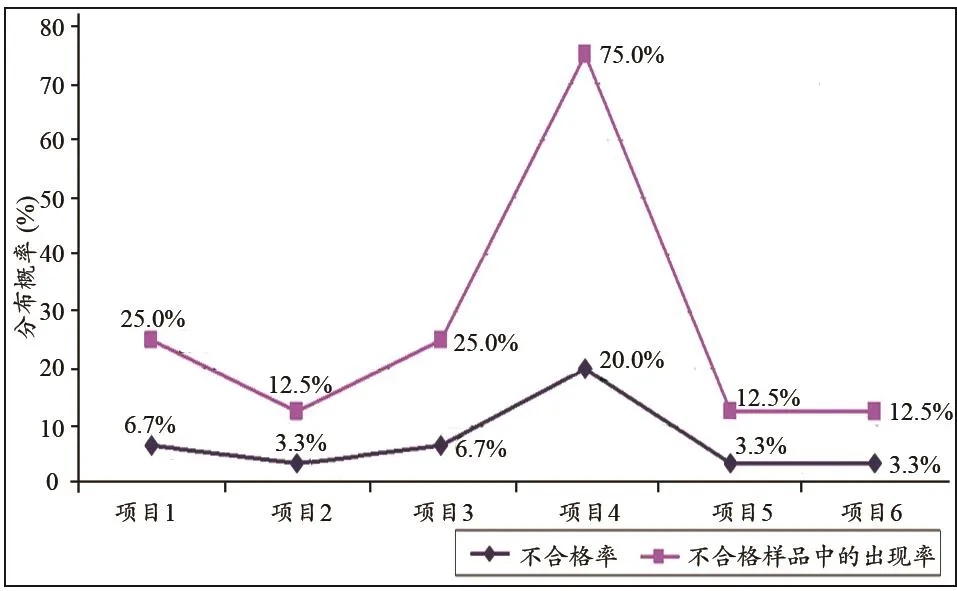
图2 不合格项目分布概况
3 不合格项目及原因分析
3.1 设备或设备部件的外部标记
该检验项目涉及2批次不合格样品,占不符合标准规定样品的25.0%。具体表现为部分样品将交流符号“~”标记为“-”,将频率单位“Hz”标记为“JHz”。外部标记的不准确或不完整,会使操作者无法得知设备的一些关键信息,误导操作者的使用,而错误使用设备的结果则会影响设备的正常安装和安全有效运行,给操作者或患者带来安全隐患。
形成原因主要是:① 企业对标准的理解掌握水平不高,混淆交直流符号;② 企业不重视产品外部标记,只当成普通的标签来看,不了解外部标记准确完整的重要性;③ 企业出厂检验走形式,属于明显印刷错误的也未发现,质量意识不强。
3.2 随机文件
该检验项目涉及1批次不合格样品,占不符合标准规定样品的12.5%。具体表现为部分样品说明书中无环境保护内容。产品说明书缺少环境保护的相关内容,将导致有关废物、残渣以及设备和附件在其使用末期不合理的处置,危害环境保护。比如主机设备中电子垃圾的不恰当处理,废旧电池的随意丢弃等,均会对环境造成污染和破坏。
形成原因主要是:① 企业对标准的理解掌握水平不高,不清楚对环境保护内容进行说明的必要性和重要性;② 企业不重视说明书等随机文件,内容不够详尽完整,只注重设备具体操作的说明,缺少环境保护内容的说明。
3.3 网电源连接器和设备电源输入插口等
该检验项目涉及2批次不合格样品,占不符合标准规定样品的25.0%。具体表现为部分样品为Ⅱ类设备,但使用了Ⅰ类设备的设备电源输入插口,且接地脚标记为保护接地或悬空未连接任何导线。设备电源输入插口如不符合标准要求,会造成电源软电线的误用,对使用带来不便,甚至对产品安全等级造成误判,给使用者或患者带来安全隐患。
形成原因主要是:① 企业不清楚功能接地与保护接地的区别,不能准确理解国家标准对电源输入插口的要求;② 不排除企业在注册检验时是符合标准要求的,但后期生产时随意更换产品配件,导致产品不符合标准要求。
3.4 供电电源的中断
该检验项目涉及6批次不合格样品,占不符合标准规定样品的比例最高,达到75.0%。具体表现为部分使用内部电池作为备用供电的样品,在由于电池耗尽而导致的输液停止之前,发出可听和可视报警的时间不足30 min;部分样品在电池电量耗尽前,设备未停止输液,保持输液状态直至自动关机。设备发出的可听和可视报警时间小于标准要求,医护人员无法及时响应并进行处理,危害患者的输液安全,造成治疗延误或中断。而电池临耗尽时不停止输液,设备因电量不足可能工作状态不稳定,无法保证输液精度,同样会对患者造成输液危害。
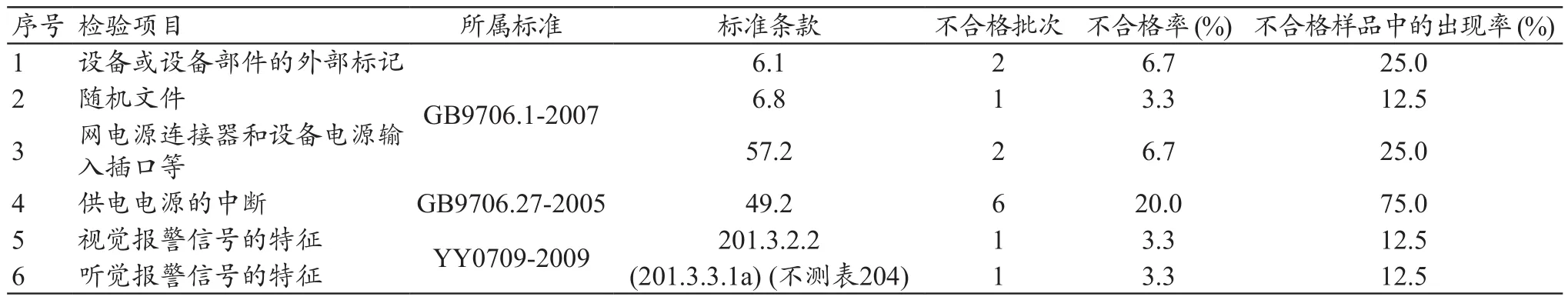
表1 输液泵/注射泵不合格项目表
形成原因主要是:① 企业不能准确理解国家标准对供电电源中断的要求,造成样品的断电工作时间较长,但在报警时间及报警动作上达不到标准要求的现象;② 不排除企业在注册检验时是符合标准要求的,但后期生产时更换内部电源,更改了报警设计,导致产品不符合标准要求。
3.5 视觉和听觉报警信号的特征
视觉报警信号特征和听觉报警信号特征涉及1批次不合格样品,各占不符合标准规定样品的12.5%。具体表现为部分样品低优先级报警指示灯闪烁频率和占空比不符合标准要求,高优先级报警信号的脉冲间隔,低优先级报警信号的脉冲群间期不符合标准要求。低优先级视觉报警信号不符合标准要求,且与标准规定的中优先级视觉报警信号的特征发生混淆;高优先级听觉报警信号的脉冲间隔过长,降低了声音紧急程度,而低优先级听觉报警信号完全不符合标准要求。这都将导致无法准确地向操作者指示报警状态紧急程度,造成医护人员的误判,延误对报警的及时响应,给患者带来安全风险。另外,在多医疗设备环境中,当同时有多个报警信号出现时,医护人员不能准确判定首先需要对哪台设备作出响应并采取措施,无法保证患者安全。
形成原因主要是:① 企业不能准确理解报警状态不同优先级的含义,造成说明书公布的报警状态优先级与产品实际设计不符;② 企业缺乏研发技术人员,将报警系统的软件设计交由他方完成,而自己又缺乏对报警系统的自检能力,导致产品不符合标准要求。
4 探索性研究
探索性研究主要分为两个方面,一是针对未执行YY0709-2009的10批次产品进行涉及该标准的法定检验项目的检验,研究这些产品的报警系统对该标准的符合性;二是针对“丸剂量和阻塞的防止”这一非法定检验项目进行检验,研究输液泵类产品在这一项目上的质量状况,为以后该类产品的抽验项目设计提供思路。
4.1 视觉和听觉报警信号的特征
经过检验,发现只有2批次符合标准要求,另外8批次样品的报警系统均未按YY0709-2009的要求进行设计,主要表现为报警指示灯特性(颜色、闪烁频率和占空比)不合格,听觉报警信号仅为缓慢或急促的单一重复声。造成的主要危害是在有报警信号产生时,不容易分辨该报警信号来自于哪台设备,以及该报警信号的优先级和紧急程度如何,不利于医护人员作出快速和准确的反应。
4.2 丸剂量和阻塞的防止
依据GB9706.27-2005中51.101b),对所有30批次样品进行检验,合格率仅为33.3%,整体质量不高,存在安全隐患。具体表现为:① 部分样品说明书未按GB 9706.27-2005中6.8.2a)9)至6.8.2a)12)的要求公布相关参数;② 阻塞报警失效或阻塞报警阈值(压力)不符合制造商规定的值,可能导致输液压力过大,引起输注管路破裂或泄漏,影响设备正常使用,带来安全方面危险;③ 触发阻塞报警所需时间超出制造商规定的值,可能造成欠流即给液不足,而制造商公布值影响医护人员的判断,不能及时发现阻塞现象,导致输液停止,治疗中断,危害患者生命安全;④产生的丸剂量超出制造商规定的数值,可能导致阻塞缓解后患者药物输注过量,超出安全治疗范围,产生毒副作用,危害患者生命安全。
4.3 问题分析
通过探索性研究,发现存在以下问题:① 部分生产企业不主动跟踪新标准发布实施动态,不重视或不了解YY0709-2009,导致该标准未引用;② 丸剂量和阻塞的防止的影响因素较多:环境条件,输注管路长度、粗细和弹性特征,所用注射器规格等都对试验结果有一定的影响,但制造商在说明书中公布相关参数时考虑不全面,造成公布值不合理,比如阻塞报警阈值(压力)公布一个定值而不是范围,阻塞触发所需时间和阻塞产生的丸剂量未公布可能的最大值;③ 企业不重视标准,对标准研究不透彻,说明书未能正确按照标准要求公布相关参数,存在说明书未公布或公布不全、信息混乱现象;④ 企业质量意识不强,缺乏有效质检设备及人员,自检能力不足,导致无法及时发现产品质量问题,比如阻塞报警阈值(压力)未做好出厂校准。
5 总结
近年来我国医疗机构对输液泵/注射泵产品的需求逐渐增大,与国外同类产品的普及程度相比市场潜力巨大,给这类产品带来了较大的发展机遇。而国内生产厂家数量较多,规模与质量参差不齐,且产品同质化现象较重,市场竞争将会越来越激烈。通过对2016年国家医疗器械抽验结果进行统计、分析及探讨,结合法定检验和探索研究,对该类产品的质量现状作出评价分析。针对本次抽验发现的问题,建议生产企业应:① 加强标准学习。平时主动跟踪新标准发布实施动态,通过参加标准宣贯实施培训会或内部学习研讨,提高对标准的理解和掌握水平;② 重视外部标记、说明书和产品外包装。对照标准要求,做到内容详尽完整,信息准确;③ 增强质量意识。严格执行医疗器械生产质量管理规范,按照标准组织生产,提高自检能力,把好出厂检验关;④ 严格遵守医疗器械注册相关法规,增强生产工艺稳定性,不随意更换产品配件。
[参考文献]
[1] 张朋,王殊轶,余传意,等.输液泵/注射泵的发展趋势研究[J].中国医疗器械杂志,2009,33(4):282-285.
[2] 李宁,陈涛.输液泵工作数据准确性处理的方法分析[J].中国医疗器械信息,2011,12(1):23-25.
[3] 柏正璐,张华伟,蒋红兵.多功能微量注药泵与微量输液泵的流速精度对比与探讨[J].中国医疗设备,2016,31(7):115-118.[4] 国家食品药品监督管理局.2012年医疗器械不良事件监测年度报告[EB/OL].(2013-04-03)[2017-07-03].http://www.sfda.gov.cn/WS01/CL0051/79538.html.
[5] 国家食品药品监督管理局.国家医疗器械不良事件监测年度报告(2013年度)[EB/OL].(2014-05-07)[2017-07-03].http://www.sfda.gov.cn/WS01/CL0438/99420.html.
[6] 国家食品药品监督管理局.国家医疗器械不良事件监测年度报告(2014年度)[EB/OL].(2015-07-20)[2017-07-03].http://www.sfda.gov.cn/WS01/CL0438/124546.html.
[7] 国家食品药品监督管理局.国家医疗器械不良事件监测年度报告(2015年度)[EB/OL].(2016-05-27)[2017-07-03].http://www.sfda.gov.cn/WS01/CL0438/154081.html.
[8] 郝霞莉,王冬梅.影响输液泵使用安全的因素分析与对策[J].中国医学装备,2012,9(9):40-42.
[9] 周泉志,邹庆辉,陆建雄,等.输液泵及注射泵质量控制管理方案探究[J].中国医疗设备,2015,30(10):140-142.
[10] 邓振进.输液泵流速准确性检测方法的探讨[J].中国医疗设备,2015,30(4):110-111.
[11] GB9706.27-2005,医用电气设备 第2-24部分:输液泵和输液控制器安全专用要求[S].
[12] 李静.输液泵性能检测的流速检测[J].医疗装备,2017,30(1):37-38.
[13] 谷中慧,王宣,高鹏,等.注射泵计量质量控制中常见问题分析及解决方法[J].中国医学装备,2016,13(7):110-111.
[14] 刘昕昕.医用注射泵质量控制与分析[J].医疗装备,2017,30(3):76-77.
[15] 罗竫娜,韩宇枫,韩伟,等.从典型个案讨论注射泵质量风险源控制[J].中国医疗设备,2015,30(2):117-119.
[16] GB9706.1-2007,医用电气设备 第1部分:安全通用要求[S].
[17] YY0709-2009,医用电气设备 第1-8部分:安全通用要求 并列标准: 通用要求, 医用电气设备和医用电气系统中报警系统的测试和指南[S].

