8省市鸡肉源性大肠杆菌分离鉴定及其耐药性检测
,,, ,聪明,,,,
大肠杆菌(Escherichiacoli)是食品中重要的卫生指标菌[1],普遍存在于人和动物的肠道中,是人和动物肠道的共栖菌和条件致病菌[2]。一般不致病,但在某些毒力因子的影响下,对人和动物有致病性,常引起严重的腹泻和败血症[3-4]。其中,五类致泻性大肠埃希菌(包括肠产毒性大肠埃希菌ETEC,肠致病性大肠埃希菌EPEC,肠侵袭性大肠埃希菌EIEC,肠出血性大肠埃希菌EHEC和肠集聚性大肠埃希菌EIEC)是引起人类腹泻的重要病原菌,给发展中国家造成重大的公共卫生负担[5]。大肠杆菌易产生耐药性,由于在养鸡过程中大量、不合理地使用抗菌药物,导致大肠杆菌耐药菌株不断出现,许多敏感药物变为耐药,其耐药谱不断增大,并且已经证实耐药菌株是可以通过食品在动物与人类之间进行转移[6],质粒、转座子、整合子等可移动元件将耐药基因转移到人类肠道中的其他共栖菌群或者致病菌中[7],这将会对公共健康构成巨大的威胁。
特对我国8个省份零售鸡肉中的大肠杆菌进行耐药性检测,旨在评估禽肉源大肠杆菌耐药性和多重耐药性的流行趋势,以期为养殖业抗菌药物的合理使用提供科学依据。
1 材料与方法
1.1主要试剂及菌株来源蛋白胨缓冲液(BPW)、伊红美兰琼脂(EMB)、麦康凯琼脂(MacConkey Agar)、乳糖胆盐发酵培养基、LB琼脂培养基、LB肉汤培养基、MH琼脂、IMViC试验试剂,均购自北京陆桥技术有限责任公司;抗生素,购自Sigma公司;Taq酶、Buffer(Mg2+)、dNTP,购自大连宝生物(TaKaRa)公司;引物由上海生工生物工程技术服务有限公司合成;标准菌株大肠埃希菌ATCC25922由本实验室保存。
1.2样品采集从2010年3月至11月分别自陕西(西安、宝鸡和渭南)、河南(郑州、新乡和洛阳)、四川(成都、眉山和邛崃)、北京(海淀区、朝阳区和顺义区)、上海(浦东区、浦东新区和长宁区)、广东(广州、深圳和中山)、广西(南宁、玉林和柳州)和福建(福州、厦门和泉州)的各大超市和农贸市场随机采集鸡肉样品。其中,每个省选择3个城市(1个省会城市和两个非省会城市)进行样品采集。直辖市选择3个区进行样品采集。在每个城市或区,从4个大超市(面积大于14 000 m2)、4个小超市(面积小于14 000 m2)和4个农贸市场采集样品。在大超市或小超市,购买产自家禽公司并冷藏(4 ℃~10 ℃)或(-10 ℃~-20 ℃)冷冻的鸡肉。农贸市场是开放的食品市场,包括肉铺、活禽店和鱼店,以及售卖水果的摊位。在活禽店,家禽被屠宰后,在被卖出之前不用被冷藏。每个市场采集4个样品,这样每个省或者直辖市共计采样114个整鸡肉样品。从陕西省、河南省和广西省采集的鸡肉样品通过冰袋直接运往西北农林科技大学实验室,在14h内进行大肠杆菌分离鉴定。其它省或直辖市采集的鸡肉样品直接在当地的疾病预防控制中心或大学的实验室用灭菌400 mL BPW肉汤对整鸡酮体进行冲淋,冲淋的BPW肉汤通过冰袋直接运往西北农林科技大学实验室,在14h内进行大肠杆菌分离鉴定。
1.3菌株的分离鉴定参照只帅[7]等人对大肠杆菌的分离纯化方法:整鸡酮体用400 mL BPW洗涤并充分振荡,置于37 ℃、120 r/min摇床中复活;4h后取5 mL上述复活液到含50mL双料EC肉汤的锥形瓶中,42 ℃摇床培养24 h。将增菌液划线于EMB平板,37 ℃培养24 h。选取 EMB 平板上紫黑色带金属光泽的单菌落,划线于LB平板上进行纯化。对疑似菌株进行IMViC 试验,结果++--者认定为大肠杆菌。采用PCR扩增uidA基因对分离菌株进行大肠杆菌确认。DNA模板通过煮沸法获得,所用引物序列见表1。PCR反应体系为25 μL:DNA模板2 μL,10×PCR buffer 2.5 μL,MgCI22.5 μL,dNTP 1 μL,TaqDNA聚合酶0.25 μL,引物各0.5 μL(25 pmol)。PCR反应条件:94 ℃ 10 min;94 ℃30 s,58 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃延伸10 min。每个阳性样本中,挑取一个菌落保存,-80 ℃保存备用。
表1PCR 引物序列
Tab.1Sequences of PCR primers

基因Gene引物名称Primer引物序列(5′⁃3′)Primersequence(5′⁃3′)扩增片段/bpProductsize/bpuidAuidA1CGATTCCGTTTC⁃AGGGTT194uidA2TTTCTGATAGGA⁃CCGAGCAT
1.4药敏性测定方法采用NCCLS[8](美国临床实验室标准化委员会,National Committee of Clinical Laboratory Standard)推荐的琼脂扩散法测定760株鸡肉源大肠杆菌对15种常用抗菌类药物的敏感性。具体操作:1)抗生素母液的配制:用无菌水或适当的缓冲液将每种抗生素配成质量浓度为 5120 μg/mL的贮存液,分装于无菌EP管置于-20 ℃冰箱中保存备用;2)含抗菌药物琼脂平板的制备:向已冷却至50 ℃的无菌MH固体培养基中加入一定浓度的抗生素(见表2),并用磁力搅拌器迅速混合均匀后倒平板,配成不同质量浓度的抗生素平板;3)药敏试验:用无菌棉签取过夜菌株培养物于0.85%的生理盐水中,调节菌液浊度为0.30~0.35,菌液浓度为107CFU/mL;采用100倍稀释法稀释菌液浓度至105CFU/mL,在漩涡振荡器上震荡使稀释液混合均匀;用微量移液器分别取80 μL稀释后菌悬液于模具点样孔中,做好起始标记并准确记录样品在模具点样孔上的排列顺序;用接种器小心蘸取菌液并接种于已经做好起始标记的MH药敏平板上,同一抗生素接种顺序由低浓度到高浓度,于37 ℃恒温条件下培养18~22 h,观察生长情况并做记录;每次试验前用标准菌株大肠埃希菌ATCC25922进行质控。
表2药敏测定用抗生素及耐药折点
Tab.2Antibiotics and breakpoints of drug-resistant

抗生素Antibiotic耐药(μg/mL)Resistance敏感(μg/mL)Susceptible萘啶酮酸(NAL)≥32≤8环丙沙星(CIP)≥4≤1加替沙星(GAT)≥8≤2氨苄西林(AMP)≥32≤8阿莫西林-克拉维酸(A/C)≥32/16≤8/4阿莫西林(AMO)≥32≤8链霉素(STR)≥8≤4卡那霉素(KAN)≥25≤6庆大霉素(GEN)≥8≤4阿米卡星(AMK)≥32≤16头孢西丁(FOX)≥32≤8头孢哌酮(CFP)≥64≤16甲氨苄啶-新诺明(T/S)≥4/76≤2/38四环素(TET)≥16≤4氯霉素(CHL)≥32≤8
2 结 果
2.1鸡肉源大肠杆菌的污染情况如表3所示,鸡肉源大肠杆菌的总分离率为65.97%(760/1152)。其中,来自上海(90.28%,130/144)、北京(86.80%,125/144)和河南(78.47%,113/144)的样品大肠杆菌分离率相对较高;其次为陕西(65.28%,94/144)、广东(64.58%,93/144)、广西(56.94%,82/144);而来自四川(45.83%,66/144)和福建(39.58%,57/144)的样品大肠杆菌分离率较低。
表3大肠杆菌样品数及分离菌株
Tab.3Information on the number of Escherichia coli isolates
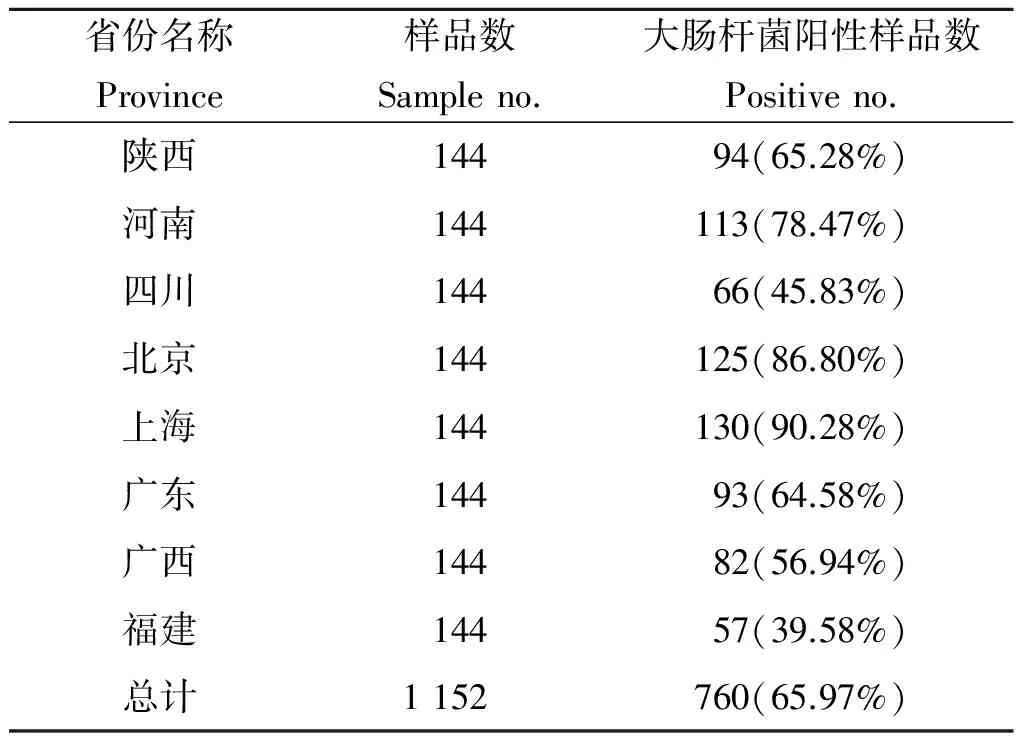
省份名称Province样品数Sampleno.大肠杆菌阳性样品数Positiveno.陕西14494(65.28%)河南144113(78.47%)四川14466(45.83%)北京144125(86.80%)上海144130(90.28%)广东14493(64.58%)广西14482(56.94%)福建14457(39.58%)总计1152760(65.97%)
2.2鸡肉源大肠杆菌对15种常见抗生素的耐药情况
2.2.1菌株的耐药率本研究分离的760株鸡肉源大肠杆菌对15种常见抗生素呈现不同程度的耐药,其耐药率介于9.74%~66.84%,见表4。其中,对萘啶酮酸的抗性最高(66.84%);其次为阿莫西林一克拉维酸(66.05%)、四环素(65.00%)、甲氧苄啶-新诺明(63.16%)、氨苄西林(60.66%)、阿莫西林(51.32%)、链霉素(50.39%)、氯霉素(48.42%)、卡那霉素(38.29%)、庆大霉素(26.31%)、环丙沙星(25.79%)、头孢西丁(21.05%);而对加替沙星、头孢哌酮和阿米卡星的抗性较弱,其耐药率均低于20%。
2.2.2菌株的多重耐药性试验结果表明760株鸡肉源大肠杆菌分离株耐药情况较为严重,大多数菌株耐3~10种药(536株,70.53%),最高可对14种抗生素耐药(3株,0.39%),而没有发现对15种抗生素都耐的菌株。其中,对8种抗生素耐药的菌株最多,有78株(10.26%),其次为9耐(76株,10.00%),7耐(72株,9.47%),10耐(68株,8.95%),4耐(62株,8.16%),5耐(62株,8.16%),6耐(62株,8.16%),3耐(56株,7.37%),11耐(38株,5.00%),12耐(19株,2.50%),13耐(10株,1.32%)。多重耐药测定结果见图1。

图1 760株鸡肉源大肠杆菌的多重耐药Fig.1 Multidrug resistance of 760 E. coli isolates from chicken
2.3不同地区分离株耐药性比较8省鸡肉源大肠杆菌的耐药性比较见表5。整体上看来,其耐药模式基本相似,对萘啶酮酸、甲氧苄啶-新诺明、四环素、氨苄西林、阿莫西林-克拉维酸普遍呈现较高的耐药性,而对加替沙星、头孢哌酮和阿米卡星的耐药性相对较低。但值得注意的是,不同地区分离的菌株对抗生素的耐药率也有所差异,例如,北京、上海、河南的分离菌株耐药率相对偏高。
表4760株鸡肉源大肠杆菌对15种抗生素的耐药率
Tab.4Antibiotic resistant rate of 760 E. coli isolates from chicken

药物种类Typesofdrugs抗生素Antibiotic耐药菌株数No.ofisolates耐药率/%Percentageofresistance喹诺酮类萘啶酮酸(NAL)50866.84环丙沙星(CIP)19625.79加替沙星(GAT)8511.18青霉素类氨苄西林(AMP)46160.66阿莫西林-克拉维酸(A/C)50266.05阿莫西林(AMO)39051.32氨基糖苷类链霉素(STR)38350.39卡那霉素(KAN)29138.29庆大霉素(GEN)20026.31阿卡米星(AMK)749.74头孢菌素类头孢西丁(FOX)16021.05头孢哌酮(CFP)8411.05磺胺类甲氨苄啶-新诺明(T/S)48063.16四环素类四环素(TET)49465.00氯霉素类氯霉素(CHL)36848.42
表5不同地区大肠杆菌的耐药率
Tab.5Drug resistant rate of E. coli isolates different areas

抗生素Antibiotic耐药率(%)Percentageofresistance(%)陕西河南四川北京上海广东福建广西萘啶酮酸(NAL)71.2875.2257.5875.2075.3852.6943.9071.93环丙沙星(CIP)22.3431.869.0937.6030.0010.757.3254.39加替沙星(GAT)9.572.651.5212.0010.7722.583.6633.33氨苄西林(AMP)62.7770.8042.4289.6075.38057.3264.91阿莫西林-克拉维酸(A/C)65.9676.9957.5878.4083.8562.3757.325.26阿莫西林(AMO)52.1361.0636.3658.4069.2350.5441.467.01链霉素(STR)58.5159.2930.3068.8057.6930.1131.7045.61卡那霉素(KAN)37.2345.1327.2752.8033.0826.8828.0552.63庆大霉素(GEN)18.0927.4313.6448.8024.6225.818.5433.33阿卡米星(AMK)9.5714.163.0320.0010.762.153.665.26头孢西丁(FOX)1.0613.2712.1269.6019.237.5319.511.75头孢哌酮(CFP)017.704.5524.0017.697.531.220甲氨苄啶-新诺明(T/S)65.9674.3463.6357.6064.6159.1439.0285.96四环素(TET)86.1792.0469.704.8080.7760.2254.8889.47氯霉素(CHL)40.4342.4839.3984.0054.6234.4121.9552.63
3 讨 论
本研究从陕西、河南、四川、北京、上海、广东、广西和福建的各大超市和农贸市场随机采集1 152份鸡肉样品,其分离率为65.97%,这与2013年王冠玉等[9]从采自贵州省5个地区县级市的1 180份样品,其分离率为70.89%的结果基本一致。其中,来自上海[90.28%(130/144)]、北京[86.80%(125/144)]和河南[78.47%(113/144)]的样品大肠杆菌分离率相对较高。特别在超市的鸡肉,较多是没有包装的冷冻鸡,由于北京、上海和河南的人口相对集中,超市内的人流量较大,国内很多消费者挑选鸡肉时,用手翻动鸡肉习惯,使鸡肉交叉污染的概率相对较高,这可能是增加了大肠杆菌污染率较高的原因之一。
从总体上看,本研究分离的760株鸡肉源大肠杆菌对喹诺酮类中的萘啶酮酸、磺胺类、四环素以及青霉素类中的氨苄西林、阿莫西林等一直被推荐治疗大肠杆菌的抗生素产生了较强的抗性,其耐药率均达到60%以上,这与宋立等[10]检测中国不同地区家禽大肠杆菌耐药性结果相似,上述药物耐药率达到56%以上,接近代鹏飞等[11]对四川地区动物源性大肠杆菌耐药性的检测结果(耐药率接近或超过70%)。表明随着时间推移,一些由于价格低廉,抗菌谱广而被养殖户长期大量投入使用的抗菌药物已逐渐失去对大部分大肠杆菌分离株的防治作用。其中,喹诺酮类抗生素是临床常用药物。据报道,在过去20年里大肠杆菌对喹诺酮类抗生素耐药率迅速上升[12]。本调查分离的大肠杆菌对喹诺酮类抗生素中的萘啶酮酸和环丙沙星的耐药率分别为66.84%和25.79%,与只帅等[7]对陕西地区食源性大肠杆菌的检测结果相似(62.6%和39.2%),但大于Van等[13](34.3%和16.2%)和Petar Knezevic等[14](33.9%和7.0%)对食源性大肠杆菌的检测结果,提示在我国养殖业中,存在喹诺酮类抗生素长期滥用的现象。青霉素类抗生素也是临床使用较为有效的抗菌药物,其作用机制是破坏细菌的细胞壁并在细菌细胞繁殖期起杀菌作用[15]。本调查中使用了3种青霉素类抗生素,分离菌株对它们的耐药范围在51.32~66.05%。该结果高于K. Immaculate jeyasanta等报道的食源性大肠杆菌对氨苄西林(34.06%)和阿莫西林-克拉维酸(47.25%)的耐药率,但低于毛福超等报道的禽源性大肠杆菌对氨苄西林(81.63%)和阿莫西林 (67.34%)的耐药率,这可能与地区、菌株来源及处理方法不同有关[16-17]。磺胺类药物甲氧苄啶-新诺明通过使细菌的叶酸合成代谢受到阻断达到抑菌目的[15],四环素类药物主要是阻止氨酰基与核糖核蛋白体的结合,阻止肽链的增长和蛋白质的合成,从而抑制细菌的生长。在中国其他学者的报道中,食源性大肠杆菌对这两类药物均表现出非常严重的耐药性[18-20]。分离株对较少使用的加替沙星、头孢哌酮和阿米卡星的抗性较弱,其耐药率均低于20%,与当前的研究报道一致[21]。以上结果说明鸡肉源大肠杆菌的耐药性与人常用药(如喹诺酮类、青霉素类等)存在较多重叠,存在通过食物链传播给人的风险,应引起有关部门的重视,提前做好预防工作控制其耐药性大范围的传播。
760株鸡肉源大肠杆菌中,多数表现为多重耐药,这与中国其它地区有关报道结果一致[22-25]。多重耐药菌株的出现与抗生素不合理、不规范的使用有关,因此,应禁止在饲养过程中滥用抗生素,同时要注意科学合理用药,在抗菌药物的选择上应考虑联合用药、交叉用药、轮换用药,建立健全大肠杆菌耐药性监测系统。
此外,本试验结果发现大肠杆菌的耐药性呈现一定的区域性。不同地区对抗生素耐药率有所差异,其中北京、上海和河南菌株耐药率相对偏高。这可能是因为不同地区在预防和治疗相关疾病时,所使用抗菌药物的强度和频率存在差异。对北京、上海和河南等人口密集的地区,可能需要相对来说更为集中的饲养和加工规模来满足其食物需求,因此使用抗菌药物的强度和频率有所提高,从而导致鸡肉源大肠杆菌分离株的耐药率也有所提高[26]。
本试验对8省鸡肉源大肠杆菌的耐药性进行检测与比较,有利于监控不同地区鸡肉源大肠杆菌耐药性流行趋势,并为各地区对抗生素的规范使用,以减缓细菌耐药性的扩散和传播具有重要的指导意义。
4 结 论
抗生素的耐药性已成为全球最紧迫的公共卫生问题之一,并且这一问题仍随着抗生素的过度使用而日益加剧[27]。由于养殖场和兽医临床大量使用抗生素,大肠杆菌耐药谱逐渐扩大,耐药率逐渐上升,原本对大肠杆菌病治疗有效的抗菌药物疗效明显下降甚至丧失[28]。本次调查结果表明,8省鸡肉源大肠杆菌的耐药现象比较严重,对萘啶酮酸、青霉素类、四环素类、磺胺类药物的抗性最强,耐药率均在60%以上。多重耐药类型以8耐最多,7耐、9耐和10耐次之。北京、上海和河南地区的鸡肉源大肠杆菌耐药性高于其他地区。由此,各地区相关部门应加大对抗生素使用的监管力度,促使相关养鸡企业合理、规范地使用抗生素,以避免细菌耐药性从食物链进入到人体中,保障公众健康。
参考文献:
[1] Altalhi AD, Hassan SA. Bacterial quality of raw milk investigated byEscherichiacoliand isolates analysis for specific virulence-gene markers[J]. Food Control, 2009, 20(10): 913-917. DOI: 10.1016/j.foodcont.2009.01.005
[2] Duffy G, Lynch OA, Cagney C. Tracking emerging zoonotic pathogens from farm to fork[J]. Meat Sci, 2008, 78(1/2): 34-42. DOI: 10.1016/j.meatsci.2007.05.023
[3] Badura A, Luxner J, Feierl G, et al. Prevalence, antibiotic resistance patterns and molecular characterization ofEscherichiacolifromAustriansandpits[J]. Environmental Pollution, 2014, 194(7): 24-30. DOI:10.1016/j.envpol.2014.07.007
[4] 徐剑. 禽源大肠杆菌的分离及药敏试验[J]. 中国畜牧兽医文摘, 2013, 29(3): 52-53.
[5] Zhao AL, Xiong YW, Bai XM, et al. Multiplex PCR for identification of diarrheogenicEscherichiacoliand Shigella spp [J]. Dis Surveill, 2011, 26(1):65-67. DOI:10.3784/j.issn.1003-9961.2001.01.020. (in Chinese)
赵爱兰, 熊衍文, 白雪梅,等. 鉴定五类致泻性大肠埃希菌和志贺菌的多重PCR方法[J]. 疾病监测, 2011, 26(1):65-67.
[6] Bennett PM. Plasmid encoded antibiotic resistance: Acquisition and transfer of antibiotic resistance genes in bacteria[J]. British J Pharmacol, 2009, 153(S1): 347-357. DOI: 10.1038/sj.bjp.0707607
[7] 只帅, 席美丽, 刘攻关, 等. 陕西部分地区不同食源性大肠杆菌耐药性检测[J]. 中国食品学报, 2011, 11(1): 196-201. DOI:10.16429/j.1009-7848.2011.01.029.
[8] Nccls. Performance standards for antimicrobial disk and dilution susceptibility tests for bacteria isolated from animals, approved standard. 2nd. Wayne, Pa: National Committee for Clinical Laboratory Standards, 2003[S].
[9] Wang GY, Tan AJ, Lv SM, et al. Identification, isolation and antibiotic resistance ofE.colifrom poultry in Guizhou [J]. Tianjin Agr Sci, 2013, 19(2):26-28. DOI :10.3969/j.issn.1006 6500.2013.02.00. (in Chinese)
王冠玉, 谭艾娟, 吕世明,等. 贵州鸡源大肠杆菌的分离鉴定及耐药性测定[J]. 天津农业科学, 2013, 19(2):26-28.
[10] Song L, Ning YB, Zhang XY, et al. Comparative research on serotype distribution and antimicrobial resistance ofEscherichiacoliisolates from poultry in different areas of China [J]. Scientia Agricultura Sinica, 2005, 38(7): 1466-1473. DOI:10.3321/j.issn:0578-1752.2005.07.029. (in Chinese)
宋立, 宁宜宝, 张秀英, 等. 中国不同地区家禽大肠杆菌血清型分布和耐药性比较研究[J]. 中国农业科学, 2005, 38(7): 1466-1473.
[11] Dai PF, Shu G, Lin JC, et al. Surveillance of resistance, β-lactamase-producing and serotypes ofE.coliisolates from animals in Sichuan Province, China [J].Chin J Zoono, 2016, 32(4): 412-416. DOI:10.3969/j.issn.1002-2694 2016.04.018.(in Chinese)
代鹏飞, 舒刚, 林居纯,等. 四川动物源大肠杆菌耐药性、产β-内酰胺酶及血清型的检测[J]. 中国人兽共患病学报, 2016, 32(4):412-416.
[12] Pan WJ, Chen X, Wang XG, et al. The analysis of quinolone resistance of the avianEscherichiacoliand Salmonella isolates from 1993 to 2008 [J].Chin J of Zoono, 2009, 25(7): 630-635. (in Chinese)
潘渭涓, 陈祥, 王晓泉,等. 1993-2008年禽源大肠杆菌和沙门菌对喹诺酮类药物耐药性分析[J]. 中国人兽共患病学报, 2009, 25(7):630-635.
[13] Van TT, Moutafis G, Tran LT, et al. Antibiotic resistance in foodborne bacterial contaminants in Vietnam [J]. Appl Envir Microbiol,2007, 73(24):7906-7911.
[14] Knezevic P, Petrovic O. Antibiotic resistance of commensalEscherichiacoli, of food-producing animals from three Vojvodinian farms, Serbia[J]. Int J Antimicrob Agents, 2008, 31(4):360-3. DOI:10.1016/j.ijantimicag.2007.10.020
[15] Wang Y, Wang YN, Yi L, et al. Drug resistance ofEscherichiacolifrom chicken [J]. Guangdong Agr Sci, 2011,58(2):124-125. DOI:10.16768/j.issn.1004-874x.2011.02.058 (in Chinese)
汪洋,王育娜,易力,等. 洛阳地区鸡源大肠杆菌的耐药性研究[J]. 广东农业科学,2011,58(2):124-125.
[16] Immaculate K,Aiyamperumal V,Patterson J. Prevalence of antibiotic resistantEscherichiacoliin sea foods of tuticorin coast, southeastern India [J]. Adv Biological Res, 2012, 6 (2): 70-77. DOI: 10.5829/idosi.abr.2012.6.2.6475
[17] Mao FC, Yu C, Han L, et al. Isolation, identification and drug resistance analysis ofEscherichiacolifrom chickens in Western Henan Province [J]. J Henan Agr Sci, 2016, 45(1): 127-130. DOI:10.15933/j.cnki.1004-3268.2016.01.028 (in Chinese)
毛福超, 郁川, 韩璐, 等. 豫西地区禽源大肠杆菌的分离鉴定与耐药性分析[J]. 河南农业科学, 2016, 45(1): 127-130.
[18] 岳秀英, 葛荣, 吴晓岚,等. 四川省猪、鸡源大肠杆菌对抗生素耐药性研究[J]. 中国兽医杂志, 2017,53(1):93-95.
[19] Gai WY,Wang J, Qu ZN, et al. Molecular classification and drug resistance analysis ofEscherichiacoliin Shandong Province[J]. Chin J Food Hyg, 2015, 27(2):109-114.DOI: 10. 13590 / j.cjfh.2015. 02. 003 (in Chinese)
盖文燕, 王娟, 曲志娜,等. 山东地区大肠杆菌的耐药性及分子分型研究[J]. 中国食品卫生杂志, 2015, 27(2):109-114.
[20] 刘艳红, 吕淑霞, 李颖,等. 大肠杆菌耐药性及氟苯尼考耐药基因floR的研究[J]. 中国畜牧杂志, 2017, 53(1):115-118. DOl:10.19556/j.0258-7033.2017-01-001
[21] 黄迪海, 秦春芝,盛晓丹, 等. 禽源大肠杆菌的分离鉴定及耐药性检测[J]. 山东畜牧兽医, 2015, 36(11): 11-12. DOI:10.3969/j.issn.1007-1733.2015.11.005.
[22] Zhao XS, Sun Y, Ji X, et al. Antibiotic resistance ofEscherichiacoliisolated from dogs [J]. Chin J Zoono, 2014, 30(3):268-272. DOI: 10.3969/cjz. J.issn .1002-2694.2014.0.010 (in Chinese)
赵相胜, 孙洋, 纪雪,等. 犬源大肠杆菌分离鉴定及耐药性分析[J]. 中国人兽共患病学报, 2014, 30(3):268-272.
[23] Li YR, Chen LG, Hu F, et al. Resistance detection and analysis of plasmid replicon typing of pathogenicEscherichiacoliisolates from chicks in Hebei [J]. J Agr Univ Hebei, 2015, 38(4):103-107. DOl:10.13320/j.cnki.jauh.2015.0093
李玉荣, 陈立功, 胡凡,等. 鸡源大肠杆菌河北分离株耐药性与质粒不相容群分析[J]. 河北农业大学学报, 2015, 38(4):103-107.
[24] Feng MY, Fu J, Yang SF, Variation trend monitoring of antibiotic resistance to E.coli isolated from chickens in Shandong province [J]. Chin J Vet Sci, 2017, 37(2):250-253.DOI : 10.16303/j.cnki.1005 4545.2017.02.09 (in Chinese)
冯敏燕, 傅剑, 杨世发,等. 山东省鸡源性大肠杆菌耐药变化趋势监测[J]. 中国兽医学报, 2017, 37(2):250-253.
[25] Liu LY. Isolation, identification and antimicrobial susceptibility test of chicken colibacillosis in Southern Liaoning Province [J]. J Liaoning Agr Coll, 2017, 19(2):1-4.DOI:10.3969/j.issn.1671-0517.2017.02.001 (in Chinese)
刘立英. 辽南地区鸡源性大肠杆菌的分离鉴定及药敏试验[J]. 辽宁农业职业技术学院学报, 2017, 19(2):1-4.
[26] Wu Q, Xi M, Lv X, et al. Presence and antimicrobial susceptibility ofEscherichiacolirecovered from retail chicken in China [J]. Food Protection, 2014, 77(10):1773-1777.
[27] Bush K, Courvalin P, Dantas G, et al. Tackling antibiotic resistance [J]. Nat Rev Microbiol, 2011, 9 (12): 894-896. DOI: 10.1038/nrmicro2693
[28] Wang Y, LiXN,Han JZ, et al. Research on the generating and spreading mechanism of drug resistance ofEscherichiacoli[J]. Modern J Anim Husb Vet Med, 2016, (1): 32-37. DOI:10.3969/j.issn.1672-9692.2016.01.007 (in Chinese)
王影, 李欣南, 韩镌竹, 等. 大肠杆菌耐药性产生与传播机制研究现状[J]. 现代畜牧兽医,2016, (1): 32-37.

