动物源沙门菌的耐药表型、基因型及流行特征研究
,,,,,
非伤寒沙门菌(Non-typhoidalSalmonella, NTS)是重要的食源性致病菌之一。人类感染非伤寒沙门菌多与食品相关产品尤其是肉、蛋、奶等动物性食品产品有关,动物性食物链是重要的沙门氏菌的传播载体[1]。耐药性细菌特别是超级耐药菌的出现已成为全球人与动物临床治疗的重要挑战并成为公共卫生的严重威胁。在畜牧业,抗生素常常用作疾病治疗及生长刺激剂使用导致动物成为耐药菌的重要贮存库[2]。
沙门菌分型方法包括血清学分型、药物敏感试验(Antimicrobial Susceptibility Testing, AST)、脉冲场凝胶电泳(Pulsed-Field Gel Electrophoresis, PFGE)及多位点序列分型(Multilocus Sequence Typing, MLST),这类分型方法在确定与追踪沙门菌的感染及溯源方面起着重要的作用[3-4]。血清分型是监测在环境及动物中沙门氏菌存在与流行的有效工具;细菌的耐药特征在流行病学研究同样有重要意义,多重耐药沙门氏菌(Multidrug-Resistant, MDR)如鼠伤寒沙门菌DT104、纽波特沙门菌、德尔卑沙门菌、阿贡纳沙门菌引起全球关注[2-4]。此类沙门菌重要的特征是对9种药物氨苄青霉素(ampicillin, AMP)、阿莫西林(amoxicillin-clavulanic acid,AMC)、头孢西丁(cefoxitin,FOX)、先锋霉素(cephalothin)、头孢噻呋(ceftiofur)、 氯毒素(chloramphenicol,C)、链霉素(streptomycin)、磺胺甲恶唑(sulfamethoxazole)、及四环素(tetracycline,TE) 药物超级耐药(super-MDR)。主要原因是此类沙门菌获得一重要的基因岛SGI1(Salmonellagenomic island-1)或此基因岛的变体,此类基因岛含有多个编码与耐此类药物相关基因,主要是指blaPSE-1 (氨苄青霉素及头孢类)、floR(氯霉素类/氟苯尼考)、aadA2 (链霉素/壮观霉素)、sul1 (磺胺甲恶唑)、及tet(G) (四环素)以及后续发现的其它相关变体基因岛[4-6]。MLST是一种基于细菌保守基因序列分型方法,在对病原体流行病学溯源与监控以及传播者机制的研究起重要作用[7-8]。
本文通过对动物产业链中沙门菌,主要是鸡、猪两个最重要的食源性动物中的沙门菌进行血清分型、MLST分子分型、耐药表型及耐药基因型的分析研究,分析动物源性沙门菌耐药及传播流行特征,为控制沙门菌通过食物链的传播以减少人与动物相关疾病提供信息。
1 材料与方法
1.1菌株共收集沙门菌116株。其中56株鸡源沙门菌来源于江苏省鸡产业链沙门菌基线调查所采集的样本,38株鸡源沙门菌来源于扬州大学动物疫病检测实验室对散养及养殖场的的病原分离株;猪源沙门菌22株,主要来源于江苏省基线调查的猪活体内脏及猪粪。以上这116个菌株均于2012-2013年间收集。所有菌株均参考GB4789.4-2010方法进行生化试验确认。
1.2方法
1.2.1血清学分型参照GB4789.4-2010方法,对所有沙门菌进行血清学分型。
1.2.2药物敏感试验药物敏感试验使用琼脂平板扩散法参照CLSI(2013)进行[9]。主要检测沙门菌对14类药物的敏感性:10 μg氨苄青霉素(AMP)、30 μg 阿莫西林(AMC)、30 μg 头孢噻圬 (CTX)、30 μg 头孢吡肟 (cefepime, FEP)、75 μg 头孢哌酮 (cefoperazone, CFP)、30 μg 头孢曲松 (ceftriaxone, CRO)、10 μg 庆大霉素 (gentamicin, GN)、30 μg 卡那霉素 (kanamycin, K)、 30 μg 阿米卡星(amikacin, AK)、30 μg萘啶酸 (nalidixic acid, NA)、5 μg 环丙沙星(ciprofloxacin,CIP)、25 μg磺胺甲嗯唑 (trimethoprim/sulfamethoxazole, SXT)、30 μg 氯霉素(C)、30 μg 四环素(TE) (Oxoid Ltd., Basingstoke, England)。使用大肠杆菌ATCC 25922作为试验参考株。耐药结果按照CLSI (2013)判断标准进行判断[9]。
1.2.3MLST分子分型所有的沙门菌均进行MLST分子分型[3-4,7-8]。7个沙门菌管家基因(housekeeping genes)aroC,dnaN,hemD,hisD,purE,sucA, 及thrA通过PCR方法扩增后的产物进行测序。基因引物及扩增方法参照MLST官方网站提供的方法进行 (http://mlst.warwick.ac.uk/mlst/dbs/Senterica),测序的结果上传官网可得到相应的序列型别(sequence type,ST),即ST型。
1.2.4耐药基因的测定本研究中的耐药基因主要是近年报道的位于SG1基因岛及其变体上主要11个耐药基因包括β-内酰胺酶基因[4,10-12]。主要包括:β-内酰胺酶基因:blaTEM-1-like、blaCTX-M、blaOXA-1-like、blaCMY-2、blaPSE及blaSHV;磺胺甲嗯唑:sul1;庆大霉素:aacC4;卡那霉素:aac(6′)-1b;氯霉素:floR;四环素:tet(G)。PCR扩增方法按文献提供的方法进行,见表1[4,10-12]。扩增产物经测序并通过BLAST 确认(http://blast.ncbi.nlm.nih.gov/Blast.cgi)。
2 结 果
2.1血清学分型116株沙门菌共有4个血清型。其中肠炎沙门菌64株,印第安那沙门菌32株,德尔卑沙门菌19株,鲁齐齐沙门菌1株。在鸡产业链中的56株沙门菌中,31株为肠炎沙门菌,25株为印第安那沙门菌;从病禽获得的38株沙门菌中,33株为肠炎沙门菌,5株为印第安那沙门菌。而在猪源性22株沙门菌中,19株为德尔卑沙门菌,1株为鲁齐齐沙门菌,2株为印第安那沙门菌,见表3。
表1PCR 引物及来源
Tab.1PCR primers
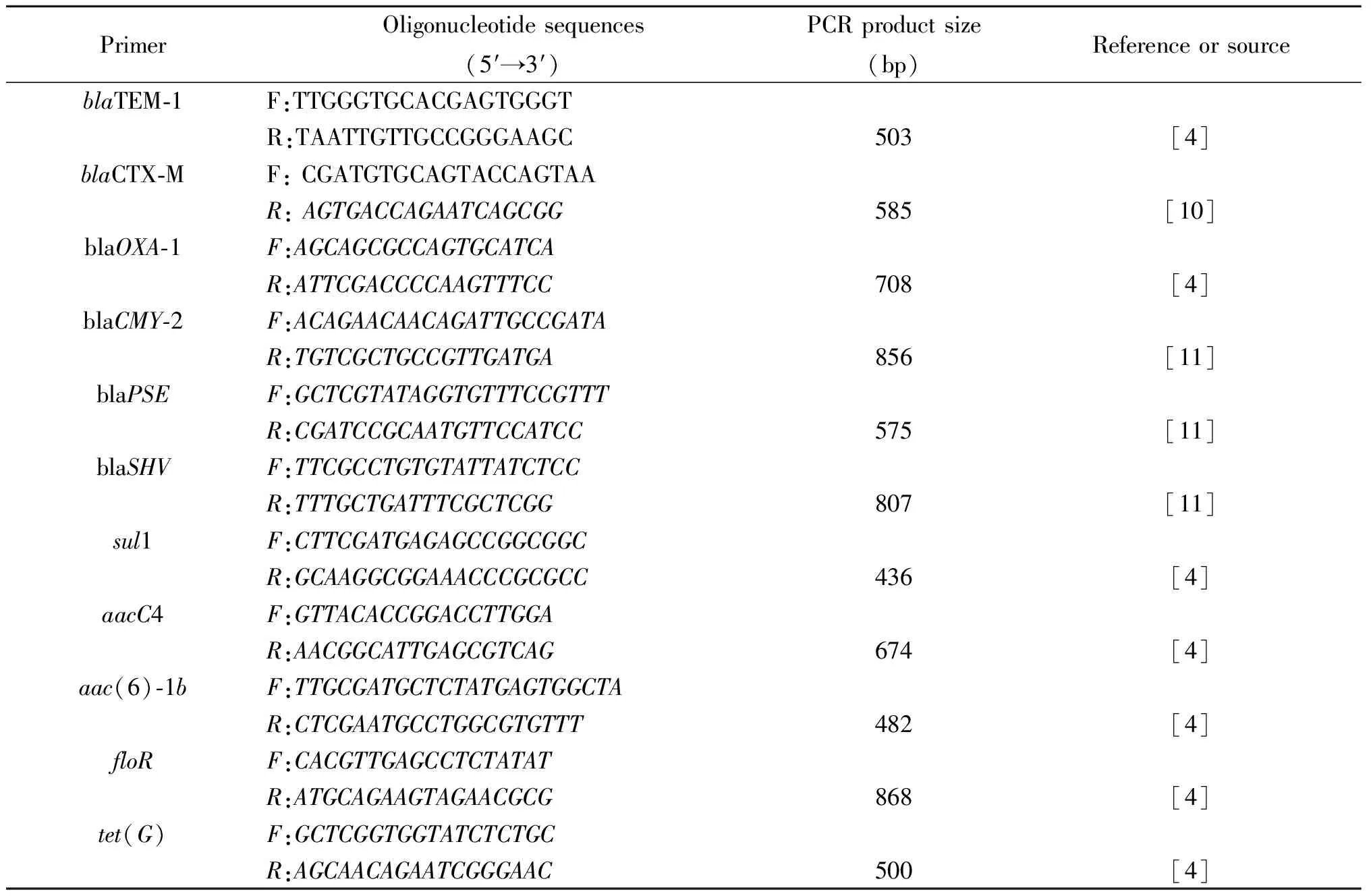
PrimerOligonucleotidesequences(5′→3′)PCRproductsize(bp)ReferenceorsourceblaTEM⁃1F:TTGGGTGCACGAGTGGGTR:TAATTGTTGCCGGGAAGC503[4]blaCTX⁃MF:CGATGTGCAGTACCAGTAAR:AGTGACCAGAATCAGCGG585[10]blaOXA⁃1F:AGCAGCGCCAGTGCATCAR:ATTCGACCCCAAGTTTCC708[4]blaCMY⁃2F:ACAGAACAACAGATTGCCGATAR:TGTCGCTGCCGTTGATGA856[11]blaPSEF:GCTCGTATAGGTGTTTCCGTTTR:CGATCCGCAATGTTCCATCC575[11]blaSHVF:TTCGCCTGTGTATTATCTCCR:TTTGCTGATTTCGCTCGG807[11]sul1F:CTTCGATGAGAGCCGGCGGCR:GCAAGGCGGAAACCCGCGCC436[4]aacC4F:GTTACACCGGACCTTGGAR:AACGGCATTGAGCGTCAG674[4]aac(6)⁃1bF:TTGCGATGCTCTATGAGTGGCTAR:CTCGAATGCCTGGCGTGTTT482[4]floRF:CACGTTGAGCCTCTATATR:ATGCAGAAGTAGAACGCG868[4]tet(G)F:GCTCGGTGGTATCTCTGCR:AGCAACAGAATCGGGAAC500[4]
2.2药物敏感试验: 116株2012-2013年收集的菌株中,对萘啶酸、氨苄青霉素、四环素、头孢哌酮耐药率较高,分别达93.10%、80.17%、73.28%、62.93%;肠炎沙门菌中,对萘啶酸、氨苄青霉素、四环素、头孢哌酮耐药率较高,分别达94.83%、 89.66%、62.07%、56.90%;猪源德尔卑等沙门菌四环素、萘啶酸、磺胺甲嗯唑、氯霉素耐药率较高,分别达100%、90%、70%、55%;印第安那沙门菌中,对大多数药物耐药达80%以上,耐药率最低的阿莫西林达52.63%。116株菌株对14种药物耐药结果形成49个耐药谱型。38株印第安那沙门菌共产生21种耐药谱,其中33株菌株形成对9个以上药物耐药谱,有6株对所有药物耐药。59株肠炎沙门菌产生14种耐药谱;3株对9种以上的药物耐药;部分菌株形成固定的耐药谱:AMP-CFP-NA-TE、AMP-CTX-FEP-CFP-CRO-K-NA-C。20株主要为德尔卑猪源沙门菌产生14种耐药谱,主要对四环素、萘啶酸、磺胺甲嗯唑、氯霉素耐药,有2株对9种以上耐药,见表2、3。
表2116株沙门菌的耐药情况Tab.2Antibioticresistanceof116strainsofSalmonella
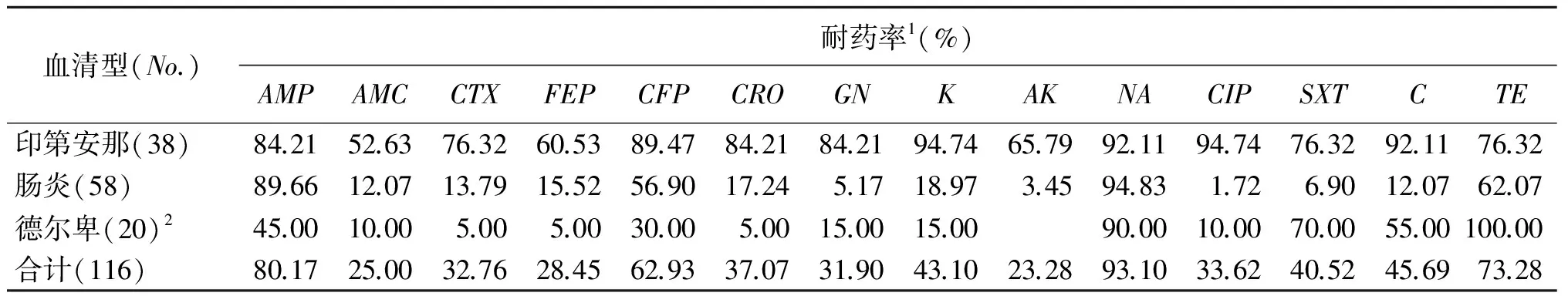
血清型(No.)耐药率1(%)AMPAMCCTXFEPCFPCROGNKAKNACIPSXTCTE印第安那(38)84.2152.6376.3260.5389.4784.2184.2194.7465.7992.1194.7476.3292.1176.32肠炎(58)89.6612.0713.7915.5256.9017.245.1718.973.4594.831.726.9012.0762.07德尔卑(20)245.0010.005.005.0030.005.0015.0015.0090.0010.0070.0055.00100.00合计(116)80.1725.0032.7628.4562.9337.0731.9043.1023.2893.1033.6240.5245.6973.28
1AMP: 氨苄青霉素AMC:阿莫西林CTX: 头孢噻圬FEP: 头孢吡肟CFP:头孢哌酮CRO:头孢曲松GN:庆大霉素K:卡那霉素AK:阿米卡星NA:萘啶酸CIP: 环丙沙星SXT:磺胺甲嗯唑C: 氯霉素TE:四环素
2包括一株鲁齐齐沙门菌
表3动物源沙门菌血清型、分子型、耐药表型及基因型Tab.3Serotype,ST,antibioticresistancephenotypesandgenotypes
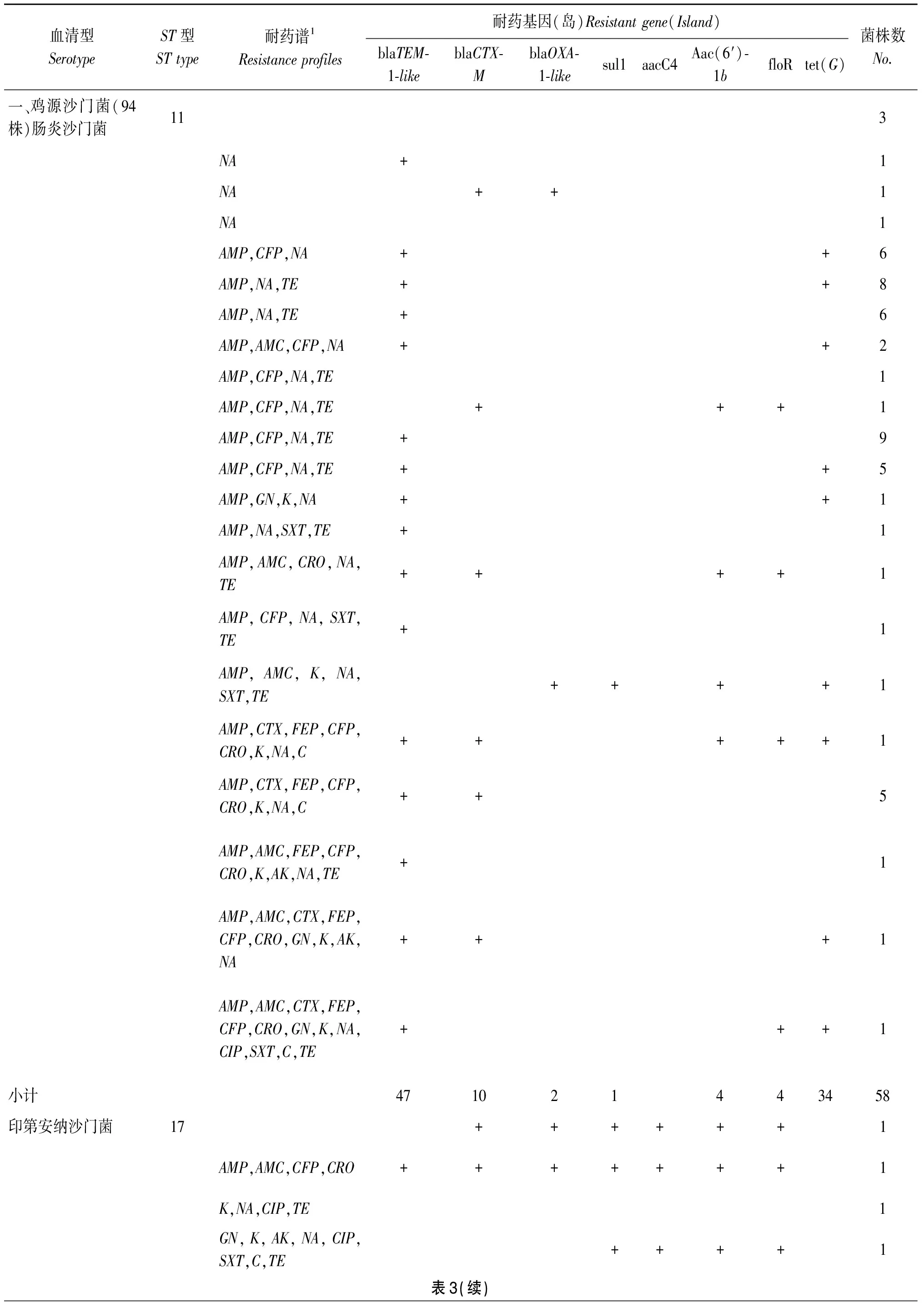
血清型SerotypeST型STtype耐药谱1Resistanceprofiles耐药基因(岛)Resistantgene(Island)blaTEM⁃1⁃likeblaCTX⁃MblaOXA⁃1⁃likesul1aacC4Aac(6′)⁃1bfloRtet(G)菌株数No.一、鸡源沙门菌(94株)肠炎沙门菌113NA+1NA++1NA1AMP,CFP,NA++6AMP,NA,TE++8AMP,NA,TE+6AMP,AMC,CFP,NA++2AMP,CFP,NA,TE1AMP,CFP,NA,TE+++1AMP,CFP,NA,TE+9AMP,CFP,NA,TE++5AMP,GN,K,NA++1AMP,NA,SXT,TE+1AMP,AMC,CRO,NA,TE++++1AMP,CFP,NA,SXT,TE+1AMP,AMC,K,NA,SXT,TE++++1AMP,CTX,FEP,CFP,CRO,K,NA,C+++++1AMP,CTX,FEP,CFP,CRO,K,NA,C++5AMP,AMC,FEP,CFP,CRO,K,AK,NA,TE+1AMP,AMC,CTX,FEP,CFP,CRO,GN,K,AK,NA+++1AMP,AMC,CTX,FEP,CFP,CRO,GN,K,NA,CIP,SXT,C,TE+++1小计471021443458印第安纳沙门菌17++++++1AMP,AMC,CFP,CRO+++++++1K,NA,CIP,TE1GN,K,AK,NA,CIP,SXT,C,TE++++1表3(续)
1.AMP: 氨苄青霉素AMC:阿莫西林CTX: 头孢噻圬FEP: 头孢吡肟CFP:头孢哌酮CRO:头孢曲松GN:庆大霉素K:卡那霉素AK:阿米卡星NA:萘啶酸CIP: 环丙沙星SXT:磺胺甲嗯唑C: 氯霉素TE:四环素
2.3MLST分子分型按Feil等MLST的分型规则[7],所有沙门菌可以分为10个ST型 (sequencetype),即10个ST克隆(clone):ST11,ST17,ST19,ST40,ST64,ST155,ST68,ST139,ST145,ST2939;其中ST139及ST145是ST68同源复合体(ClonalComplex,CC)。鸡源性沙门菌含有两克隆即:ST11克隆,全部为肠炎沙门菌;ST17克隆全部为印第安那沙门菌;猪源性沙门菌中主要为ST40克隆,为德尔卑沙门菌。
2.4耐药基因检测对11个耐药基因的检测,116株2012-2013年收集的菌株中,blaTEM-1-like、bla-CTX-M、blaOXA-1-like、sul1、aacC4、aac6-1b、floR、tet(G) 检出率分别达68.97%、37.93%、28.45%、35.34%、30.17%、31.90%、32.21%、20.69%; blaCMY-2、 blaPSE、及blaSHV均未检出。在ST11克隆(肠炎沙门菌)中,blaTEM-1-like、tet(G)检出率最高,分别占81.03%和41.38%;在ST17克隆(印第安那沙门菌)中,除tet(G)未检出外,其余耐药基因携带率都大于65.79%以上,bla-CTX-M、blaOXA-1-like、blaTEM-1-like携带率达89.47%、73.68%及65.79%。在猪源沙门菌(主要为ST40克隆),耐药基因较高携带者为sul1及blaTEM-1-like,分别为50%及40%。
3 讨 论
本调查从鸡场外环境、肉鸡、饲料、屠宰用具、冷水池、分割鸡、贮存及配送等环节均检出沙门菌。表明在国内动物产业链中,沙门菌污染的公共卫生状况普遍。另一重要的危害因素是国内农村地区有大量个体散养、半散养鸡群,对防控沙门菌传播带来重大挑战,这一点从散养及小规模养殖场病禽中检测出沙门菌所说明。
结果表明在江苏及周围地区鸡是肠炎沙门菌及印第安那沙门菌的宿主,而猪是德尔卑沙门菌的宿主,这一结果与国内外一些报告相似[11, 13-14]。MLST分子分型结果表明,在整个鸡产业链中的检出的沙门菌,其分子型都是相同的,即肠炎沙门菌属于ST11克隆,而印第安那沙门菌属于ST17克隆。动物带菌传播到人并对人类健康带来危害早已被其它研究证明[12, 15-17]。肠炎沙门菌对人体的危害已广为人知,而印第安那沙门菌在国内主要引起动物致病,但其导致人体感染甚至暴发感染报告近年来有所增加[18-20]。
近年来,多重耐药菌特别是对广谱头孢类抗生素及氟喹诺酮类抗生素的出现并在全世界扩散引起了人们的关注[21-22]。本调查中,所有沙门菌对青霉素类包括头孢类药物氨苄青霉素、头孢哌酮及喹诺酮类药物柰啶酮酸、及四环素高度耐药,83.05%菌株对于3种以上的药物多重耐药(MDR)。不同ST克隆、不同血清型细菌耐药特征各不相同。在ST11克隆肠炎沙门菌,耐药结果与沙门菌总体情况类似,但出现了几个固定的耐药谱型,表明肠炎沙门菌对特定药物组合耐药特性,多数只对4-6种耐药,属于中度多重耐药,与国内外其它研究的报道相似[23-26]。猪源沙门菌中,多数为ST40克隆德尔卑沙门菌,耐药程度相对较轻,并显示出了与ST11克隆明显不同的耐药谱型。最引人关注的是ST17克隆印第安那沙门菌对14种药物显示出多数至少对9种以上的药物的超级耐药(super-MDR)特征:除了几乎所有的青霉素类药物包括第三代、第四代头孢菌素耐药外,对氟喹诺酮类药物环丙沙星、氨基糖苷类药物卡那霉素等高耐药,且这类药物特别是头孢类及氟喹诺酮类是沙门菌临床治疗过程中的首选药物甚至是最终药物。抗生素在畜牧业及动物包括宠物中的滥用是造成高耐药出现主要原因。长期以来,抗生素(包括近年来严格在动物的禁用的抗生素)作为生长刺激剂以及疾病的预防剂一直没有真正的停止过,尤其是在广大农村地区的散养及小型养殖户[2,12,27-29]。抗生素的滥用,导致动物中超级耐药菌的出现。令人担忧的是,这类耐药菌通过耐药基因正向同属菌及其它类菌中扩散[12]。减少并严格控制动物中抗生素的滥用及误用是控制多重耐药菌特别是超级耐药菌出现的关键。
导致青霉素类包括头孢类药物耐药的主要原因是由于细菌携带有β-内酰胺酶基因。超级耐药菌基因岛如SG1及变体拥有不同的耐药基因如β-内酰胺酶基因、氨基糖苷类基因等,这类多变的基因簇可以在细菌相同种属或不同种属间传播[4,6,12, 30-33]。在本文中,耐药基因的携带状况特别是β-内酰胺酶基因与耐药表型相关性较高。与已有的报道SG1及变体中携带有基因blaPSE、blaCMY-2、blaSHV不同[4,6, 27-28],本研究结果总体上blaTEM-1-like有较高的携带率;而ST17克隆中印第安那沙门菌多数同时携带blaOXA-1-like、blaCTX-M、及blaTEM-1-like基因,blaCTX-M是近十年来发现的基因[6];不仅如此在ST17克隆中,floR, aadA2, sul1及aac(6′)-1b有较高的携带率。ST11克隆肠炎沙门菌主要对blaTEM-1-like、tet(G)有较高的携带率。与耐药表型结果类似,不同地区不同时间不同分子克隆及血清型携带的耐药基因不一样,可能是菌株所处的环境及耐药压力不同,而导致耐药基因的产生及传播出现差异。
参考文献:
[1]FoleySL,LynneAM.Foodanimal-associatedSalmonellachallenges:pathogenicityandantimicrobialresistance[J].JAnimSci,2008, 86(14Suppl): 173-87.DOI:10.2527/jas.2007-0447
[2]VoAT,VanDE,FluitAC,etal.DistributionofSalmonella entericaserovarsfromhumans,livestockandmeatinVietnamandthedominanceofSalmonella Typhimuriumphagetype90[J].VetMicrobiol,2006,113(1-2):153.DOI:10.1016/j.vetmic.2005.10.034
[3]StepanRM,SherwoodJS,PetermannSR,etal.MolecularandcomparativeanalysisofSalmonella enterica SenftenbergfromhumansandanimalsusingPFGE,MLSTandNARMS[J].BMCMicrobiol,2011,11(1):153.DOI: 10.1186/1471-2180-11-153
[4]BeutlichJ,JahnS,MalornyB,etal.AntimicrobialresistanceandvirulencedeterminantsinEuropeanSalmonellagenomicisland1-positiveSalmonella entericaisolatesfromdifferentorigins[J].ApplEnvironMicrobiol,2011,77(16):5655-5664.DOI:10.1128/AEM.00425-11
[5]BoydD,PetersGA,CloeckaertA,etal.Completenucleotidesequenceofa43-kilobasegenomicislandassociatedwiththemultidrugresistanceregionofSalmonella entericaserovarTyphimuriumDT104anditsidentificationinphagetypeDT120andserovarAgona[J].JBacteriol,2001,183(19):5725-5732.DOI: 10.1128/JB.183.19.5725-5732.2001
[6]CantónR,CoqueTM.TheCTX-Mbeta-lactamasepandemic[J].CurrOpinMicrobiol,2006,9(5):466-75.DOI: 10.1016/j.mib.2006.08.011
[7]FeilEJ,MaidenMC,AchtmanM,etal.TherelativecontributionsofrecombinationandmutationtothedivergenceofclonesofNeisseria meningitidis[J].MolBiolEvol,1999,16(11):1496.DOI: 10.1093/oxfordjournals.molbev.a026061
[8]UrwinR,MaidenMC,etal.Multi-locussequencetyping:atoolforglobalepidemiology[J].TrendsMicrobiol, 2003, 11(10):479-487.DOI: 10.1016/j.tim.2003.08.006
[9]ClinicalandLaboratoryStandardsInstitute(CLSI).PerformancestandardsforAntimicrobialsusceptibilitytesting[S].2013,M100-23.
[10]BatchelorM,HopkinsK,ThrelfallEJ,etal.BlaCTX-MgenesinclinicalSalmonellaisolatesrecoveredfromhumansinEnglandandWalesfrom1992to2003 [J].AntimicrobAgentsChemother,2005,49(4): 1319.DOI:10.1128/AAC.49.4.1319-1322.2005
[11]LiR,LaiJ,WangY,etal.PrevalenceandcharacterizationofSalmonella,speciesisolatedfrompigs,ducksandchickensinSichuanProvince,China[J].IntJFoodMicrobiol,2013,163(1):14-18.DOI: 10.1016/j.ijfoodmicro.2013.01.020
[12]ChaoG,WangC,WuT,etal.MolecularepidemiologyandantibioticresistancephenotypesandgenotypesofsalmonellaefromfoodsupplychainsinChina[J].FoodControl,2017.DOI:10.1016/j.foodcont.2017.01.022
[13]LaiJ,WuC,WuC,etal.SerotypedistributionandantibioticresistanceofSalmonellainfood-producinganimalsinShandongprovinceofChina,2009and2012[J].IntJFoodMicrobiol,2014,180(3):30.DOI:10.1016/j.ijfoodmicro.2014.03.030
[14]WangY,ChenQ,CuiS,etal.EnumerationandcharacterizationofSalmonellaisolatesfromretailchickencarcassesinBeijing,China[J].FoodbornePathogDis,2014,11(2):126.DOI:10.1089/fpd.2013.1586
[15]MarcusR,VarmaJK,MedusC,etal.Re-assessmentofriskfactorsforsporadicSalmonellaserotypeEnteritidisinfections:acase-controlstudyinfiveFoodNetSites,2002-2003[J].EpidemiolInfect,2007,135(1):84.DOI:10.1017/S0950268806006558
[16]MeadG,LammerdingAM,CoxN,etal.ScientificandtechnicalfactorsaffectingthesettingofSalmonellacriteriaforrawpoultry:aglobalperspective[J].JFoodProt,2010,73(8):1566.DOI: 10.4315/0362-028X-73.8.1566
[17]SmadiH,SargeantJM.QuantitativeRiskassessmentofhumanSalmonellosisinCanadianbroilerchickenbreastfromretailtoconsumption[J].RiskAnal,2013,33(2):232-248.DOI:10.1111/j.1539-6924.2012.01841.x
[18]CentersforDiseaseControlandPrevention(CDC),FourMultistateOutbreaksofHumanSalmonellaInfectionsLinkedtoLivePoultryinBackyardFlocks,[EB/OL].(2015-07-30)[2015-09-24].http://www.cdc.gov/salmonella/live-poultry-07-15/index.html.
[19]CentersforDiseaseControlandPrevention(CDC),EightMultistateOutbreaksofHumanSalmonellaInfectionsLinkedtoLivePoultryinBackyardFlocks,[EB/OL].(2015-07-19)[2015-10-06].http://www.cdc.gov/salmonella/live-poultry-05-16/index.html.
[20]GongJ,WangC,ShiS,etal.Highlydrug-resistantSalmonella entericaserovarIndianaclinicalisolatesrecoveredfrombroilersandpoultryworkerswithdiarrheainChina[J].AntimicrobAgentsChemother,2016,60(3):AAC.03009-15.DOI:10.1128/AAC.03009-15.
[21]HarbottleH,WhiteDG,McdermottPF,etal.Comparisonofmultilocussequencetyping,pulsed-fieldgelelectrophoresis,andantimicrobialsusceptibilitytypingforcharacterizationofSalmonella entericaserotypeNewportisolates[J].JClinMicrobiol,2006,44(7):2449-57.DOI:10.1128/JCM.00019-06
[22]LolansK,CalvertK,WonS,etal.DirectertapenemdiskscreeningmethodforidentificationofKPC-producingKlebsiella pneumoniaeandEscherichia coliinsurveillanceswabspecimens[J].JClinMicrobiol,2010,48(3):836-841.DOI:10.1128/JCM.01988-09
[24] Lu Y,Zhao H,Sun J,et al.Characterization of multidrug-resistantSalmonellaentericaserovarsIndianaandEnteritidisfrom chickens in Eastern China[J].PLoS One,2014,9(5):e96050.DOI:10.1371/journal.pone.0096050
[25] Zhang M,Li YF,Qi HY,et al.Surveilance situation ofSalmonellain foodborne diseases in Henan,China,2015-2016[J].Chin J Zoonoses,2015,33(8): 748-752.DOI:10.3969/j.issn.1002-2694.2017.08.017 (in Chinese)
张濛,李艳芬,戚浩彧,等.2015-2016年河南省食源性疾病沙门氏菌监测情况分析[J].中国人兽共患病学报,2015,33(8): 748-752.
[26] Wang J,Liu XX,Zhang Q,et al.Resistance and serotype ofSalmonellaisolated from pig slaughtering process in Shandong Province[J].Chin J Zoonoses,2017,33(6):517-521.DOI:10.3969/ j.issn.1002-2694.2017.06.009 (in Chinese)
王娟,刘鲜鲜,张倩,等.山东生猪屠宰环节沙门氏菌血清型及耐药性测试[J].中国人兽共患病学报,2017,33(6):517-521.
[27] Gyles CL.Antimicrobial resistance in selected bacteria from poultry[J].Anim Health Res Rev,2008, 9(2):149-158.DOI:10.1017/S1466252308001552
[28] Mathew AG,Cissell R,Liamthong S.Antibiotic resistance in bacteria associated with food animals: a United States perspective of livestock production[J].Foodborne Pathog Dis,2007,4(2):115.DOI: 10.1089/fpd.2006.0066
[29] Zhang XL,Yang BW,Liao XG,et al.Antimicrobial resistance of foodborne and poultryborneSalmonellain Hebi City Henan Province[J].Chin J Zoonoses,2010,26(12):1134-1136.DOI: 1002-2694(2010)12-1134-03 (in Chinese)
张秀丽,杨保伟,廖兴广,等.河南省鹤壁市食源性和禽源性沙门氏菌耐药性研究[J].中国人兽共患病学报,2010,26(12):1134-1136.
[30] Li B,Lan R,Zhang X,et al.Prevalence ofSalmonellaisolates from chicken and pig slaughterhouses and emergence of ciprofloxacin and cefotaxime co-resistantS.entericaserovarIndianain Henan,China[J].PLoS One,2015,10(12):e0144532.DOI:10.1371/journal.pone.0144532
[31] Rodríguez I,Barownick W,Helmuth R,et al.Extended-spectrum {beta-lactamases and AmpC {beta-lactamases in ceftiofur-resistantSalmonellaentericaisolates from food and livestock obtained in Germany during 2003-07[J]. J Antimicrob Chemother,2009,64(2):301-309.DOI:10.1093/jac/dkp195
[32] Wang XQ,Chen X,Wu S,et al.Effect ofgyrAgene mutation inSalmonellaon the drug susceptibility to fluoroquinolones[J].Chin J Zoonoses,2007,23(9):891-894,898.DOI:1002-2694(2007)09-0891-04 (in Chinese)
王晓泉,陈祥,吴双,等.沙门氏菌gyrA基因的变异对氟喹诺酮类药物敏感性的影响[J].中国人兽共患病学报,2007,23(9): 891-894,898.
[33] Lu Y,Zhao HY,Liu Y,et al.Analysis of quinolones resistance inSalmonellaIndianafrom chicken[J].Chin J Zoonoses,2013,29(6):605-608.DOI:10.3969/cjz.j.issn.1002-2694.2013.06.016 (in Chinese)
陆彦,赵红玉,刘宇,等.鸡源印第安纳沙门氏菌对喹诺酮类药物耐药性分析[J].中国人兽共患病学报,2013,29(6):605-608.

