荞麦生物学研究进展
杨学乐,何录秋,邱 博,李志清
(湖南省作物研究所,长沙 410125)
荞麦属于蓼科荞麦属,是一种双子叶草本植物。荞麦在世界上分布很广,目前在全世界发现的荞麦共有28个种、亚种和变种。荞麦的主要栽培种有两个:甜荞(common buckwheat)和苦荞(tartary buckwheat)。甜荞和苦荞被用作各种食物制品,主要种植在韩国、日本和中国[1~4]。由于苦荞含有丰富的营养成分,近年来,韩国的种植面积逐年增加[5]。与甜荞相比,苦荞中含有丰富的芦丁和生物类黄酮物质。芦丁对降低血管内胆固醇、高血压和糖尿病都有很好的治疗效果。据报道,芦丁在药物研究中也发挥了关键作用[6~8]。
荞麦自古在我国就有种植,但都作为填闲补缺作物,或在大宗作物不能生长的高山冷凉地区种植,且大多数荞麦收获之后都留着自用,没有形成大规模规范种植。随着对荞麦研究的深入,荞麦的营养价值和药用价值被发掘出来。近年来,国内外对荞麦的研究也越来越多。我国被认为是荞麦的起源中心,同时也是荞麦种植大国,荞麦种植面积居世界第二位。但荞麦在我国一直不受重视,属于小宗粮豆类。国内对荞麦的研究一直处于起步阶段,研究基础薄弱,进展比较缓慢。目前国内学者对荞麦的研究大部分都是关于荞麦的遗传多样性及亲缘关系等方面,分子生物学方面的研究还比较少。
1 荞麦的营养价值和保健功能
荞麦自古以来虽然也作为粮食,但和水稻、小麦等粮食作物不同,不属于禾本科。荞麦除了食用价值以外,还有药用价值,是药食两用的特色作物。荞麦中除了含有的蛋白质、氨基酸、膳食纤维、维生素和微量矿质元素等大多都优于大宗粮食作物以外(表1)[9],还含有许多禾本科作物不具有的黄酮类生物活性成分,能够有效地预防、控制和辅助治疗糖尿病、心血管硬化疾病、高血压。荞麦的营养价值非常高。最新研究结果表明,荞麦中含有植物类蛋白质,这类蛋白质不容易转化成脂肪,经常吃荞麦制品可以预防肥胖病。荞麦中的膳食纤维非常丰富,远远高于大米和面粉,常吃荞麦制品可以预防便秘。荞麦中还含有铬元素。铬元素能够调节体内糖代谢,保持体内血糖平衡,经常食用荞麦制品可以有效控制血糖,对糖尿病患者有帮助。
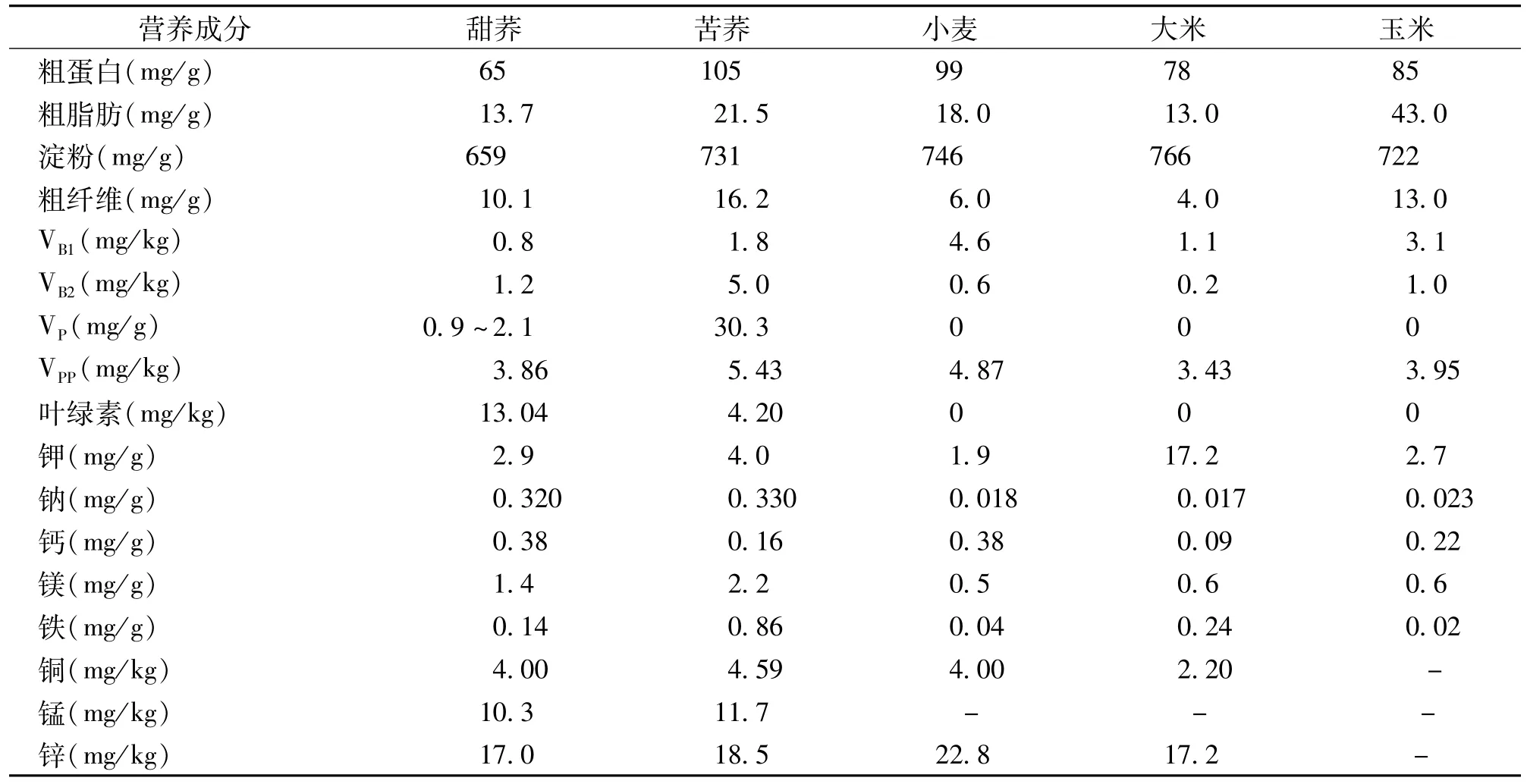
表1 荞麦与小麦、大米、玉米营养成分比较Table 1 The nutrition comparison of buckwheat w ith wheat,rice and corn
2 荞麦的形态学研究
随着国内外对荞麦研究的深入,荞麦形态学研究也越来越多,主要涉及形态解剖学和种间杂交等方面。李淑久等[10]对甜荞(F.esculentum Moench)、苦荞[F.tataricum(L.)Gaertn]、金荞麦(F.cymosum)和齿翅野荞麦(F.graclipes var.odontopterum)等4种荞麦生殖器官的形态结构进行研究,结果表明:4种荞麦在外部形态尤其是子叶和真叶的形态上有明显的差异,而内部解剖结构差异较小;根、茎结构基本相同,4者之间有较近的亲缘关系,但又彼此之间有一定的界限。之后,李淑久等[11]又对这4种荞麦的生殖器官进行了形态学与解剖学的比较观察,结果表明:4种荞麦的花被片的颜色、形状和脉迹数目都存在品种间差异;蜜腺数量相同但大小不同,苦荞蜜腺最小,甜荞蜜腺最大;甜荞与金荞麦存在雌蕊与花柱异长现象,苦荞与齿翅野荞麦雌雄蕊近等长;4种荞麦的果实在形态上有明显差异。张小燕等[12]采用系统聚类分析方法将来源于全球的121个荞麦品种分成了4个类型,即Ⅰ高产型、Ⅱ中产型、Ⅲ低产型、Ⅳ特矮低产型。Ⅳ特矮低产型引种无价值,Ⅲ低产型直接利用价值不大,但作为改良品种材料在育种中可能会有一定的作用,Ⅱ中产型经过适当改良能够应用于农业生产中,Ⅰ高产型是人们所需要的理想品种。
岳鹏等[13]以甜自21-1、Lorena-3和甜自100三个普通荞麦品种为材料配制杂交组合,得到F1、F2代种子,对亲本、F1和F2群体的落粒性、茎干颜色和瘦果形状进行研究,结果表明:不同的杂交组合F2代在瘦果形状、落粒性和茎干颜色方面表现不同,3个品种正反交F2代的尖果性状是由单基因控制的;甜自21-1和Lorena-3正反交F2的落粒性是由显性基因互补控制,而甜自21-1和甜自100杂交后代群体不存在落粒基因的显性互补作用;甜自21-1和Lorena-3的杂交后代组合的茎干颜色是由显性互补基因控制的,而甜自21-1和甜自100的杂交后代的茎干颜色是由单基因控制的。邓蓉等[14]对不同地区收集的11份野生金荞麦进行田间观察和聚类分析,结果表明:不同来源的野生金荞麦叶面积幅度差异大,通过表型性状的聚类分析可以将11份资源分为4类,可以选育出牧草产量高和抗倒伏性好的材料;通过营养成分的聚类分析可以将11份材料分为2类,可以筛选出蛋白质含量高且纤维素和木质素含量低的材料。周忠泽等[15]对中国荞麦属花粉形态及花被片和果实微形态特征研究结果表明:中国荞麦属根据沟膜的有无,花粉可以明显地区分为具沟膜者和不具沟膜者2类;荞麦属的花粉形态极为一致,其外壁纹饰均为细网状,萌发孔为三孔沟。
Ohsako等[2]描述了在中国西南部发现的两个新的荞麦种,F.gracilipedoides和 F.jinshaense。F.gracilipedoides在形态上和细柄野荞麦相似,但其染色体倍数(2n=16)与细柄野荞麦(2n=32)不同;F.jinshaense在形态上与岩野荞麦相似,但其花序形态不同,F.jinshaense属于长的穗状花序,而岩野荞麦属于紧凑的头状花序;F.gracilipedoides和F.jinshaense都属于花柱异常,自交不亲和的二倍体。
许多人对荞麦的主要农艺性状进行了研究。边巴卓玛[16]对7个甜荞品种和9个苦荞品种进行农艺性状及产量的相关分析和通径分析,结果表明:影响甜荞产量的主要因素作用大小是主茎节数>单株粒重>千粒重>株高>生育日数;影响苦荞产量的主要因素作用大小是千粒重>单株粒重>主茎节数>株高>生育日数>主茎分枝。阮培均等[17]对收集到的14份野生金荞麦的部分农艺性状进行观察,并测定根茎中表儿茶素、醇溶性浸出物、总灰分和水分含量,并进行相关通径分析,结果表明:14份材料中,根茎主要成分符合国家标准的有9份,醇溶性浸出物含量对表儿茶素的形成影响最大,其次是总灰分和水分含量。郭菊卉等[18]以 Homo、甜自 100、Lorena-3和甜自21-1四个品种配制的8个杂交组合的F5代群体和亲本组成的群体(n=520)为材料,对主要农艺性状进行相关分析和通径分析,结果表明:影响单株产量的主要因素为结实率、种子长度、种子宽度、千粒重和总分枝数。杨明君等[19]对苦荞主要经济性状遗传参数进行研究表明:苦荞株高、千粒重等遗传力较高,早代进行选择效果明显;单株粒重等遗传力低,应放宽选择标准,增加选择世代;单株粒重虽然与产量高度相关,但遗传变异系数较小,直接选择效果差,可通过选择株高、单株粒数和千粒重来达到间接提高单株粒重的目标。
3 荞麦的细胞学研究
荞麦的染色体属于小染色体类,细胞学观察比较难,因此目前关于荞麦细胞学的研究很少,主要是染色体核型和带型的分析。朱凤绥[20]在1984年首次对国产5种不同类型荞麦的染色体进行了比较,结果表明:不同类型荞麦的染色体倍性、随体染色体数目和G-带带型等均有所差异。朱必才等[21]通过秋水仙素诱导普通二倍体荞麦得到四倍体荞麦‘混选4号’,对其外部形态及细胞学方面进行研究,结果表明:同源四倍体与普通二倍体相比,花粉粒、叶片保卫细胞、根尖分生组织细胞都增大,染色体也加倍变成2n=32,且同源四倍体表现出具有多核仁及不规则核仁等核不稳定现象。朱必才等[22]于1992年又对‘混选4号’的细胞遗传学进行研究,结果表明:荞麦结实率低与减数分裂过程无关,主要是由其花器结构和外界气候原因决定的,同源四倍体和普通二倍体在结实率方面没有明显差异,增产的主要原因是千粒重的增加。
张长顺[23]综合前人研究方法,采用改良过的BrdU-风油精法对荞麦染色体G-带显带进行研究,结果表明:荞麦染色体从晚前期到中期的不同有丝分裂时期均显示出了G-带条纹,但每个时期的条纹差异却很大;随着有丝分裂的进行,染色体上的显带条纹数目从前期到中期依次减少。王建胜等[24]对我国部分甜荞和苦荞品种染色体观察和核型分析,结果表明:甜荞和苦荞染色体数目稳定,均为2n=16;荞麦各品种间染色体相对长度变化范围较小,甜荞各品种都有2对随体染色体,苦荞品种间随体染色体数目不稳定,有1对和2对嵌合的现象,但以1对的为主;甜荞和苦荞的核型公式分别为12m+4m(SAT)、12m+2sm+2sm(SAT)。刘建林等[25]以在四川凉山收集到的两个野生荞麦种(皱叶野荞麦和细柄野荞麦)为材料进行核型分析,结果表明:皱叶野荞麦和细柄野荞麦的染色体数目均为2n=4x=32;两者核型都是对称型,染色体属于m型,核型公式分别为30m(4SAT)+2sm和32m。Neethirajan等[26]使用原子显微镜(AFM)对荞麦染色体进行核型分析和分类,使用酶浸渍技术从根组织中分离甜荞和苦荞染色体,并铺展在玻璃基底上,风干的染色体具有脊状表面,甜荞和苦荞染色体长度约为350 nm和150 nm,采用三维的AFM测量方法计算了荞麦染色体的中期的体积,测量的甜荞和苦荞的染色体体积分别在1.08~2.09μm3和0.49~0.78μm3之间。通过使用AFM测量的相对臂长度、着丝粒位置和染色体体积等参数,可以避免传统方法的主观不一致,从而提供精确的细胞核分类。核型变化趋势表明,甜荞是比苦荞更古老的物种。这是首次使用AFM进行荞麦细胞核型分析的报道。盛茂银[27]以25个甜荞三体种子和栽培品种‘威宁甜荞’为材料,对其有丝分裂中期染色体C带进行核型分析及细胞学鉴定,结果表明:有丝分裂中期,甜荞染色体C带丰富,多态性良好,各同源染色体之间条带差异明显;去壁低渗染色体制片法与BSG显带法首次鉴定出甜荞整套三体材料。史建强等[28]以收集到的5个荞麦野生种为材料,对其进行核型分析,研究其进化地位,结果表明:甜荞近缘种染色体数目为2n=2x=16,核型公式为12M+4m(2SAT);硬枝万年荞染色体数目为2n=2x=16,核型公式为16M;疏穗小野荞染色体数目为2n=2x=16,核型公式为14M+2m(2SAT);细柄野荞染色体数目为2n=4x=32,核型公式为32M;齿翅野荞染色体数目为2n=4x=32,核型公式为30M+2m(2SAT)。
4 荞麦的分子生物学研究
荞麦是小宗粮食作物,其分子生物学研究比较少,但是近年来随着荞麦营养价值和药用价值的发掘,荞麦分子学方面的研究也越来越多。田晓庆等[29]以在12个省份收集到的40份苦荞资源和33份甜荞资源为材料,用56对SSR引物对其遗传多样性进行研究,结果表明:筛选出有多态性的引物17对,平均每对引物扩增出15条带,引物平均位点多态性高达90%;聚类分析结果显示,材料间遗传差异显著,73份材料被分成2大组,33份甜荞被分为一组,40份苦荞被分成另外一组,两者亲缘关系较远。杜晓磊等[30]利用SSR分子标记技术对栽培苦荞及其野生近缘种(F.tataricum ssp.potanini Batalin)杂交得到的F4群体(n=119)进行遗传图谱构建,得到如下结果:构建的连锁图谱包含15个连锁群,共89个SSR标记,每条连锁群上面最少的标记有2个,最多的标记有16个,连锁群长度在6.9~165.8 cM之间,覆盖基因组860.2 cM,总平均长度9.7 cM。史建强等[31]以收集到的81份甜荞、苦荞及其野生种质资源为材料,采用SSR分子标记技术对其进行遗传多样性分析,得到如下结果:19对SSR引物共检测出84对等位基因,81份荞麦品种及其野生资源的相似系数范围是0.500~1.000,聚类分析显示,在遗传相似系数为0.732时,可以将81份荞麦品种分成4类,在遗传相似系数为0.920时,小粒组荞麦种可以被明显区分开。谭萍等[32]对10种栽培苦荞麦进行RAPD研究,结果表明:6个RAPD引物扩增出44条片段,其中18条有遗传多态性,平均每个引物扩增出7.33条带;聚类分析结果显示,各基因型之间的相似系数分布在0.8525~0.9846之间,按亲缘关系远近可以将10份材料分为4类。
Bojka等[33]采用RAPD分子标记研究栽培苦荞和野生苦荞的遗传多样性和他们之间的关系,结果表明:29对RAPD引物在40个荞麦种质资源中共扩增出270条带,平均每条引物扩增出9.3条带,其中有27条引物扩增出151个多态性片段,通过RAPD分析,可以将40份荞麦资源分成2个主要的类群,3个来自四川和青海的野生品种与其他37个资源区分开,遗传相似系数是0.16。Sharma等[34]通过RAPD分子标记技术对荞麦14个种和2个亚种的28份材料进行分析,结果显示:19个RAPD引物共扩增出364条带,平均每个引物扩增出19.15条带,其中有99.45%是有多态性的,引物OPN-08扩增出的条带最多,而引物UBC-183扩增出的条带最少;通过聚类分析,将28份材料分为4类。Yasui等[35]以AFLP分子标记技术对普通荞麦及其野生近缘种杂交产生的F2代群体进行分析,构建遗传连锁图谱,甜荞包含8个连锁图谱,其中包含223个AFLP标记,总覆盖508.3 cM,野生近缘种也包含8个连锁图谱,其中有211个 AFLP标记,总覆盖548.9 cM;3个形态学标记(自交不亲和、落粒性、翅种子)被定位在AFLP图谱上面,自交不亲和性和落粒性相互连锁,被定位在第一张连锁图中间附近的位置,翅种子被定位在第四张连锁图上。Konishi等[36]以甜荞及其野生近缘种杂交得到的F1代为作图群体进行SSR和AFLP分子标记分析,母本包含12张连锁图,共131个标记(54个SSR标记和77个AFLP标记),覆盖距离为911.3 cM,父本同样包含12张连锁图,共71个标记(37个SSR标记和34个AFLP标记),覆盖距离为909.0 cM。Pan等[37]以甜荞品种Fagopyrum esculentum Moench及其野生近缘种F.esculentum var.homotropicum杂交得到的F2代225个单株为研究对象,进行RAPD、STS和种子蛋白质亚基标记,结果得到10个连锁群,包括87个RAPD标记,12个STS标记,4个种子蛋白质亚基标记和3个形态学(花柱异长、落粒性和种子形状)标记,总覆盖遗传距离655.2 cM。Garima等[38]用ISSR分子标记技术对15份苦荞种质资源的遗传多样性和他们之间的关系进行研究,结果表明:13对ISSR引物扩增出的条带显示群体间的多态率高达98.1%,变异系数是0.9750,19对ISSR引物平均PIC为0.812,苦荞的遗传多样性与海拔和基因多样性有显著的关系。Tang等[39]用SSR分子标记对来自四川西部的12个野生荞麦品种和2个栽培荞麦品种的种属进化关系和遗传背景进行分析,结果表明:野生小粒荞麦和大粒荞麦有不同的叶绿体基因及核基因,金荞麦与小粒荞麦和大粒荞麦之间的遗传关系非常复杂;小粒荞麦之间叶绿体基因的遗传多样性比较低,金荞麦种内基因遗传多样性低于大粒荞麦,然而核基因在金荞麦种内和种间、小粒荞麦和大粒荞麦中遗传多样性很高;通过叶绿体SSR及细胞核SSR遗传分析表明:皱叶野荞麦和密毛野荞有较近的亲缘关系。
Cho等[40]利用新一代基因测序技术获得了苦荞的叶绿体基因序列,并将其与先前报道的甜荞的叶绿体基因进行比较,苦荞的叶绿体基因序列全长是159 272 bp,比甜荞叶绿体基因序列短327 bp,苦荞叶绿体基因序列的含量、顺序和方向与甜荞相似,但在串联、反向重复序列和连接处有一些结构变化,在基因间序列和ycf1基因中发现有7个插入和缺失(约100 bp)。在苦荞(4个重复)和甜荞(1个重复)间有21 bp串联重复的拷贝数差异,ycf1基因插入和缺失部分长度为63 bp。
5 小结
目前,国内学者对荞麦资源的遗传多样性进行了一些研究,但对荞麦资源的研究还比较零散,对荞麦属植物资源各种间亲缘关系的争议仍比较大。可能是各研究者所采用的材料不完整,或者种类混杂,或者是野生种不同种群间遗传差异等原因所致。我国是荞麦的主要生产国,西南地区的云南、四川、贵州省一带是苦荞麦的现代分布中心和起源地之一,已经成为苦荞麦及其近缘种种质资源研究和保护的关键地区。笔者认为今后关于荞麦的研究,国内及国外研究者应建立广泛的合作,在保证自身利益的前提下,充分共享各个研究单位收集到的种质资源,为今后荞麦各方面的研究提供原始亲本材料;同时利用已有的荞麦基因组序列,开发重要农艺性状的SSR标记,分析荞麦资源的遗传多样性,为构建荞麦遗传图谱、基因定位及克隆奠定基础。
参考文献:
[1] Kump B,Javornik B.Evaluation of genetic variability among common buckwheat(Fagopyrum esculentum Moench)populations by RAPD markers[J].Plant Sci,1996,114:149-158.
[2] Ohsako T,Yamane K,Ohnishi O.Two new Fagopyrum(polygonaceae) species, F.gracilipedoides and F.jinshaense from Yunnan,China[J].Genes Genet Syst,2002,77:399-408.
[3] Ohnishi O,Matsuoka Y.Search for the wild ancestor of buckwheat II.Taxonomy of Fagopyrum(Polygonaceae)species based onmorphology,isozymes and cpDNA variability[J].Genes Genet Syst,1996,71:383-390.
[4] Jeon YJ,Kang ES,Hong KW.PCR methods for rapid detection of buckwheat ingredients in food[J].J Korean Soc Appl Biol Chem,2007,50:276-280.
[5] Chang KJ,Seo GS,Kim YS,etal.Components and biological effects fermented extract from tartary buckwheat sprouts[J].Korean JPlant Res,2010,23:131-137.
[6] Bonafaccia G,Marocchini M,Kreft I.Composition and technological properties of the flour and bran from common and tartary buckwheat[J].Food Chem,2003,80:9-15.
[7] Fabjan JN,Rode I,Kosir J,et al.Tartary buckwheat(Fagopyrum tataricum L.Gaertn)as a source of dietary rutin and quercitin[J].J Agri Food Chem,2003,51:6452-6455.
[8] Kim JK,Kim SK.Physiochemical properties of buckwheat starches from different areas[J].Korean J Food Sci Technol,2004,36:598-603.
[9] 任长忠,赵 钢.中国荞麦学[M].北京:中国农业出版社,2015.
[10]李淑久,张惠珍,袁庆军,等.四种荞麦营养器官的形态学与解剖学比较研究[J].贵州农业科学,1992(5):10-14.
[11]李淑久,张惠珍,袁庆军.四种荞麦生殖器官的形态学研究[J].贵州农业科学,1992(6):32-36.
[12]张小燕,苏 敏,卢宗凡,等.荞麦品种资源聚类分析[J].西北农业学报,2000(2):121-124.
[13]岳 鹏,黄凯丰,陈庆富.普通荞麦落粒性、尖果、红色茎秆的遗传规律研究[J].河南农业科学,2012(1):28-31.
[14]邓 蓉,向清华,王安娜,等.11份野生金荞麦资源的性状表现与聚类分析[J].贵州农业科学,2014(4):36-41.
[15]周忠泽,赵佐成,汪旭莹,等.中国荞麦属花粉形态及花被片和果实微形态特征的研究[J].植物分类学报,2003,41(1):63-78.
[16]边巴卓玛.西藏引种荞麦品种主要农艺性状与产量的相关和通径分析[J].西藏农业科技,2014,36(2):30-38.
[17]阮培均,王孝华,赵明勇,等.14份野生金荞麦的性状观测[J].贵州农业科学,2014(3):14-17.
[18]郭菊卉,石桃雄,黄凯丰,等.普通荞麦重组自交系(RIL)主要农艺性状的相关与通径分析[J].西南农业学报,2014(2):518-522.
[19]杨明君,郭忠贤,陈有清,等.苦荞麦主要经济性状遗传参数研究[J].内蒙古农业科技,2005(5):19-20.
[20]朱凤绥.荞麦不同类型染色体研究初报[J].细胞生物杂志,1984(3):130-131.
[21]朱必才,高立荣.同源四倍体荞麦的研究[J].遗传,1988,10(6):6-8.
[22]朱必才,田先华,高立荣.同源四倍体荞麦的细胞遗传学研究[J].遗传,1992,14(1):1-4.
[23]张长顺.荞麦染色体G-带BrdU-风油精法显带的研究[J].生物学杂志,1997,14(4):27-28.
[24]王建胜,柴 岩,赵喜特,等.中国荞麦栽培品种的核型比较分析[J].西北植物学报,2005,25(6):1114-1117.
[25]刘建林,唐 宇,邵继荣,等.荞麦属2个野生荞麦种的染色体核型研究[J].西北植物学报,2009,29(9):1798-1803.
[26] Neethirajan S,Hirose T,Wakayama J,et al.Karyotype analysis of buckwheat using atomic for cemicroscopy[J].Microsc Microanal,2011,17(4):572-577.
[27]盛茂银.甜荞整套三体材料的染色体C带鉴定[J].广东农业科学,2013(14):147-150.
[28]史建强,李艳琴,张宗文,等.荞麦野生种的核型及进化特征分析[J].植物遗传资源学报,2016,17(3):455-460.
[29]田晓庆,徐宏亚,汪 灿,等.用SSR标记分析荞麦栽培种质资源的遗传多样性[J].作物杂志,2013(5):28-33.
[30]杜晓磊,张宗文,吴 斌,等.苦荞SSR分子遗传图谱的构建及分析[J].中国农学通报,2013,29(21):61-65.
[31]史建强,李艳琴,张宗文,等.荞麦及其野生种遗传多样性分析[J].植物遗传资源学报,2015,16(3):443-450.
[32]谭 萍,王玉株,李红宁,等.十种栽培苦荞麦的随机扩增多态性 DNA(RAPD)研究[J].种子,2006,25(7):46-49.
[33] Bojka K,Branka J.Genetic diversity and relationships among cultivated and wild accessions of tartary buckwheat(Fagopyrum tataricum Gaertn.)as revealed by RAPD markers[J].Genetic Resources and Crop Evolution,2002,49:565-572.
[34] Sharma TR,Jana S.Species relationships in Fagopyrum revealed by PCR-based DNA fingerprinting[J].Theor Appl Genet,2002,105:306-312.
[35] Yasui Y,Wang Y,Ohnishi O,et al.Amplified fragment length polymorphism linkage analysis of common buckwheat(Fagopyrum esculentum)and its wild self-pollinated relative Fagopyrum homotropicum [J].Genome,2004,47(2):345-351.
[36] Konishi T,Ohnishi O.A linkage map for common buckwheat based on microsatellite and AFLP markers[J].Fagopyrum,2006,23:1-6.
[37] Pan SJ,Chen QF.Genetic mapping of common buckwheat using DNA,protein and morphologicalmarkers[J].Hereditas,2010,147:27-33.
[38] Garima K,Anjana P,Rajendra D,etal.Population genetic study of Fagopyrum tataricum from western himalaya using ISSR markers[J].Biochem Genet,2013,51:750-765.
[39] Tang ZZ,Huang L,Guo JB,et al.Genetic relationships among buckwheat(Fagopyrum)species from southwest China based on chloroplast and nuclear SSR markers[J].Journal of Genetics,2014,93(3):849-853.
[40] Cho KS,Yun BK,Yoon YH,et al.Complete chloroplast genome sequence of tartary buckwheat(Fagopyrum tataricum)and comparative analysis with common buckwheat(F.esculentum)[J].PLoS One,2015,10(5):e0125332.

