胆道闭锁术后胆管炎的病原菌分布特点及药敏分析
陈峋 苏海霞 陈秀奇 吴思霞
广西医科大学第一附属医院儿科(南宁 530021)
胆道闭锁是婴儿常见的胆道系统进行性疾病,发病率约为1/5 000,且预后差[1]。至今,肝门-空肠吻合术(Kasai术)仍是治疗胆道闭锁的首选术式。术后患儿的生存情况明显改善,5年生存率可达50%~60%,甚至有15%~20%左右的患儿可以生存至成年以后[2-3],但仍有70%~80%的患儿因为胆管炎和肝脏纤维化最终需肝移植[4]。胆管炎是Kasai术后的主要并发症,大部分的患儿在术后1年内发作,部分患儿可每年出现反复发作[5]。感染是引起Kasai术后胆管炎的一个重要原因[6]。随着抗生素耐药问题的不断严峻,以及术后胆管炎反复发作导致病原菌分布的改变,如何选用合适的抗生素成为治疗Kasai术后胆管炎的关键。基于以上,本研究对我院近10年来Kasai术后胆管炎患儿进行总结,分析其病原菌分布特点及抗生素的敏感性。
1 资料与方法
1.1一般资料选取本院2007-2016年收治的300例先天性胆道闭锁Kasai术后出现胆管炎患儿。Kasai术后胆管炎诊断标准:(1)患儿出现发热,在排除其他原因之后;(2)伴有以下表现之一即可诊断[7]:不能解释原因的烦躁、哭闹及腹胀;黄疸退而复现或进行性加重,胆红素升高;大便呈陶土样或颜色变浅;炎症指标升高。其中男164例,女136例;手术日龄最小40 d,最大7个月。胆管炎的分类[7]:将手术后1个月内发生的胆管炎称为早期胆管炎;1个月后发生的胆管炎称为晚期胆管炎。将术后胆管炎半年内发作3次及以上称为频发胆管炎;少于3次为偶发胆管炎。
1.2血培养资料对诊断胆管炎患儿在使用静脉抗生素前均行一次血培养检查,之后给予经验性抗生素治疗,对初始抗感染48~72 h后体温无下降趋势的再根据临床用药反应和血培养药敏结果调整抗生素方案。收集血培养阳性病例数,统计病原菌分布特点及其对抗生素的敏感情况。抗感染治疗后,以患儿发热、黄疸症状缓解,血常规、CRP、降钙素原等指标下降做为治疗有效的评估指标。
1.3统计学方法采用SPSS 17.0统计学软件进行统计分析。计数资料以率(%)表示,组间比较采用χ2检验或确切概率法。P<0.05表示差异有统计学意义。
2 结果
2.1所纳入研究对象分类情况300例中偶发胆管炎为202例,频发胆管炎为98例;早期胆管炎为166例,晚期胆管炎为134例。
2.2血培养结果及药敏情况300例先天性胆道闭锁Kasai术后胆管炎患儿共发作541次,均行血培养,其中结果阳性128次,阳性率为23.7%。血培养常见菌依次为大肠埃希菌44次,铜绿假单胞菌37次,肠球菌16次(包括屎肠球菌5次,粪肠球菌11次),鲍曼不动杆菌14次,阴沟肠杆菌8次,真菌3次(白色念珠菌)(表1)。其余6次(肺炎克雷伯菌2次、表皮葡萄球菌2次、嗜麦芽窄食单胞菌1次、棒状杆菌1次)。
2.3Kasai术后胆管炎病原菌构成前后5年比较情况见表2。
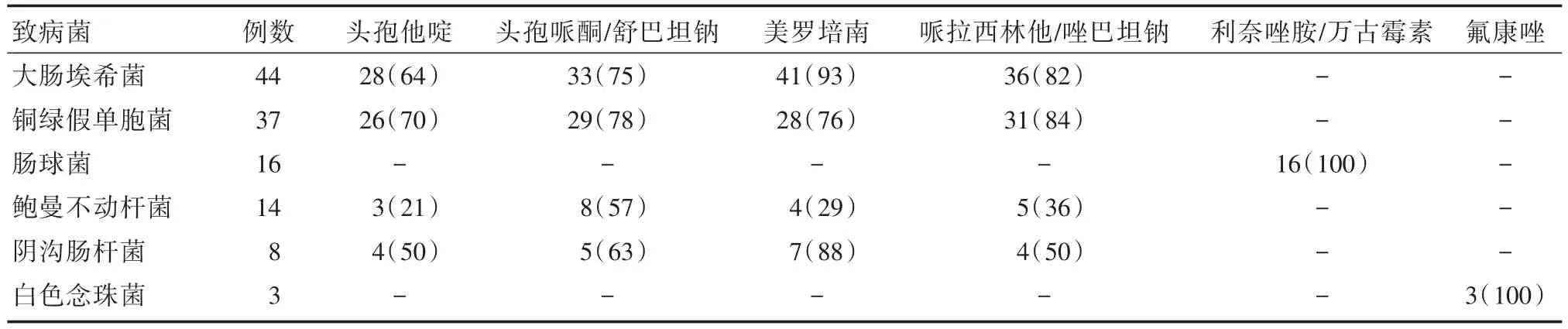
表1 血培养主要致病菌及抗生素敏感情况Tab.1 The main pathogens of blood culture and antibiotic susceptibility 例(%)
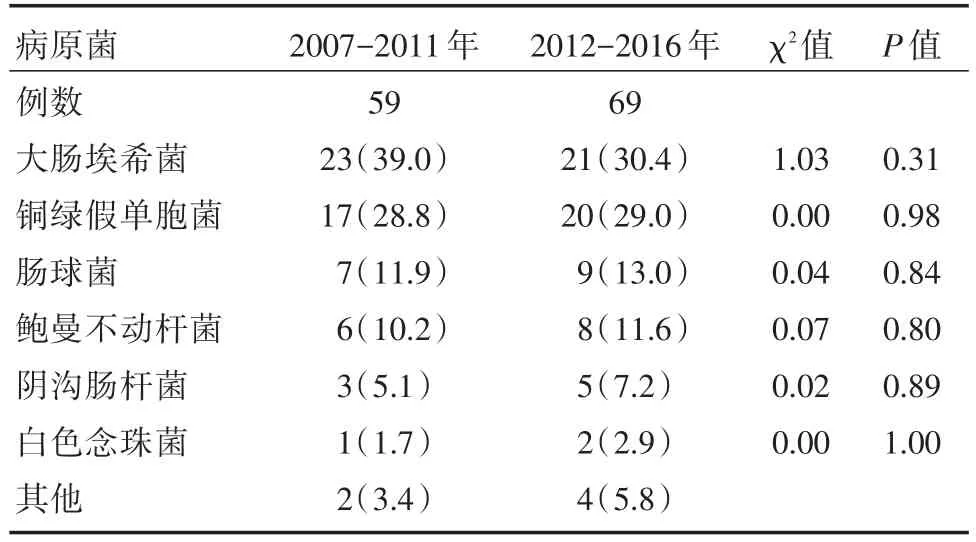
表2 Kasai术后胆管炎病原菌构成前后5年比较Tab.2 The Comparison of Kasai postoperative cholangitis pathogen formation before and after 5 years 例(%)
2.4根据胆管炎的临床分类不同类型的胆管炎其病原学谱有所区别。见表3。
3 讨论
Kasai术后胆管炎的发生率达50%左右[8],多数患儿在术后1年内发作[9]。其严重程度与治疗是否及时有关,直接影响患儿的远期预后,是决定长期生存的重要因素之一。因此早期诊断、积极的治疗术后胆管炎,对于改善Kasai术后患儿的预后有重要意义。胆管炎的发病机制目前仍有争议,可能与肝内胆管发育不良致胆道不全梗阻、胆汁引流欠通畅所致胆汁排出量不足、自身免疫应答异常、肝门空肠吻合术后细菌移位、肠道蠕动紊乱内容物反流导致上行感染等多种易感因素有关[10]。Kasai术后胆管炎出现胆管上皮细胞损伤,可进一步加重肝门部胆管梗阻,加重胆汁淤积性肝硬化及促进肝脏纤维化进程[11-12]。因此及时使用抗生素控制感染,缓解胆管炎症状,可以争取患儿自体肝长期存活的机会,提高生存质量。
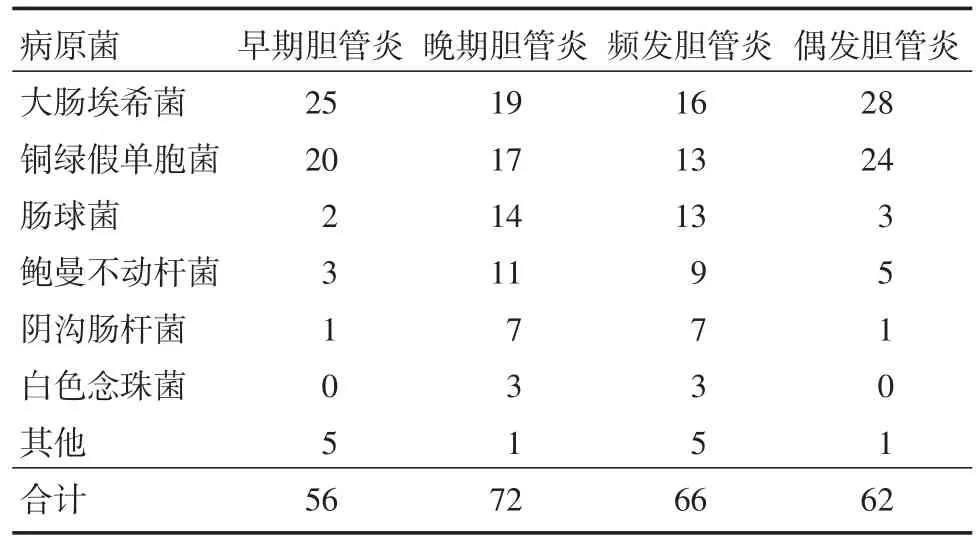
表3 早期胆管炎与晚期胆管炎、频发胆管炎与偶发胆管炎原菌构成对比Tab.3 The comparison of pathogen formation between early cholangitis and advanced cholangitis、frequent cholangitis and occasional cholangitis例
由于Kasai术后无菌的胆道直接暴露于肠道系统,故引起其胆管炎的病原体多为肠道细菌上行性的需氧和或厌氧菌的混合感染,以革兰阴性杆菌为主,其中以大肠埃希菌最多见[13]。在本研究中血培养出大肠埃希菌44例,占全部阳性结果比例为34.4%,与文献报道相符[14]。然而值得注意的是随着抗生素的广泛应用,条件致病菌的比例不断上升,尤其是肠球菌[15-16]。本文肠球菌的比例位居第三,病原菌构成前后5年、早期胆管炎与晚期胆管炎、偶发胆管炎与频发胆管炎比较,均以大肠埃希菌、铜绿假单胞菌及肠球菌多见[17]。大肠埃希菌和铜绿假单胞菌常见于偶发胆管炎,肠球菌常见于频发胆管炎。因为随着时间推移,肠道细菌移位以及大量使用广谱抗生素,导致细菌的耐药质粒相互交叉传染,从而出现耐药菌株和条件致病菌感染比例也随之大幅度升高。
Kasai术后胆管炎如何选择合适的抗生素?由于Kasai术后胆管炎以革兰阴性杆菌为主,既往认为二代头孢联合氨基糖甙类抗生素可做为主要选择[18]。但目前临床上三代头孢菌素头孢哌酮舒巴坦是经验首选用药,可能与细菌谱的改变及抗生素耐药问题有关。而WONG等[19]报道头孢哌酮舒巴坦治疗Kasai术后胆管炎的敏感性已从89%降至75%。本文大肠埃希菌、铜绿假单胞菌对头孢哌酮舒巴坦的敏感度分别为:75%、78%,表明头孢哌酮舒巴坦仍可做为首选抗生素。此外,本研究还发现大肠埃希菌、铜绿假单胞菌对哌拉西林他唑巴坦的敏感度分别为:82%、84%,这与国内报道一致[20],表明在不适合使用头孢哌酮舒巴坦的时候(例如头孢类抗生素过敏)可备用哌拉西林他唑巴坦抗感染治疗。
另外,本研究中发现随着时间推移,部分患儿出现频发胆管炎,且治疗效果欠佳。WONG等[19]在研究中发现头孢哌酮舒巴坦治疗失败后改用美罗培南能获得较好疗效。IKAWA等[21]研究美罗培南药代动力学表明其在胆汁中的药物浓度高,对胆道感染的大肠杆菌,肺炎克雷伯菌和阴沟肠杆菌等杀菌力强。国内有报道Kasai术后反复发作胆管炎患儿,美罗培南可作为经验首选用药[20]。国外文献报道美罗培南抗菌谱广,不易产生耐药性,对革兰阳性、革兰阴性需氧菌及厌氧菌均有强力的抗菌活性,可作为治疗胆管炎的一线用药[18]。本文大肠埃希菌和铜绿假单胞菌对美罗培南的敏感度分别为93%、76%。因此,对于Kasai术后胆管炎患儿如经头孢哌酮舒巴坦或哌拉西林他唑巴坦治疗效果欠佳,可选用美罗培南抗感染。
本研究中频发胆管炎和晚期胆管炎肠球菌和鲍曼不动杆菌的比例明显上升。导致该抗菌谱变化的主要原因可能与长期使用抗生素导致条件致病菌占优势有关。鲍曼不动杆菌由于其获得耐药性和克隆传播的能力,已呈世界性流行[22-23]。CHINET中国细菌耐药性监测网2016年上半年报告:鲍曼不动杆菌对头孢他啶、头孢哌酮舒巴坦、哌拉西林他唑巴坦及美罗培南的敏感率分别为:29%、57%、33%及29%[24]。本研究结果显示对以上细菌的药物敏感率分别为:21%、57%、36%及29%。因此如果血培养阳性且临床考虑胆管炎为鲍曼不动杆菌感染所致,经单独应用头孢哌酮舒巴坦、哌拉西林他唑巴坦或美罗培南治疗效果不佳时,应及时联合其他抗生素(如:米诺环素、多粘菌素、左氧氟沙星等)加强抗感染[23]。此外,随着胆管炎发作次数增加、宿主免疫力低下及抗生素长期大量使用,革兰阳性菌所占比例已逐年上升,且主要为肠球菌[15-16,20]。本研究血培养出肠球菌16次(包括屎肠球菌5次,粪肠球菌11次),在频发胆管炎和晚发胆管炎的抗菌谱中居第3位。由于肠球菌固有耐药、获得性耐药特性导致其对多种抗生素耐药,但对万古霉素和利奈唑胺仍较敏感[25-26]。CHINET中国细菌耐药性监测网2016年上半年报告:利奈唑胺(屎肠球菌耐药率为0.2%,粪肠球菌耐药率为1.2%),万古霉素(屎肠球菌耐药率为1.9%,粪肠球菌耐药率为0.4%)[24]。本研究肠球菌对万古霉素和利奈唑胺敏感性均为100%,是目前肠球菌的首选抗生素。
此外,胆道闭锁术后激素的长期应用,以及术后反复胆管炎导致广谱抗生素的不断升级等原因,使得深部真菌感染日益增多。当血培养出真菌,葡聚糖检测、半乳甘露聚糖检测阳性,需警惕真菌感染。本研究显示真菌感染以白色念珠菌多见,对氟康唑敏感度高,可做为首选用药。
本研究所选的对象有一定的欠缺,均未行胆汁细菌培养,是因为这类标本获取较困难,实施的成本高,在以后的研究中应注意该标本的收集,提高阳性率,得到更全面、更详细的理论依据,进一步指导临床,为胆道闭锁患儿提供更好的治疗。
综上所述,治疗Kasai术后胆管炎尽早进行细菌培养及药敏试验。结果未回之前可将头孢哌酮舒巴坦或哌拉西林他唑巴坦做为首选抗生素覆盖大肠埃希菌和铜绿假单胞菌,当治疗效果欠佳时应及时更换美罗培南抗感染或根据药敏结果调整治疗方案。晚期胆管炎和频发胆管炎需警惕肠球菌感染。
[1]TYRASKIS A,DAVENPORT M.Steroids after the Kasai proce⁃dure for biliary atresia:the effect of age at Kasai portoenterosto⁃my[J].Pediatr Surg Int,2016,32(3):193⁃200.
[2]DE V W,DELANGEN Z J,GROEN H,et al.Biliary atresia in the Netherlands:outcome of patients diagnosed between 1987 and 2008[J].J Pediatr,2012,160(4):638⁃644.
[3]LIEN T H,CHANG M H,WU J F,et al.Effects of the infant stool color card screening program on 5⁃year outcome of biliary atresia in Taiwan[J].Hepatology,2011,53(1):202.
[4]SUPERINA R,MAGEE J C,BRANDT M L,et al.The ana⁃tomic pattern of biliary atresia identified at time of Kasai hepato⁃portoenterostomy and early postoperative clearance of jaundice are significant predictors of transplant⁃free survival[J].Ann Surg,2011,254(4):577⁃585.
[5]SUNDARAM S S,MACK C L,FELDMAN A G,et al.Biliary atresia:indications and timing of liver transplantation and opti⁃mization of pretransplant care[J].Liver Transplantation,2017,23(1):96⁃109.
[6]CHUNG P H,WONG K K,TAM P K.Predictors for failure af⁃ter Kasai operation[J].J Pediatr Surg,2015,50(2):293⁃296.
[7]郭鑫,孙雪,任红霞.102例胆道闭锁Kasai术后胆管炎分析[J].临床小儿外科杂志,2017,16(2):146⁃150.
[8]SHI C R.Current condition of clinical research of congenital bil⁃iary atresia[J].J Appl Clin Pediatr,2008,23(23):1802 ⁃1803.
[9]LUO Y,ZHENG S.Current concept about postoperative cholan⁃gitis in biliary atresia[J].World J Pediatr,2008,4(1):14⁃19.
[10]赵开飞,李昌燕,利峰,等.经皮肝穿胆道引流术治疗急性梗阻性化脓性胆管炎46例[J].实用医学杂志,2013,29(14):2355⁃2356.
[11]YANG L Y,FU J,PENG X F,et al.Validation of aspartate aminotransferase to platelet ratio for diagnosis of liver fibrosis and prediction of postoperative prognosis in infants with biliary atresia[J].World J Gastroenterol,2015,21(19):5893⁃5900.
[12]LIEN T H,BU L N,WU J F,et al.Use of lactobacillus casei rhamnosus to prevent cholangitis in biliary atresia after kasai operation[J].J Pediatr Gastroenterol Nutr,2015,60(5):654⁃658.
[13]LUO Q,HAO F,ZHANG M,et al.Serum bacterial DNA de⁃tection in patients with cholangitis after Kasai procedure.[J].Pediatrics International,2015,57(5):954⁃960.
[14]SCHNEIDER J,DE W P,HAPFELMEIER A,et al.Risk fac⁃tors for increased antimicrobial resistance:a retrospective anal⁃ysis of 309 acute cholangitis episodes[J].J Antimicrobl Che⁃mother,2014,69(2):519⁃525.
[15]CHRISTIAN R,KONRAD B,HEINZ W K,et al.Microbiolog⁃ical assessment of bile and corresponding antibiotic treatment:A strobe⁃compliant observational study of 1401 endoscopic retro⁃grade cholangiographies[J].Medicine,2016,95(10):2390.
[16]BORNSCHEUER T,SCHMIEDEL S.Calculated antibiosis of acute cholangitis and cholecystitis[J].Viszeralmedizin,2014,30(5):297⁃302.
[17]LEE J Y,LIM L T,QUAK S H,et al.Cholangitis in children with biliary atresia:Health⁃care resource utilisation[J].J Pae⁃diatr Child Health,2014,50(3):196⁃201.
[18]KATAWAETEE D,LEYS C M,WEST K W,et al.Prophylac⁃tic antibiotics for prevention of cholangitis in patients with bili⁃ary atresia status post⁃kasai portoenterostomy:A systematic re⁃view[J].Clin Pediatr,2016,55(1):66⁃72.
[19]WONG K K,FAN A H,LAN L C,et al.Effective antibiotic regime for postoperative acute cholangitis in biliary atresia⁃⁃an evolving scene[J].J Pediatr Surg,2004,39(12):1800⁃1802.
[20]余梦楠,刘钢,黄柳明,等.胆道闭锁术后反复发作性胆管炎的细菌谱分析及抗生素选择[J].临床小儿外科杂志,2012,11(3):187⁃189.
[21]IKAWA K,NAKASHIMA A,MORIKAWA N,et al.Clinical pharmacokinetics of meropenem and biapenem in bile and dos⁃ing considerations for biliary tract infections based on site⁃spe⁃cific pharmacodynamic targetattainment [J].Antimicrob Agents Chemother,2011,55(12):5609⁃5615.
[22]PELEG A Y,SEIFERT H,PATERSON D L.Acinetobacter baumannii:Emergence of a successful pathogen[J].Clin Mi⁃crobiol Rev,2008,21(3):538⁃582.
[23]YANG Y S,LEE Y,TSENG K C,et al.In Vivo and In Vitro efficacy of minocycline⁃based combination therapy for minocy⁃cline ⁃Resistant Acinetobacter baumannii.[J].Antimicrob Agents Chemother,2016,60(7):4047⁃4054.
[24]胡付品,郭燕,朱德妹,等.2016年上半年CHINET中国细菌耐药性监测报告.中国细菌耐药性监测协作网(CHINET).http://www.chinets.com.
[25]耐万古霉素肠球菌感染防治专家委员会.耐万古霉素肠球菌感染防治专家共识[J].中华实验和临床感染病杂志:电子版,2010,4(2):60⁃64.
[26]刘林森,毕建钢,张卓,等.梗阻性黄疸在内镜引导下安置胆胰管双支架治疗的安全性探讨[J].现代医院,2017,17(3):384⁃386.

