酪醇酯类衍生物的合成方法学研究
耿晓宇,张露云,徐 倩,丛 丽,王 雨,臧 皓
酪醇(Tyrosol,1)又名对羟基苯乙醇,是红景天苷的苷元[1],也是橄榄油中含有的主要酚类化合物之一[2].因其较强的抗氧化能力而具有多种药理作用,擅长清除毒性大的羟基自由基[3],可拮抗β-淀粉样蛋白和抑制多巴胺能神经元细胞凋亡,从而有效地预防阿尔茨海默病和帕金森病[4-5];还可以有效地延长寿命[6],保护心脏[7]以及预防肿瘤的发生[8-9].酪醇性质温和,几乎没有毒副作用,在医药和食品领域具有广阔的应用前景,近年来受到了广泛关注.然而因药物动力学表现欠佳阻碍了酪醇的实际应用,因此,对其进行结构修饰是药物化学领域的研究热点,研究主要集中在合成酪醇酯类衍生物方面[10-14].酪醇结构中含有一个醇羟基和一个酚羟基,一般的合成方法是对酚羟基进行保护,与有机酸反应成酯再脱保护得到目标化合物,反应步骤较长,收率较低[11-13].为了简洁地合成酪醇衍生物,本文拟建立一种新型的具有化学选择性的酯化方法,无需进行酚羟基保护,直接一步反应得到目标化合物,此方法应具有步骤短、选择性好、收率高等特点.
1 实验部分
1.1 试剂与仪器
酪醇(纯度98%)、三苯基膦(TPP,纯度98%)、偶氮二甲酸二异丙酯(DIAD,纯度97%)、二环己基碳二亚胺(DCC,纯度98%)、4-二甲氨基吡啶(4-DMAP,纯度98%)、N-羟基丁二酰亚胺(NHS,纯度98%)、3,4,5-三甲氧基肉桂酸(纯度98%)、无水四氢呋喃(THF,纯度99.5%)均购自萨恩化学技术有限公司;苯甲酸(纯度99.5%)、对甲苯甲酸(纯度98%)、肉桂酸(纯度99%)均购自阿拉丁生化科技股份有限公司;乙酸乙酯(纯度99.5%)、石油醚(沸程60~90℃)均购自国药集团化学试剂有限公司,硫酸(H2SO4)购自天津市科密欧化学试剂有限公司.
YRT-3型熔点仪(天津天光光学仪器有限公司);Bruker-600型核磁共振波谱仪(CDCl3和DMSO-d6为溶剂,TMS为内标,德国Bruker公司);Q-TOF-MS6520型质谱仪(美国Agilent公司);DFY-5型低温反应浴槽(巩义市英峪高科仪器厂);2XZ-2C型真空泵(临海市谭氏真空设备有限公司);FA1104N型电子分析天平(上海菁海仪器有限公司).
1.2 实验过程
1.2.1苯甲酸酪醇酯(3a)的合成路线
采用四条路线合成化合物3a,具体操作方法如下:
路线①将苯甲酸(0.4mmol)、酪醇(0.4mmol)放入干燥的Schlenk管中,加入THF(1.0mL),再加入H2SO4(50μL),室温反应12h后薄层色谱检测.
路线②将苯甲酸(0.4mmol)、酪醇(0.4mmol)、TPP(0.4mmol)于 N2条件下放入干燥的 Schlenk管中,加入 THF(1.0mL),于 0℃下加入 DIAD(0.4mmol),室温反应12h后薄层色谱检测.
路线③将苯甲酸(0.4mmol)、DCC(0.4mmol)、NHS(0.4mmol)放入干燥的 Schlenk 管中,加入THF(1.0mL)后活化12h,随后加入酪醇(0.4mmol),室温反应12h后薄层色谱检测.
路线④将苯甲酸(0.4mmol)、DCC(0.4mmol)、DMAP(0.04mmol)放入干燥的Schlenk管中,加入THF(1.0mL)后 活 化 12h,随 后 加 入 酪 醇(0.4mmol),室温反应12h后薄层色谱检测.
经过分析薄层板,确定路线②为化合物3a的合成路线.
1.2.2合成方法的确立
在路线②的基础上对反应时间进行考察,分别考察了12h、24h、36h、48h和60h时化合物3a的收率,确定反应时间为48h,收率为92%,结果见表1.
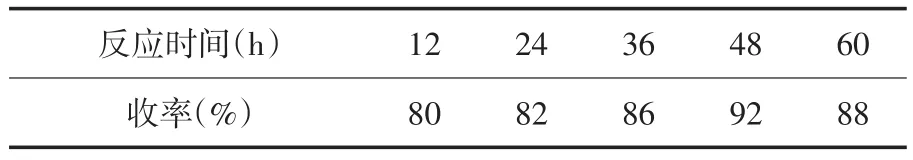
表1 不同反应时间3a的收率
1.2.3合成方法的应用
应用建立的合成方法合成了苯甲酸酪醇酯(3a)、对甲苯甲酸酪醇酯(3b)、肉桂酸酪醇酯(3c)和3,4,5-三甲氧基肉桂酸酪醇酯(3d),合成路线见图1,收率分别为92%、97%、90%、88%,化合物3a-3d经核磁共振波谱和高分辨质谱确证均为目标化合物,数据如下.
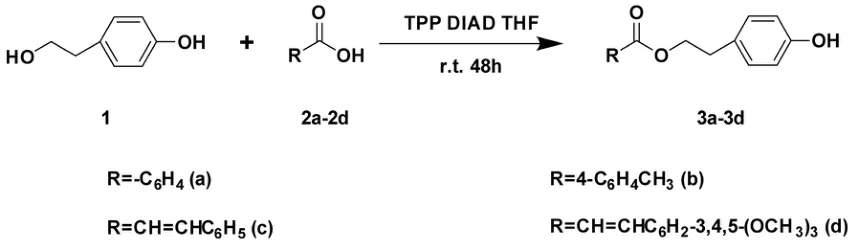
图1 化合物3a-3d的合成路线
化合物3a,白色固体,收率92%;m.p.73-76℃.1H-NMR(CDCl3,600MHz,ppm):8.00(t,2H),7.52(s,1H),7.39(t,2H),7.09(d,J=8.4Hz,2H),6.82(d,J=8.4Hz,2H),6.66(s,1H,-OH),4.47(t,2H),2.97(t,2H).13C-NMR(CDCl3,150MHz,ppm):δ 167.2,154.6,133.0,129.9,129.9,129.9,129.5,129.5,129.3,128.3,128.3,115.4,115.4,66.0,34.2;MS m/z:265.0419(M+Na).
化合物3b,白色固体,收率97%;m.p.142–144℃.1H-NMR(CDCl3,600MHz,ppm):7.90(d,J=8.4Hz,2H),7.22(d,J=8.4Hz,2H),7.12(d,J=8.4Hz,2H),6.79(d,J=8.4Hz,2H),5.45(s,1H,-OH),4.47(t,J=6.6Hz,2H),2.99(t,J=6.6Hz,2H).13C-NMR(CDCl3,150MHz,ppm):δ166.9,154.4,143.7,130.1,130.1,129.8,129.6,129.6,129.1,129.1,127.4,115.4,115.4,65.7,34.3,21.6;279.0583(M+Na).
化合物3c,白色固体,收率90%;m.p.129–131℃.1H-NMR(DMSO-d6,600MHz,ppm):9.22(s,1H,-OH),7.70(d,2H),7.63(d,J=16.2Hz,1H),7.42(s,3H),7.07(d,J=7.2Hz,2H),6.70(d,J=7.2Hz,2H),6.61(d,J=16.2Hz,1H),4.28(s,2H),2.84(s,2H).13C-NMR(DMSO-d6,150MHz,ppm):δ166.1,155.9,144.5,134.0,130.4,129.7,129.7,128.9,128.9,128.3,128.3,127.8,118.0,115.2,115.2,64.9,33.6;MS m/z:291.0674(M+Na).
化合物3d,浅黄色固体,收率88%;m.p.79–80℃.1H-NMR(CDCl3,600MHz,ppm):7.59(d,J=16.2Hz,1H),7.10(d,J=8.4Hz,2H),6.81(d,J=8.4Hz,2H),6.74(s,2H),6.34(d,J=16.2Hz,1H),6.31(s,1H,-OH),4.39(t,2H),3.88(s,3H,-OCH3),3.87(s,6H,-OCH3),2.94(s,2H).13C-NMR(CDCl3,150MHz,ppm):δ167.2,154.7,153.3,153.3,145.0,140.0,129.9,129.9,129.8,129.3,117.1,115.4,115.4,105.3,105.3,65.4,60.9,56.1,56.1,34.2;MS m/z:381.0887(M+Na).
2 实验结果与讨论
2.1 化合物3a合成路线的确定
上述四种合成路线反应结束后采用薄层色谱法检测,结果见图2,通过对原料与产物的比对分析,确认路线①、路线②和路线④共有点为目标点,将路线②反应液蒸干,硅胶柱层析分离得到白色固体,经核磁共振波谱和高分辨质谱确证为目标化合物.
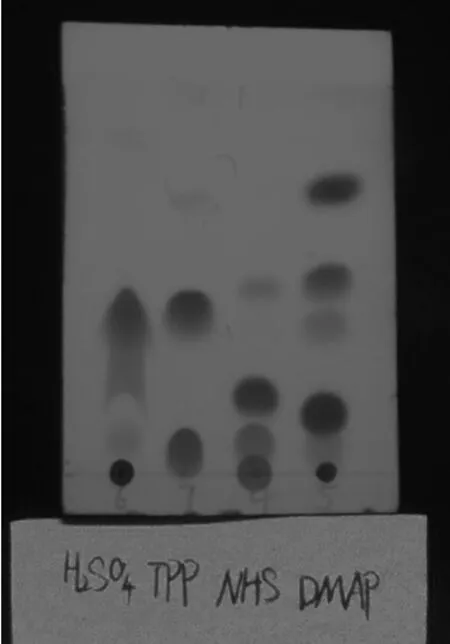
图2 四种合成方法薄层色谱检测结果
从薄层板上来看,路线③未生成3a,因此首先放弃;路线①生成了目标化合物,但是硫酸危险且生成的杂质点与目标化合物难以分开,因此未选用此路线;路线④也生成了3a,但是从薄层板上判断其收率不高,杂质众多,相邻杂质难以除去,纯化困难,故放弃此方法;路线②在薄层板上只有两个斑点,杂质较少,斑点间距较远易于纯化,且收率较高,因此综合考虑,选用路线②作为3a的合成路线.
2.2 化合物3a合成路线的优化
从表1中可以看出,反应12h时3a的收率为80%,收率不错,但根据经验判断反应未完全,故延长反应时间观察收率的变化,确定了反应时间为48h时收率最高,为92%,不足48h均未反应完全,超过48h则副反应增多,收率下降.考虑到收率已经很高,固未对其他反应条件进行优化.
3 结论
本研究建立的合成方法是新型的具有化学选择性的酯化方法,无需进行酚羟基保护,直接一步反应得到了目标化合物,该方法具有步骤短、选择性好、收率较高和反应条件温和等优点,应用此方法又高收率地合成了3个酪醇酯类衍生物,这也为酪醇酯类衍生物的合成提供了新的方法和依据.
参考文献:
[1]Li T,He X.Quantitative analysis of salidroside and p-Tyrosol in the traditional Tibetan medicine Rhodiola cren⁃ulata by fourier transform near-infrared spectroscopy[J].Chem Pharm Bull,2016,64(4):289-296.
[2]Servili M,Esposto S,Fabiani R,et al.Phenolic compounds in olive oil:antioxidant,health and organoleptic activities according to their chemical structure[J].Inflam⁃mopharmacology,2009,17(2):76-84.
[3]马天翔,史宁,陈乾,等.红景天中8种成分体外抗氧化作用的比较[J].中国药理学通报,2012,28(9):1224-1228.
[4]St-Laurent-Thibault C,Arseneault M,Longpre F,et al.Tyrosol and hydroxytyrosol,two main components of ol⁃ive oil,protect N2a cells against amyloid-β-induced toxici⁃ty.Involvement of the NF-κB signaling[J].Curr Alzheimer Res,2011,8(5):543-551.
[5]Dewapriya P,Himaya SW,Li YX,et al.Tyrosol ex⁃erts a protective effect against dopaminergic neuronal cell death in in vitro model of Parkinson’s disease[J].Food Chem,2013,141(2):1147-1157.
[6]Canuelo A,Gilbert-Lopez B,Pacheco-Linan P,et al.Tyrosol,a main phenol present in extra virgin olive oil,increases lifespan and stress resistance in Caenorhabditis el⁃egans[J].Thromb Res,2012,133(8):563-574.
[7]Sun L,Fan H,Yang L,et al.Tyrosol prevents isch⁃emia/reperfusion-induced cardiac injury in H9c2 cells:in⁃volvement of ROS,Hsp70,JNK and ERK,and apoptosis[J].Molecules,2015,20(3):3758-3775.
[8]Tripoli E,Giammanco M,Tabacchi G,et al.The phenolic compounds of olive oil:structure,biological activi⁃ty and beneficial effects on human health[J].Nutr Res Rev,2005,18(1):98-112.
[9]Ahn EY,Jiang Y,Zhang Y,et al.Cytotoxicity of p-tyrosol and its derivatives may correlate with the inhibi⁃tion of DNA replication initiation[J].Oncol Rep,2008,19(2):527-534.
[10]Busnena BA,Foudah AI,Melancon T,et al.Olive secoiridoids and semisynthetic bioisostere analogues for the control of metastatic breast cancer[J].Bioorg Med Chem,2013,21(7):2117-2127.
[11]Mateos R,Trujillo M,Pereira-Caro G,et al.New lipophilic tyrosyl esters.Comparative antioxidant evaluation with hydroxytyrosyl esters[J].J Agric Food Chem,2008,56(22):10960-10966.
[12]Lee CW,Son EM,Kim HS,et al.Synthetic tyrosyl gallate derivatives as potent melanin formation inhibitors[J].Bioorg Med Chem Lett,2007,17(19):5462-5464.
[13]Belmonte-Reche E,Martinez-Garcia M,Penalver P,et al.Tyrosol and hydroxytyrosol derivatives as antitry⁃panosomal and antileishmanial agents[J].Eur J Med Chem,2016,119(1):132-140.
[14]Zhou D,Sun Y,Shahidi F.Preparation and antiox⁃idant activity of tyrosol and hydroxytyrosol esters[J].J Funct Foods,2017,37(1):66-73.

