TGF-β/Smads通路参与EndoMT在HHPH中的作用及益气温阳活血化痰方的干预效应*
张聪聪,张晶晶▲,武垣伶,戴雍月,钱小英,王万铁△
(1温州医科大学病理生理学教研室,浙江 温州 325035; 2温州市人民医院呼吸内科,浙江 温州 325000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是造成我国慢性肺源性心脏病(肺心病)的主要原因[1]。肺心病具有预后不佳和进展较快的特点,严重影响我国城乡居民的健康[2-3]。肺动脉高压(pulmonary artery hypertension,PAH)是肺心病的特征性改变,直接影响肺心病的预后[4],并且其发生同时往往伴随着肺泡和血液中二氧化碳分压升高[5]。
低氧高二氧化碳性肺动脉高压(hypoxia-hypercapnia pulmonary hypertension,HHPH)是一个多因子参与的病理过程,肺血管收缩反应(pulmonary vasoconstriction,PV)和肺血管重构(pulmonary vascular remodeling,PVSR)是2个主要的发病环节[6]。近年来的研究表明,血管内皮细胞通过内皮-间充质转化(endothelial-mesenchymal transition,EndoMT)可能参与PVSR过程[7]。其中,转化生长因子β1(transforming growth factor-β1,TGF-β1)家族和其下游的Smads信号通路与EndoMT的发生有着密切的关系[8]。
益气温阳活血化痰方(Yiqi-Wenyang-Huoxue-Huatan formula,YWHHF),全方组成:黄芪、人参、附片、川芎、丹参、法夏、薤白和白芥子等。研究表明,黄芪和丹参等对心、肺及脑相关疾病具有一定的治疗作用[9-10],但其是否能缓解低氧高二氧化碳引起的肺动脉高压,目前尚未有报道。本实验旨在探究益气温阳活血化痰方在低氧高二氧化碳情况下与肺动脉内皮细胞-间质转分化中的作用及与TGF-β/Smads信号通路的关系,从而探讨益气温阳活血化痰方可能的作用机制,为临床防治肺动脉高压症提供理论指导。
材 料 和 方 法
1 动物
健康雄性Sprague-Dawley(SD)大鼠50只,清洁级,体重为(200±20) g,由温州医科大学动物实验中心提供,动物许可证号为SCXK(浙)2015-0009。
2 主要试剂
益气温阳活血化痰方(北京中医药大学组方);逆转录试剂盒(Thermo);兔抗大鼠α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和TGF-β1抗体及小鼠抗大鼠CD31抗体(Abcam);兔抗大鼠Smad2/3和p-Smad2/3抗体(Cell Signaling Technology);辣根酶标记山羊抗兔 II 抗和辣根酶标记山羊抗小鼠 II 抗(博蕴生物科技有限公司);BCA蛋白浓度测定试剂盒(增强型)(碧云天);PVDF膜(Millipore);琼脂糖凝胶(Bio-Rad);所有引物均由上海捷瑞生物工程有限公司合成。
3 主要方法
3.1中药制备将药材磨成粉状,于冷水中浸泡1 h,多功能提取罐煎煮2次,每次90 min,合并2次滤液,置于4 ℃冷藏。分装滤液于EP管中,真空冷冻干燥处理,并于阴凉处保存。按体表面积折算率换算成大鼠等效剂量,按浓度分为高剂量(200 g/L)组、中剂量(100 g/L)组和低剂量(50 g/L)组,灌胃前用生理盐水溶解,并将溶液置于37 ℃水浴锅20 min,避免大鼠出现腹泻等现象[11]。
3.2实验分组将50只清洁级SD大鼠随机分为5组(n=10):常氧对照(normal control,N)组、低氧高二氧化碳(hypoxia-hypercapnia,HH)组、YWHHF高剂量(high-dose YWHHF,YH)组、YWHHF中剂量(middle-dose YWHHF,YM)组和YWHHF低剂量(low-dose YWHHF,YL)组。
3.3HHPH动物模型的制备N组置于常氧环境,自由呼吸空气,饲养4周;其余4组置于低氧高二氧化碳(10% O2和5% CO2)氧舱中饲养,HH组进仓前用等体积的生理盐水灌胃,各中药组用等体积的YWHHF灌胃,YH组剂量为0.6 g/kg,YM组剂量为0.3 g/kg,YL组剂量为0.15 g/kg,仓内多余CO2用氢氧化钠吸收8 h/d,每周6 d,饲养4周。
3.4大鼠平均肺动脉压(mean pulmonary artery pressure,mPAP)和平均颈动脉压(mean carotid artery pressure,mCAP)的检测用10%的水合氯醛以350 mL/kg麻醉大鼠,消毒后分离皮下组织和肌肉,暴露颈外静脉,并在其上剪一个2~3 mm的“V”形切口,将PE导管慢慢往里推送,直至出现波幅较心室波小且波形较规则的肺动脉压力波形,记录肺动脉压并保存; 剪开大鼠左侧颈部的皮毛,暴露颈总动脉,用小型动脉夹分别夹住动脉的近心端和离心端,剪2~3 mm的“V”形切口,将PE导管插入颈总动脉,记录颈动脉压并保存。
3.5右心室肥大指数(right ventricular hypertrophy index,RVHI)的测量测完压力后用生理盐水灌洗,直至肺叶呈白色,剪下心脏及肺叶至PBS中漂洗,沿房室沟剪去心房,分离右心室(right ventricle,RV)及左心室(left ventricle,LV)加心室间隔(interventri-cular septum,IVS)(LV+S),用滤纸吸干,电子天平称重,计算RV/(LV+S)的质量比,即右心室肥大指数,以此作为判断右心室肥厚程度。
3.6肺组织的HE染色观察留取右中肺叶用4%的多聚甲醛浸泡48 h至1周,脱水后常规石蜡切片,HE染色,观察。
3.7肺组织的免疫荧光观察取各组大鼠肺叶,用4%多聚甲醛固定,石蜡包埋切片,60 ℃恒温烤箱中烤片2 h,经过脱蜡、水化、封闭,滴加兔抗大鼠α-SMA和小鼠抗大鼠CD31的抗体(稀释比均为1∶100),4 ℃过夜。第2天PBS冲洗3次,每次5 min,滴加 II 抗,37 ℃孵育30 min,50%防淬灭缓冲甘油封片,用正置荧光显微镜观察并拍片。
3.8RT-PCR检测α-SMA、CD31、TGF-β1和Smad2/3的mRNA表达水平取大鼠肺组织 100 mg,加液氮在研钵里研磨,以Trizol法提取总RNA,测定RNA浓度,按照RT-PCR试剂盒说明书进行cDNA合成及扩增,PCR扩增反应条件如下:(1)β-actin:95 ℃(预变性)6 min; 95 ℃(变性)1 min、54 ℃(退火)1 min、72 ℃(延伸)1 min,32个循环; 72 ℃(终止延伸)10 min。(2)α-SMA:94 ℃(预变性)3 min; 94 ℃(变性)30 s、53.9 ℃(退火)30 s、72 ℃(延伸)1 min,32个循环; 72 ℃(终止延伸)5 min。(3)CD31:94 ℃(预变性)3 min; 94 ℃(变性)30 s、 51.2 ℃(退火)30 s、72 ℃(延伸)1 min,32个循环;72 ℃(终止延伸)5 min。(4)TGF-β1:94 ℃(预变性)3 min、94 ℃(变性)30 s、51.1 ℃(退火)30 s、72 ℃(延伸)1 min,32个循环; 72 ℃(终止延伸)5 min。(5)Smad2/3:94 ℃(预变性)3 min; 94 ℃(变性)30 s、53.7 ℃(退火)30 s、72 ℃(延伸)1 min,32个循环; 72 ℃(终止延伸)5 min。引物序列见表1。
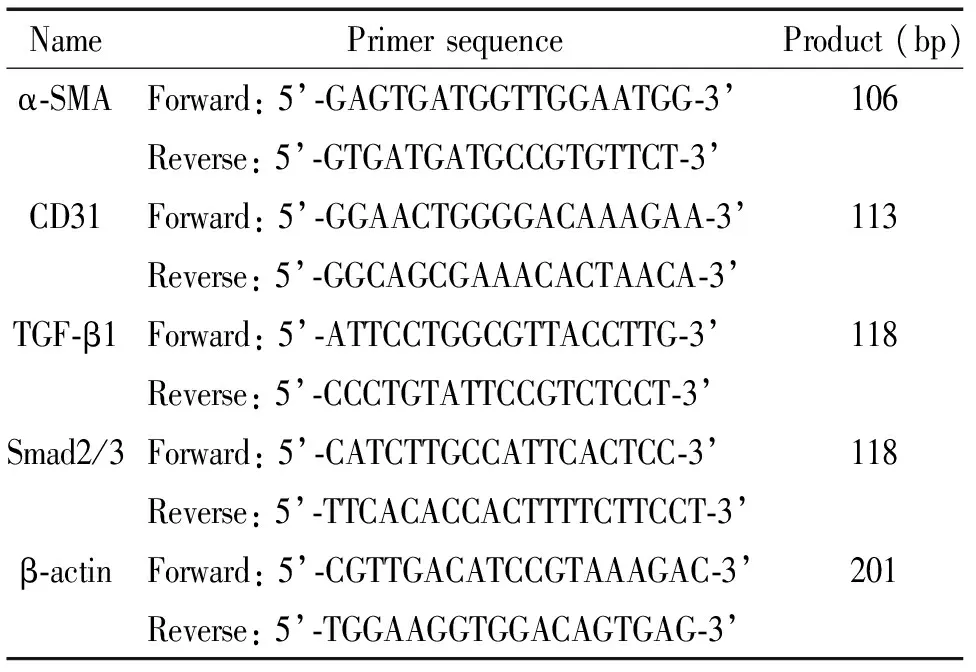
表1 PCR引物序列Table 1.The sequences of the primers for RT-PCR
3.9Western blot测定各组α-SMA、CD31、TGF-β1和p-Smad2/3的蛋白水平取100 mg各组大鼠肺组织,加液氨在研钵里充分研磨,用1 mL RIPA 和 10 μL PMSF裂解肺组织,待裂解充分后,12 000 r/min、4 ℃ 离心10 min,取上清液,用BCA法测定蛋白浓度。电泳结束后截取相应位置的胶进行转膜,室温下用5%脱脂牛奶封闭1 h,用 I 抗稀释液稀释 I 抗(α-SMA、CD31、TGF-β1、Smad2/3和p-Smad2/3抗体均为1∶1 000),4 ℃孵育过夜。TBST洗膜后,用HRP标记的 II (CD31为山羊抗鼠IgG,1∶10 000; α-SMA、TGF-β1、Smad2/3、p-Smad2/3和GAPDH为山羊抗兔IgG,1∶10 000)抗室温孵育1 h,洗膜后滴加化学发光检测试剂,置于曝光仪曝光,用Quantity One软件分析条带灰度值,用目的蛋白与GAPDH蛋白灰度值之比表示目的蛋白的表达水平,用p-Smad2/3与Smad2/3的比值反映p-Smad2/3蛋白的磷酸化水平。
4 统计学处理
采用SPSS 19.0软件进行统计分析,计量资料进行正态性检验,数据用均数±标准差(mean±SD)表示。多组样本均数比较进行方差齐性检验,组间比较采用单因素方差分析(one-way ANOVA),方差齐性者两两比较采用SNK-q法,方差不齐者进行Dunnett T3 检验,以P<0.05为差异有统计学意义。
结 果
1 各组大鼠平均肺动脉压、平均颈动脉压及右心室肥大指数的比较
与N组相比,其余4组的mPAP均有不同程度升高(P<0.05或P<0.01),RV/(LV+S)均显著增大(P<0.01);与HH组相比,YH、YM和YL组的mPAP均有不同程度降低(P<0.01),RV/(LV+S)也有相应降低趋势(P<0.01或P<0.05);与YL组比,YH组和YM组的mPAP均降低(P<0.01),并以YM组下降最显著。各组劲动脉平均压力值无统计学意义,见表2。
表2各组大鼠mPAP、mCAP及RV/(LV+S)的变化
Table 2.The changes of mPAP,mCAP and RV/(LV+S) in the rats with different treatments (Mean±SD.n=10)

GroupmPAP(mmHg)mCAP(mmHg)RV/(LV+S)(%)N13.21±1.30 102.64±4.0122.20±1.01HH28.27±2.01∗∗121.64±3.9635.02±2.88∗∗YH22.81±2.34∗∗△△##119.34±4.4527.41±1.46∗∗△△YM22.69±2.89∗∗△△##124.52±3.8727.56±1.97∗∗△△YL25.76±3.01∗△△109.47±4.3331.84±1.68∗∗△
*P<0.05,**P<0.01vsN group;△P<0.05,△△P<0.01vsHH group;##P<0.01vsYL group.
2 各组大鼠肺组织形态学光镜观察结果
与N组相比,HH组及各中药组肺动脉平滑肌均有不同程度增殖,中膜层有不同程度增厚,血管管壁面积(wall area,WA)/总面积(total area,TA)均升高(P<0.01或P<0.05),血管管腔面积(lumen area,LA)/TA均降低(P<0.01或P<0.05);与HH组比,各中药组肺动脉平滑肌的增殖有不同程度的降低,中膜厚度有不同程度下降,管腔面积增加明显,WA/TA均降低(P<0.01或P<0.05),LA/TA均升高(P<0.01或P<0.05),见图1、表3。

Figure 1.HE staining of pulmonary arteries in each group (×40).The red rectangle area is the characteristic change area of the pulmonary artery.
图1各组大鼠肺动脉HE染色结果
表3各组大鼠WA/TA和LA/TA值的比较
Table 3.The changes of WA/TA and LA/TA values of the rats with different treatments (%.Mean±SD.n=10)

GroupWA/TALA/TAN29.12±5.0667.02±6.22HH62.33±2.88∗∗37.86±2.01∗∗YH49.36±2.96∗∗△△#53.61±2.98∗∗∗△△##YM50.44±3.02∗∗△△#51.73±3.01∗△△##YL59.97±4.86∗△44.56±5.68∗△
*P<0.05,**P<0.01vsN group;△P<0.05△△P<0.01vsHH group;#P<0.05,##P<0.01vsYL group.
3 免疫荧光法测定大鼠肺动脉壁CD31和α-SMA的表达
在免疫荧光实验中,CD31用来证明内皮细胞的存在,是其特异性标志物,常表达于血管内膜,α-SMA是间充质细胞的特异性标志物,常表达于血管中膜。各组大鼠肺动脉壁免疫荧光图中CD31呈绿色,α-SMA呈红色,荧光强度代表各自表达量。结果如下:N组可见CD31沿内膜分布,强度高,α-SMA在中膜分布,强度一般;HH组CD31脱落明显,少见,α-SMA在动脉各层弥散分布,强度高;YH组及YM组CD31强度一般,α-SMA强度中等;YL组CD31强度较弱,α-SMA分布较强,见图2。

Figure 2.Immunofluorescence of pulmonary arteries in each group (×40).The white arrow is defined as a distinct change area.
图2各组大鼠肺动脉壁免疫荧光图
4 各组大鼠肺组织α-SMA、CD31、TGF-β1和Smad2/3的mRNA相对表达量的比较
与N组比,低氧高二氧化碳时α-SMA、TGF-β1和Smad2/3的mRNA水平均明显增高(P<0.01),CD31的mRNA水平明显降低(P<0.01);与HH组比,YM组和YH组α-SMA、TGF-β1和Smad2/3的mRNA水平有不同程度的降低(P<0.05或P<0.01),YL组α-SMA和Smad2/3的mRNA水平有不同程度的降低(P<0.05或P<0.01),但TGF-β1无明显改变,YM组、YH组和YL组CD31的mRNA水平均有不同程度升高(P<0.05或P<0.01),见图3~6。
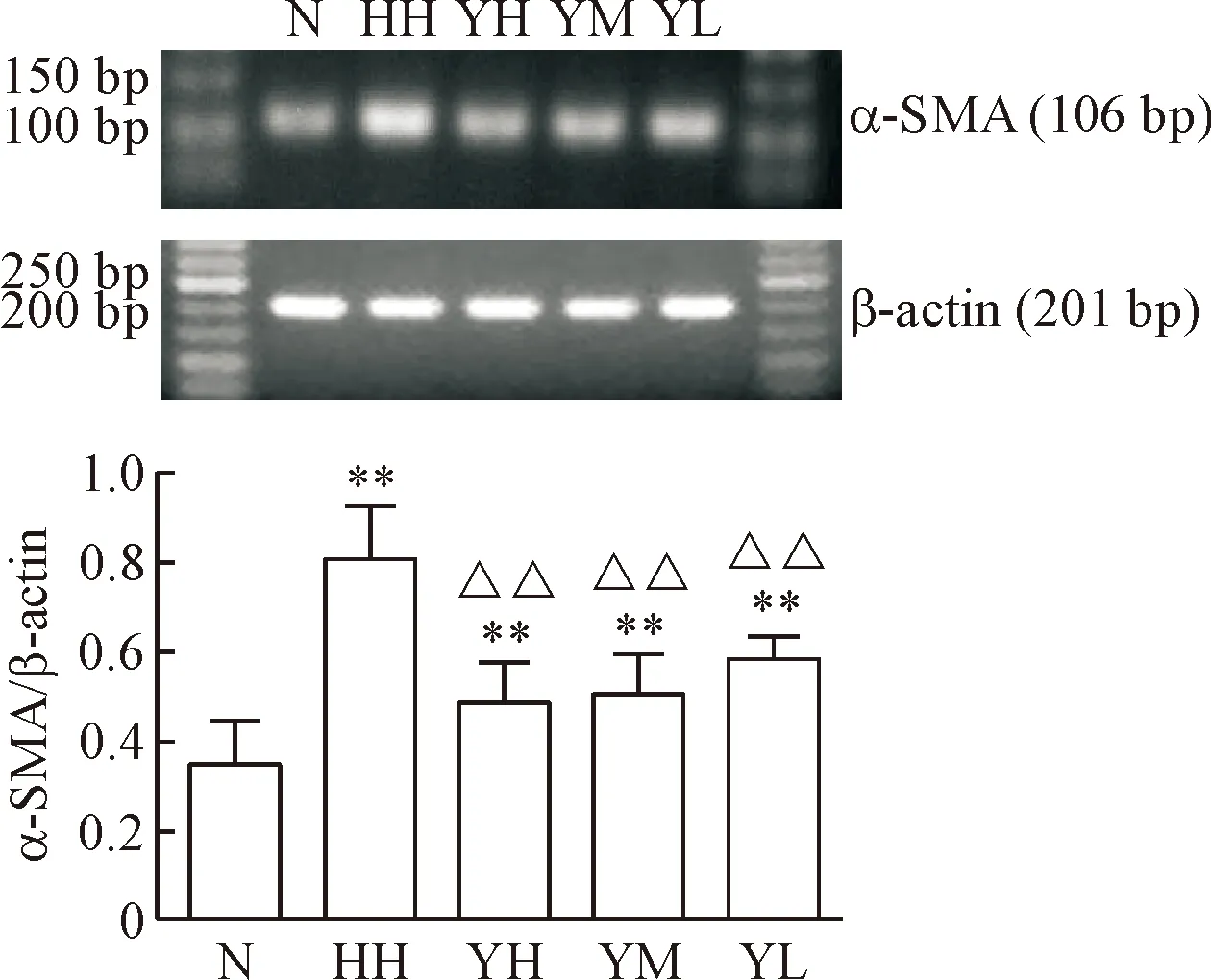
Figure 3.The mRNA expression of α-SMA in each group.Mean±SD.n=10.**P<0.01vsN group;△△P<0.01vsHH group.
图3各组大鼠肺组织α-SMA的mRNA表达水平

Figure 4.The mRNA expression of CD31 in each group.Mean±SD.n=10.**P<0.01vsN group;△P<0.05,△△P<0.01vsHH group;#P<0.05vsYL group.
图4各组大鼠肺组织CD31的mRNA表达水平
5 各组大鼠肺组织α-SMA、CD31、TGF-β1和p-Smad2/3 蛋白水平的比较
与N组比,低氧高二氧化碳时α-SMA、TGF-β1和p-Smad2/3的蛋白水平均明显增高,CD31的蛋白水平明显降低(P<0.05或P<0.01);与HH组比,YM组和YH组α-SMA、TGF-β1和p-Smad2/3的蛋白水平有不同程度的降低(P<0.05或P<0.01),YL组的p-Smad2/3蛋白水平有不同程度的降低(P<0.05),但α-SMA和TGF-β1无明显改变;YM组、YH组和YL组CD31的蛋白水平均有不同程度升高(P<0.05或P<0.01),见图7~10。

Figure 5.The mRNA expression of TGF-β1 in each group.Mean±SD.n=10.**P<0.01vsN group;△P<0.05,△△P<0.01vsHH group.
图5各组大鼠肺组织TGF-β1的mRNA表达水平

Figure 6.The mRNA expression of Smad2/3 in each group.Mean±SD.n=10.**P<0.01vsN group;△P<0.05,△△P<0.01vsHH group;#P<0.05,##P<0.01vsYL group.
图6各组大鼠肺组织Smad2/3的mRNA表达水平

Figure 7.The protein expression of α-SMA in each group.Mean±SD.n=10.**P<0.01vsN group;△△P<0.01vsHH group;#P<0.05vsYL group.
图7各组大鼠肺组织α-SMA蛋白的表达水平

Figure 8.The protein expression of CD31 in each group.Mean±SD.n=10.*P<0.05,**P<0.01vsN group;△P<0.05,△△P<0.01vsHH group;#P<0.05vsYL group.
图8各组大鼠肺组织CD31蛋白的表达水平
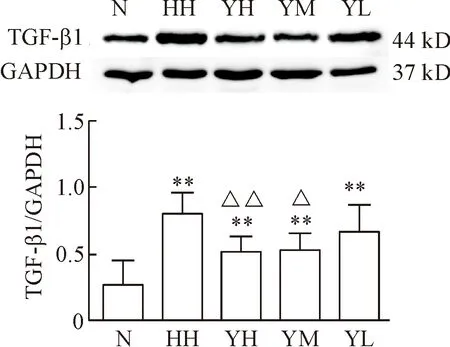
Figure 9.The protein expression of TGF-β1 in each group.Mean±SD.n=10.**P<0.01vsN group;△P<0.05,△△P<0.01vsHH group.
图9各组大鼠肺组织TGF-β1蛋白的表达水平
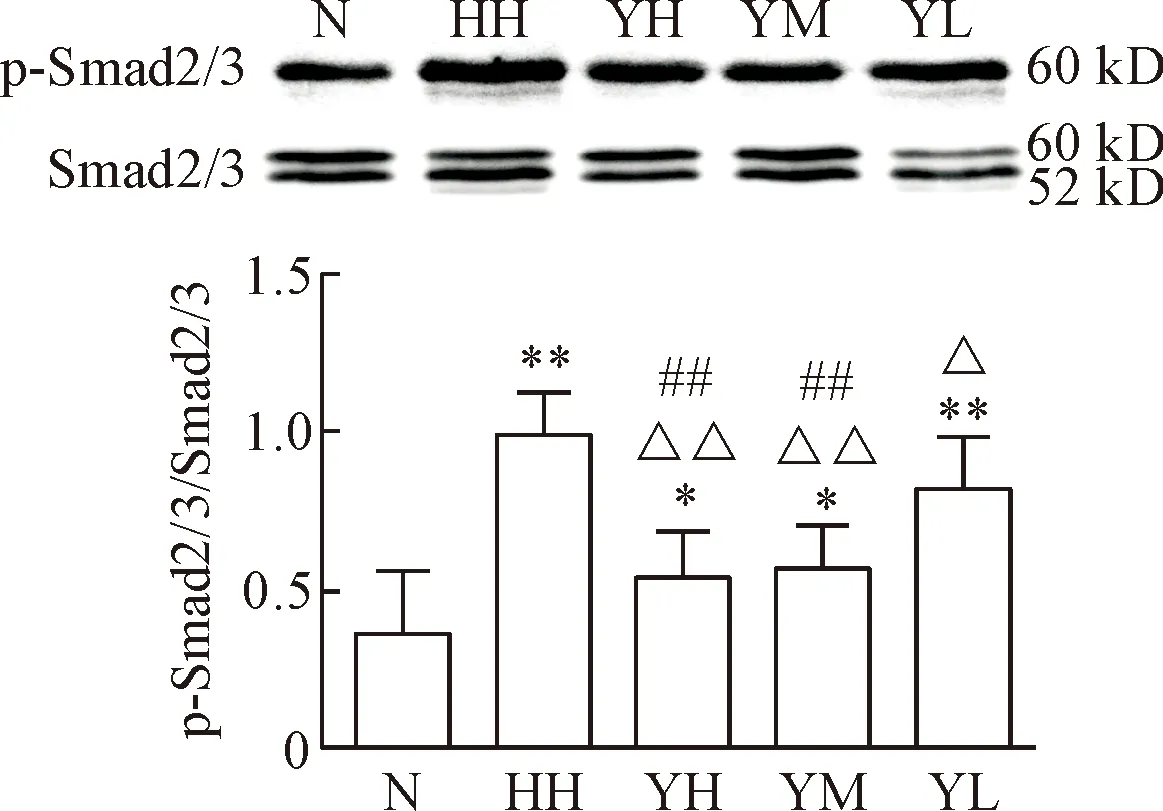
Figure 10.The protein levels of p-Smad2/3 in each group.Mean±SD.n=10.*P<0.05;**P<0.01vsN group;△P<0.05,△△P<0.01vsHH group;##P<0.01vsYL group.
图10各组大鼠肺组织p-Smad2/3蛋白水平的比较
6 各组大鼠mPAP、WA/TA、LA/TA、α-SMA、CD31、TGF-β1、Smad2/3和p-Smad2/3 mRNA和蛋白表达的相关性分析
各组大鼠mPAP与α-SMA mRNA和蛋白表达呈显著正相关(r分别为0.7424和0.7206,P<0.01),mPAP与CD31 mRNA和蛋白表达呈显著负相关(r分别为-0.6388和-0.7956,P<0.01);WA/TA与α-SMA mRNA和蛋白表达呈显著正相关(r分别为0.7909和0.7567,P<0.01),WA/TA(%)与CD31 mRNA和蛋白表达呈显著负相关(r分别为-0.8107和-0.8029,P<0.01);LA/TA与α-SMA mRNA和蛋白表达呈显著负相关(r分别为-0.7572和-0.8462,P<0.01),LA/TA与CD31 mRNA和蛋白表达呈显著正相关(r分别为0.8097和0.8464,P<0.01);同时,α-SMA 与TGF-β1 mRNA和蛋白表达呈显著正相关(r分别为0.5614和0.7510,P<0.01);CD31 与TGF-β1 mRNA和蛋白表达呈显著负相关(r分别为-0.5481和-0.7141,P<0.01);TGF-β1与Smad2/3 mRNA和蛋白表达呈显著正相关(r分别为0.7495和0.7925,P<0.01)。
讨 论
肺动脉高压是一种以肺动脉压力进行性升高为特征的危及生命的疾病,其病理变化包括肺血管收缩和重构及平滑肌细胞抗凋亡性等[12]。缺氧在PAH的发病机制中起关键作用,它能引起肺纤维化并导致PAH[13]。由于PAH发生同时往往伴随着肺泡和血液中二氧化碳分压升高,因此,制备吸入混合气体的肺动脉高压动物模型更符合肺心病人群发病的情况[14-15]。研究发现,EndoMT在胚胎发育时期心血管系统的发育过程中发挥着关键的作用,是近年来心肌纤维化和肾纤维化等纤维化疾病的研究热点[16]。体外实验表明,在低氧情况下,肺动脉内皮细胞通过EndoMT转分化成平滑肌细胞,且应用EndoMT抑制剂如SB431542能有效减缓内皮细胞转分化[17]。但EndoMT是否参与低氧高二氧化碳诱导的肺动脉高压目前尚未报道。
EndoMT是内皮细胞向间充质细胞转化,细胞发生了形态、表型及功能的改变,即特异性内皮细胞标志物CD31和血管内皮钙黏蛋白(vascular endothelial cadherin,VE-cadherin)等表达减弱或丧失,间充质细胞标志物α-SMA和成纤维细胞特异性蛋白1(fibroblast specific protein-1,FSP-1)等增多[18]。EndoMT是一种新认可的细胞的转化类型,PAH的发病机制中起重要作用可能是一种肌成纤维细胞来源的细胞,因此抑制EndoMT可能是治疗PAH的新型靶点[19]。TGF-β/Smads通路与EndoMT的发生紧密相关,TGF-β配体首先与内皮细胞膜上的TGF-βⅡ型受体(TGF-β receptor Ⅱ,TβRⅡ)结合,通过TβRⅡ激酶使TβRI磷酸化,并与其共同形成异二聚体或者四聚体结构,进而磷酸化其下游Smad蛋白家族中的受体激活型 Smad2和Smad3,随后Smad2/3与通用型Smad4形成复合物,转位到核内,激活或者抑制核内靶因子转录[20],调控EndoMT发生。近年来,有研究表明,低氧诱导的肺动脉高压的发展与血管重塑有关,并伴随着肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)和内皮细胞的增殖和迁移[21],其中TGF-β1是促炎因子,也是能促进血管重塑和血管收缩的生长因子,因而是调控EndoMT的关键细胞因子,目前已被公认是COPD和PAH等炎症性肺病发病的重要因子[22-23]。本实验结果表明,与N组比,HH组和各给药组肺动脉平均压和右心室肥大指数均显示不同程度升高,表明低氧高二氧化碳诱导的肺动脉大鼠模型成功复制。同时,光镜下观察到HH组和各给药组肺动脉中膜亦有不同程度的增生,血管壁增厚明显;免疫荧光结果显示HH组和各给药组内皮细胞减少或脱落明显,而平滑肌细胞呈增生趋势,且mPAP、RV/(LV+S)和WA/TA(%)分别与α-SMA呈显著正相关,LA/TA(%)与α-SMA呈显著负相关,而mPAP、RV/(LV+S)和WA/TA(%)分别与CD31呈显著负相关,LA/TA(%)与CD31呈显著正相关;α-SMA、TGF-β1和p-Smad2/3的mRNA和蛋白表达水平呈上升趋势,而CD31 mRNA和蛋白表达水平呈下降趋势,说明低氧高二氧化碳能通过TGF-β1信号通路引起EndoMT,并造成一定程度的肺血管重构,从而产生肺动脉高压。
现代西医治疗虽然明显改善了PAH患者的生理功能,但其死亡率仍高达50%。国内许多学者根据低氧性肺动脉高压症的基本病机,采用益气温阳活血化痰方治疗肺动脉高压症,能够明显改善患者缺氧状况、临床症状并提高生活质量[24],其疗效可能与调节血管活性物质的水平有关。YWHHF全方组成主要有:黄芪 30 g、人参20 g、附片9 g、川芎10 g、丹参10 g、法夏9 g、薤白12 g和白芥子15 g。方中黄芪能补一身之气,兼有升阳,固表止汗,排脓生肌,利水消肿的作用,能有效抑制肺纤维化和腺癌细胞生长,去除氧自由基[25];人参含有多种皂甙,挥发油和多糖类等成分,具有补益强壮和强心等作用,为补肺之要药[26];附片和薤白是大温热之药,有回阳救逆、温肾助阳、祛寒止痛的功效,用于肾阳 不足、畏寒肢冷和风寒湿痹等症;川芎和丹参,为血中之气药,具有辛散、解郁、通达和止痛等功能;法夏和白芥子温肺化痰,通络止痛,诸药配合具有益气温肺、活血化痰和开胸通达之效[27-28]。但其是否对低氧高二氧化碳引起的肺动脉高压有干预作用及其具体机制目前尚不明确。
本实验结果显示,与HH组比,YH、YM和YL组的肺动脉平均压和右心室肥大指数呈降低趋势;HE染色和免疫荧光结果显示肺血管壁增厚减少,损伤减轻。同时,应用YWHHF后,原本在低氧高二氧化碳情况下增高的α-SMA、TGF-β1和p-Smad2/3的mRNA和蛋白表达水平呈下降趋势,而原本降低的CD31 mRNA和蛋白表达呈上升趋势,其中α-SMA、TGF-β1和p-Smad2/3的含量变化呈显著正相关,而CD31与TGF-β1的含量变化呈显著负相关,说明YWHHF能有效抑制EndoMT,一定程度上逆转低氧高二氧化碳诱导的肺血管重构,从而减低肺动脉压力,其机制可能与通过抑制TGF-β1及下游信号通路Smad2/3有关。综合药效、经济等各方面考虑,中剂量的YWHHF更具有推广意义。
综上所述,低氧高二氧化碳诱导的肺动脉高压大鼠模型中,EndoMT可能通过TGF-β/Smads通路的过度活化而发生;益气温阳活血化痰方可通过抑制TGF-β/Smads通路在一定程度上缓解肺动脉高压。
[参考文献]
[1]Bajwa AA,Shujaat A,Patel M,et al.The safety and to-lerability of inhaled treprostinil in patients with pulmonary hypertension and chronic obstructive pulmonary disease[J].Pulm Circ,2017,7(1):82-88.
[2]Ozdemir O,Ceylan Y,Razi CH,et al.Assessment of ventricular functions by tissue Doppler echocardiography in children with asthma[J].Pediatr Cardiol,2013,34(3):553-559.
[3]Serraj M,Smahi M,Kamaoui I,et al.Hydatic pulmonary embolism:a rare complication of hepatic hydatid cyst[J].Rev Mal Respir,2013,30(3):215-221.
[4]Kaushal M,Shah PS,Shah AD,et al.Chronic obstructive pulmonary disease and cardiac comorbidities:a cross-sectional study[J].Lung India,2016,33(6):404-409.
[5]朱阿楠,王园园,王淑君,等.ERK通路和三七总皂苷干预在低氧高二氧化碳性肺动脉高压中的作用[J].中国病理生理杂志,2011,27(9):1796-1801.
[6]Wrobel JP,Thompson BR,Williams TJ.Mechanisms of pulmonary hypertension in chronic obstructive pulmonary disease:a pathophysiologic review[J].J Heart Lung Transplant,2012,31(6):557-564.
[7]Tan W,Madhavan K,Hunter KS,et al.Vascular stiffening in pulmonary hypertension:cause or consequence? (2013 Grover Conference series)[J].Pulm Circ,2014,4(4):560-580.
[8]Xiang Y,Zhang Y,Tang Y,et al.MALAT1 modulates TGF-β1-induced endothelial-to-mesenchymal transition through downregulation of miR-145[J].Cell Physiol Biochem,2017,42(1):357-372.
[9]He CL,Yi PF,Fan QJ,et al.Xiang-Qi-Tang and its active components exhibit anti-inflammatory and anticoagulant properties by inhibiting MAPK and NF-κB signaling pathways in LPS-treated rat cardiac microvascular endothelial cells[J].Immunopharmacol Immunotoxicol,2013,35(2):215-224.
[10] Zhang X,Luo W,Zhao W,et al.Isocryptotanshinone induced apoptosis and activated MAPK signaling in human breast cancer MCF-7 cells[J].J Breast Cancer,2015,18(2):112-118.
[11] 项冰倩,高慧,戴雍月,等.益气温阳活血化痰方通过抑制内质网应激对HHPH大鼠脑的保护作用[J].中国病理生理杂志,2017,33(10):1-9.
[12] Sommer N,Dietrich A,Schermuly RT,et al.Regulation of hypoxic pulmonary vasoconstriction:basic mechanisms[J].Eur Respir J,2008,32(6):1639-1651.
[13] Garcia-Morales LJ,Chen NY,Weng T,et al.Altered hypoxic-adenosine axis and metabolism in group III pulmonary hypertension[J].Am J Respir Cell Mol Biol,2016,54(4):574-583.
[14] Suresh K,Shimoda LA.Lung circulation[J].Compr Physiol,2016,6(2):897-943.
[15] 王淑君,刘立宾,黎关龙,等.三七皂苷单体R1抑制低氧高CO2诱导的肺动脉平滑肌细胞p38 MAPK信号通路的活化[J].中国病理生理杂志,2012,28(1):105-108.
[16] Beketaev I,Zhang Y,Kim EY,et al.Critical role of YY1 in cardiac morphogenesis[J].Dev Dyn,2015,244(5):669-680.
[17] Finkenzeller G,Stark GB,Strassburg S.Growth differentiation factor 11 supports migration and sprouting of endothelial progenitor cells[J].J Surg Res,2015,198(1):50-56.
[18] Rieder F,Kessler SP,West GA,et al.Inflammation-induced endothelial-to-mesenchymal transition:a novel mechanism of intestinal fibrosis[J].Am J Pathol,2011,179(5):2660-2673.
[19] Qu Y,Zhang G,Ji Y,et al.Protective role of gambogic acid in experimental pulmonary fibrosisinvitroandinvivo[J].Phytomedicine,2016,23(4):350-358.
[20] Feng J,Zhang J,Jackson AO,et al.Apolipoprotein A1 inhibits the TGF-β1-induced endothelial-to-mesenchymal transition of human coronary artery endothelial cells[J].Cardiology,2017,137(3):179-187.
[21] Dierick F,Héry T,Hoareau-Coudert B,et al.Resident PW1+progenitor cells participate in vascular remodeling during pulmonary arterial hypertension[J].Circ Res,2016,118(5):822-833.
[22] Chen X,Li B,Luo R,et al.Analysis of the function of microRNA-375 in humans using bioinformatics[J].Biomed Rep,2017,6(5):561-566.
[23] Ichimaru Y,Krimmer DI,Burgess JK,et al.TGF-beta enhances deposition of perlecan from COPD airway smooth muscle[J].Am J Physiol Lung Cell Mol Physiol,2012,302(3):L325-L333.
[24] Morrell NW,Adnot S,Archer SL,et al.Cellular and molecular basis of pulmonary arterial hypertension[J].J Am Coll Cardiol,2009,30(54):S20-S31.
[25] Zhu J,Zhang H,Zhu Z,et al.Effects and mechanism of flavonoids fromAstragaluscomplanatuson breast cancer growth[J].Naunyn Schmiedebergs Arch Pharmacol,2015,388(9):965-972.
[26] Xu YX,Lin LN,Tang L,et al.Notoginsenoside R1 attenuates hypoxia and hypercapnia induced vasoconstriction in isolated rat pulmonary arterial rings by reducing the expression of ERK[J].Am J Chin Med,2014,42(4):799-816.
[27] Xiao Y,Ma ZC,Wang YG,et al.Cardioprotection of Shenfu preparata on cardiac myocytes through cytochrome P450 2J3[J].J Integr Med,2013,11(5):327-336.
[28] Tamano H,Yusuke E,Ide K,et al.Influences of Yokukansankachimpihange on aggressive behavior of zinc-deficient mice and actions of the ingredients on excessive neural exocytosis in the hippocampus of zinc-deficient rats[J].Exp Anim,2016,65(4):353-361.

