PRRX2通过调控Wnt/β-catenin信号通路促进胃癌细胞活力和迁移*
王 倩,陈冬玲,张瓅方,2,卞 华△
(南阳理工学院 1张仲景国医国药学院,2河南省张仲景方药与免疫调节重点实验室,河南 南阳 473004)
随着人类社会的发展以及生活水平的提高,胃癌的发病率也呈逐年上升趋势,目前世界范围内胃癌发病率居所有肿瘤第4位,死亡率居所有恶性肿瘤的第3位[1-3]。近年来,尽管医疗技术不断进步,但胃癌致死率仍然居高不下[4-6],严重威胁着人类的健康。目前,针对胃癌的治疗,除了传统手术治疗、放射治疗和化疗外,新型的肿瘤分子靶向治疗也越来越展现出令人欣喜的发展前景。因此,寻找合适的胃癌治疗分子靶标是目前研究的热点。
胃癌的发生发展过程中常常伴随着抑癌基因的失活或癌基因的激活,以及各种信号通路的功能紊乱。尽管配对相关同源框2(paired-related homeobox 2,PRRX2)基因很早就被研究人员所发现[7],然而其与人类疾病的相关研究并不充分。目前,关于PRRX2与肿瘤的相关研究发现,PRRX2可能与前列腺癌[8]、乳腺癌[9]、食管鳞癌[10]和白血病[11]等肿瘤相关。有研究显示,PRRX2可能与转移性胃癌相关[12],但是其在胃癌的发生发展中的作用机制尚不清楚。本研究中,我们将PRRX2小干扰RNA(small interfering RNA,siRNA)和过表达质粒分别转染到胃癌细胞MGC-803和SGC-7901中,敲低和过表达PRRX2基因,研究其对于胃癌细胞活力和迁移能力的影响,并分析PRRX2对Wnt/β-catenin信号通路的调控作用,初步探讨相关分子机制,为寻找胃癌治疗相关的分子靶点提供理论依据。
材 料 和 方 法
1 细胞和试剂
胃癌细胞系MGC-803购自ATCC;SGC-7901细胞购自中国科学院细胞库;抗PRRX2、β-catenin、c-Myc、cyclin D1和GAPDH I抗以及HRP标记的山羊抗兔Ⅱ抗均购自ProteinTech;转染试剂脂质体Lipofectamine 3000(Invitrogen);胰蛋白酶(索莱宝生物科技有限公司);MTT细胞活力检测试剂盒(碧云天生物技术有限公司);Transwell小室(Corning);DMEM高糖培养基和胎牛血清(Gibco);双萤光素酶报告基因检测试剂盒Dual-Luciferase® Reporter Assay System(Promega);Protein A/G琼脂糖珠(Santa Cruz);空载体pFlag-NC和pHA-NC均购Sigma;pFlag-PRRX2和pHA-β-catenin质粒由本实验室构建,且通过测序验证。
2 方法
2.1PRRX2 siRNA的合成在NCBI数据库中检索人PRRX2基因序列(GenBank:BC014645.1),按照siRNA设计原则,设计3条siRNA序列,并交由上海吉玛公司合成PRRX2小干扰RNA(siR-PRRX2),以及阴性对照siR-NC,见表1。
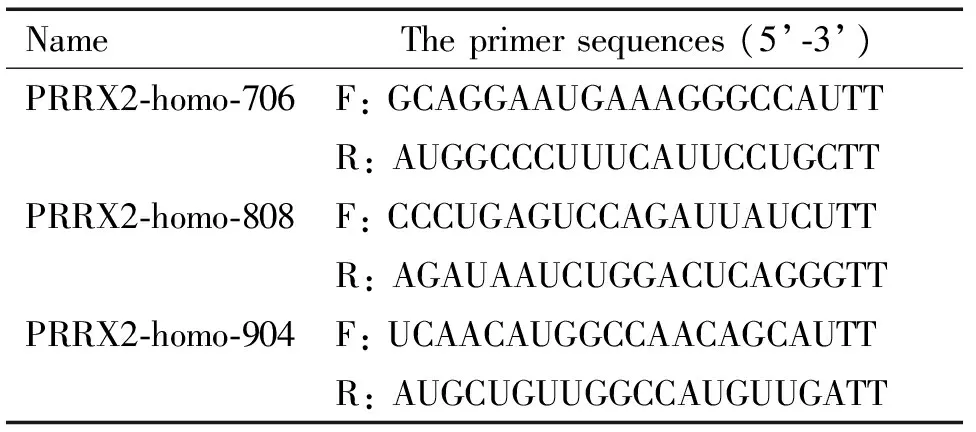
表1 PRRX2 siRNA引物序列Table 1.The primer sequences of PRRX2 siRNA
F:forward; R:reverse.
2.2细胞培养和转染用含10%胎牛血清的DMEM高糖培养基于37 ℃、5% CO2的恒温条件下培养MGC-803细胞和SGC-7901细胞。当细胞生长至80%~90%汇合度时,用胰蛋白酶消化后传代至60 mm细胞培养皿,待细胞生长至60%汇合度时,按照Lipofectamine 3000说明书进行转染。
2.3MTT实验检测细胞活力收集对数期细胞接种到96孔板,使待测细胞密度至每孔5 000个细胞左右时转染相应的质粒和空载体,每组设3个复孔,继续培养6 h后更换为含10%胎牛血清的DMEM培养基,设置培养时间0、24和48 h;培养结束后,每孔加入10 μL MTT溶液(5 g/L),继续培养4~6 h;终止培养,小心除去孔内培养基,每孔加入150 μL DMSO,在摇床上低速振荡10 min,于570 nm波长下检测吸光度(A)值。
2.4Transwell实验检测迁移能力细胞转染48 h后,用胰蛋白酶消化并用无血清培养基重悬细胞,按每孔1×106个细胞接种到Transwell小室中(每孔200 μL),上层小室为不含血清的细胞悬液,下层为500 μL含10%胎牛血清的培养基,培养36 h后弃去上层小室和下层孔内培养基,用PBS清洗小室3次,然后用4%多聚甲醛固定,结晶紫溶液染色10 min,用PBS清洗小室3次,通过显微镜观察拍照。
2.5TOPflash/FOPflash双萤光素酶报告基因实验将SGC-7901细胞按每孔5 000个细胞的密度接种到96孔板中,实验分组为pFlag-PRRX2+TOP+pRL-TK(海肾萤光素酶报告基因载体)组、pFlag-PRRX2+FOP+pRL-TK组、pFlag-NC+TOP+pRL-TK组和pFlag-NC+FOP+pRL-TK组,按照上述分组转染相应质粒到SGC-7901细胞中,培养48 h后,收集细胞按Dual-Luciferase® Reporter Assay System试剂盒说明书操作,记录并分析数据。
2.6蛋白免疫共沉淀实验将SGC-7901细胞接种到100 mm细胞培养皿中,实验分组为 pFlag-PRRX2+pHA-β-catenin组和pFlag-NC+pHA-β-catenin组,按上述分组转染相应质粒到SGC-7901细胞,培养48 h后,收集细胞并加入细胞裂解液,放置冰上裂解10 min,4 ℃、12 000×g离心10 min后取上清液,分别加入相应抗体,4 ℃孵育1 h,每管加入15~20 μL Protein A/G琼脂糖珠,4 ℃孵育过夜,再以4 ℃、3 000 r/min离心5 min,弃去上清液,再用细胞裂解液轻柔洗涤沉淀中的Protein A/G琼脂糖珠3次,最后加入蛋白上样缓冲液,沸水煮蛋白5 min,通过Wes-tern blot检测目的蛋白,确定结合蛋白。
2.7Western blot收集各组细胞,利用RIPA裂解液裂解并用超声波破碎。通过BCA法检测蛋白质浓度。将40 μg各组蛋白通过SDS-PAGE,并转印到PVDF膜(Millipore)上。然后使用5%脱脂奶粉在室温下封闭膜1 h。封闭后,分别将膜与抗PRRX2、β-catenin、c-Myc和cyclin D1(均1∶1 000倍稀释)Ⅰ抗及内参照GAPDH(1∶5 000倍稀释)抗体4 ℃孵育过夜。用TBST缓冲液洗涤膜后,将膜与相应的相应Ⅱ抗在室温作用1 h。最后,将膜用TBST洗涤3次,并使用BeyoECL Plus试剂盒通过化学发光成像系统显影。
3 统计学处理
采用SPSS 13.0 软件进行统计学分析,数据以均数±标准差(mean±SD)表示。PRRX2在胃癌和正常胃组织中的表达水平差异分析采用t检验;PRRX2敲低或过表达组与对照组之间的比较采用两独立样本t检验。PRRX2与Wnt/β-catenin信号通路关键因子(WNT2、WNT3、AXIN1、CTNNB1、DVL1、DVL2、DVL3、GSK3β和CCND1)的相关性分析采用Pearson直线相关分析法;用Kaplan-Meier法和log-rank检验分析PRRX2表达水平与患者术后总生存率的关系,以P<0.05为差异有统计学意义。
结 果
1 PRRX2在胃癌组织和正常胃上皮组织中的表达水平及其在胃癌组织中的表达与胃癌患者总生存率的相关性
通过Oncomine、GEPIA和UCSC Cancer Browser数据库分析胃癌和正常胃上皮组织中PRRX2的mRNA表达水平和DNA拷贝数的差异,结果显示,与正常胃上皮组织相比,胃癌组织中PRRX2的mRNA表达水平及DNA拷贝数均增加(P<0.05)。另外,通过Kaplan-Meier plotter数据库分析显示,PRRX2的mRNA表达水平与胃癌患者的总生存率呈负相关(P<0.05),见图1。

Figure 1.The mRNA level (A~C) and DNA copy number (D) were analyzed by bioinformatics in Oncomine,UCSC Cancer Browser and GEPIA databases.The correlation of PRRX2 expression with gastric cancer patients’ overall survival probability was analyzed in Kaplan-Meier plotter database (E).*P<0.05vsgrastric adenocarcinoma.
图1生物信息学分析PRRX2在胃癌和正常组织中的表达水平及其在胃癌组织中的表达与胃癌患者总生存率的相关性
2 过表达和敲低PRRX2对胃癌细胞活力的影响
MTT结果显示过表达PRRX2能够增加SGC-7901细胞的活力(P<0.05);在MGC-803细胞中共转染靶向PRRX2的3个siRNA和阴性对照siR-NC,结果显示敲低PRRX2能够抑制MGC-803细胞的活力(P<0.05),见图2。
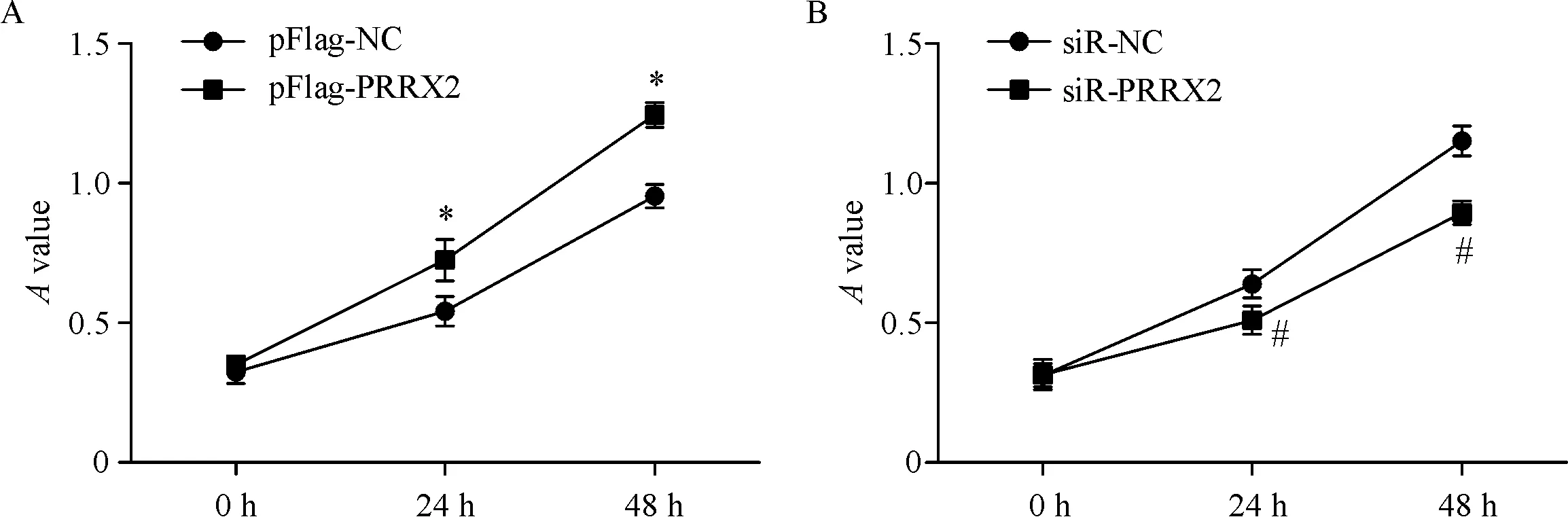
Figure 2.The effests of over-expression ofPRRX2 in the SGC-7901 cells (A) and knockdown ofPRRX2 in the MGC-803 cells (B) on cell activity.Mean±SD.n=3.*P<0.05vspFlag-NC;#P<0.05vssiR-NC.
图2PRRX2对胃癌细胞活力的影响
3 过表达和敲低PRRX2对胃癌细胞迁移能力的影响
Transwell实验结果显示过表达PRRX2能够增加SGC-7901细胞的迁移能力(P<0.05);敲低PRRX2能够抑制MGC-803细胞的迁移能力(P<0.05),见图3。
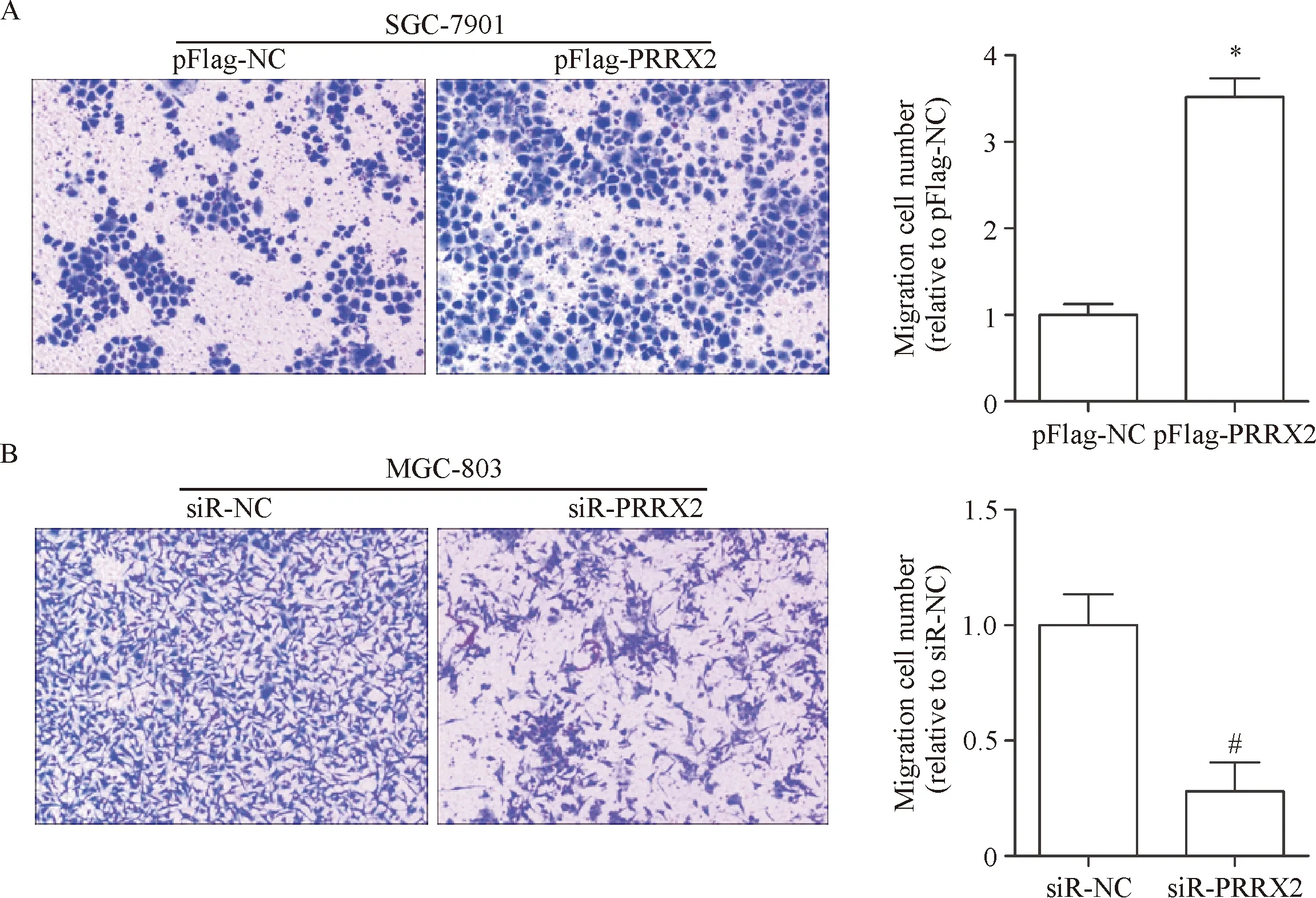
Figure 3.The effects of over-expression ofPRRX2 in the SGC-7901 cells (A) and knockdown ofPRRX2 in the MGC-803 cells (B) on the cell migration ability (×200).Mean±SD.n=3.*P<0.05vspFlag-NC;#P<0.05vssiR-NC.
图3PRRX2对胃癌细胞迁移能力的影响
4 生物信息学分析PRRX2与Wnt/β-catenin信号通路关键因子的相关性
通过GEPIA网站关联性分析显示,PRRX2与Wnt/β-catenin信号通路关键因子,如WNT2、WNT3、AXIN1、CTNNB1(β-catenin)、DVL1、DVL2、DVL3、GSK3β和CCND1(cyclin D1)显著相关(P<0.05),提示 PRRX2与Wnt/β-catenin信号通路可能存在密切关系,见图4。
5 过表达和敲低PRRX2对Wnt/β-catenin信号通路相关蛋白表达的影响
Western blot检测显示,过表达PRRX2能够显著增加Wnt/β-catenin信号通路相关蛋白β-catenin、c-Myc和cyclin D1的蛋白表达水平(P<0.05),激活Wnt/β-catenin信号通路;敲低PRRX2能够显著降低Wnt/β-catenin信号通路相关蛋白β-catenin、c-Myc、cyclin D1的蛋白表达水平(P<0.05),抑制Wnt/β-catenin信号通路,见图5。
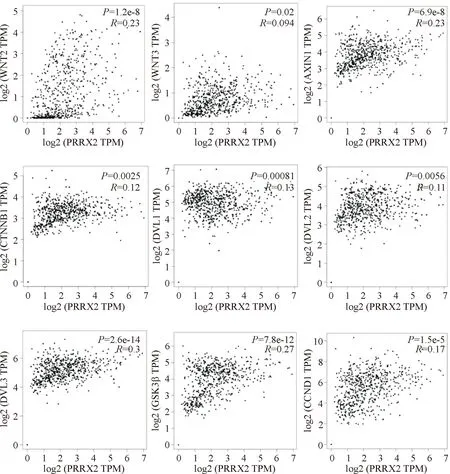
Figure 4.The correlations of PRRX2 with WNT2,WNT3,AXIN1,CTNNB1 (β-catenin),DVL1,DVL2,DVL3,GSK3β and CCND1 (cyclin D1) analyzed in GEPIA database.
图4生物信息学分析PRRX2与Wnt/β-catenin信号通路关键因子的相关性
6 过表达PRRX2对Wnt/β-catenin信号通路活性的影响
通过TOPflash/FOPflash双荧光素酶报告基因实验检测PRRX2对Wnt/β-catenin信号通路活性的影响。结果显示,过表达PRRX2能够显著增加TOPflash报告基因活性(P<0.05),提示过表达PRRX2能够显著激活Wnt/β-catenin信号通路,见图6。
7 胃癌细胞中PRRX2与β-catenin蛋白存在相互作用
在胃癌细胞SGC-7901中共转染pflag-PRRX2和pHA-β-catenin质粒,通过蛋白免疫共沉淀实验检测PRRX2与β-catenin蛋白之间的相互作用情况,结果显示胃癌细胞中PRRX2和β-catenin存在相互作用,见图7。
讨 论
胃癌是最常见的消化系统恶性肿瘤之一,由于诊断技术以及健康意识等原因,胃癌患者在出现症状并确诊时,大部分已经发生转移,即使能够通过手术治疗,但是术后五年生存率仍然很低[13]。PRRX2在胃癌发生发展中的作用尚不清楚,我们通过多种生物信息学技术分析了PRRX2与胃癌的相关性,结果显示PRRX2在胃癌组织中的mRNA表达水平明显增高,DNA拷贝数增加,更加重要的是,PRRX2的表达水平与胃癌患者的总生存率呈负相关,提示PRRX2可能在胃癌的发生发展中起着癌基因的作用。
研究显示,PRRX2在乳腺癌组织中的表达水平明显升高,作为乳腺上皮细胞中的新型TGF-β诱导因子,其表达上调能够增强乳腺细胞的迁移和侵袭能力,并诱导上皮间质转化(epithelial-mesenchymal transition,EMT)的发生[9]。另外,PRRX2的致癌作用涉及急性骨髓性白血病的发生,其中易位是由核蛋白基因NUP98和PRRX2的融合介导的[11]。通过分析转移性和非转移性胃癌组织的转录组差异,PRRX2被确定为转移性胃癌的特异性转录因子[12],但是其作用机制不明。同样地,食管鳞癌的相关测序分析也提示PRRX2可能参与食管鳞癌的发生发展[10]。另外,研究人员通过分析前列腺癌组织和配对的正常组织发现,PRRX2表达差异显著,可作为鉴别前列腺癌的生物标志物[8]。

Figure 5.The effects of over-expression ofPRRX2 in the SGC-7901 cells (A) and knockdown of PRRX2 in the MGC-803 cells (B) on protein expression of Wnt/β-catenin signal pathway.Mean±SD.n=3.*P<0.05vspFlag-NC;#P<0.05vssiR-NC.
图5PRRX2对Wnt/β-catenin信号通路相关蛋白表达的影响
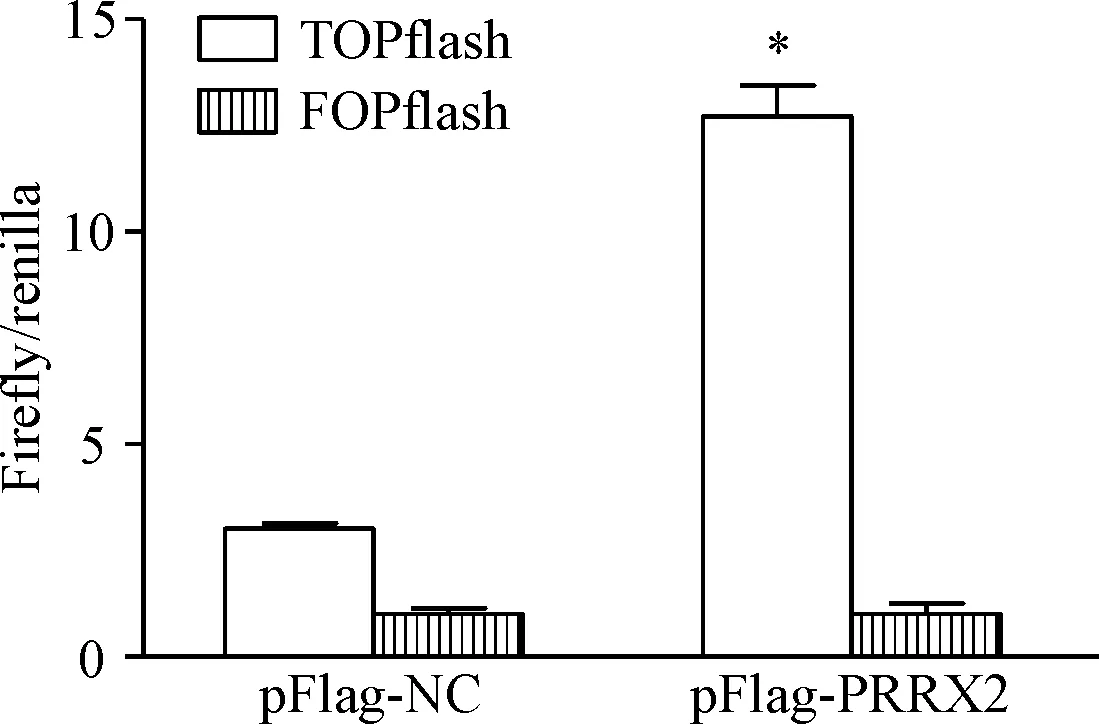
Figure 6.Over-expression ofPRRX2 enhanced the activity of TOPflash/FOPflash dual-luciferase reporter gene in the SGC-7901 cells.Mean±SD.n=3.*P<0.05vspFlag-NC.
图6PRRX2对Wnt/β-catenin信号通路活性的影响
Wnt/β-catenin信号通路在肿瘤的发生发展中起着重要的作用,其过度激活能够促进其靶基因,如c-myc和cyclin D1等的表达,从而促进细胞的增殖和迁移,而抑制其活性则可降低细胞的增殖和迁移能力[14-15]。在胃癌研究中发现,Wnt/β-catenin信号通路抑制因子SFRP2因高甲基化导致的表达水平降低可引起Wnt/β-catenin信号通路持续异常激活,促进c-Myc、cyclin D1及survivin过度表达,引起细胞过度增殖及凋亡减弱,进而诱导肿瘤的发生[16]。在另一项研究中也发现胃癌和癌前病变组织中存在Wnt/β-catenin信号通路靶基因c-myc等的表达水平差异[17]。在本研究中,我们通过在胃癌细胞中敲低和过表达PRRX2基因,发现PRRX2过表达或敲低能够增加或减弱胃癌细胞的增殖和迁移能力,同时能够激活或抑制Wnt/β-catenin信号通路,因此,我们推测在胃癌细胞中PRRX2表达上调可通过激活Wnt/β-catenin信号通路,促进靶基因c-myc和cyclin D1等经典癌基因的表达来促进肿瘤细胞的增殖和迁移。

Figure 7.PRRX2 interacted with β-catenin in SGC-7901 cells.
图7胃癌细胞中PRRX2与β-catenin蛋白存在相互作用
为了进一步探讨PRRX2对于Wnt/β-catenin信号通路的调控机制,我们通过生物信息学预测发现PRRX2与β-catenin蛋白可能存在相互作用。接下来,我们通过蛋白质免疫共沉淀实验初步验证了以上的预测。而更进一步地探讨PRRX2和β-catenin蛋白的具体结合位点以及调控机制将是我们接下来研究的重点。
综上所述,本研究首先通过生物信息学分析发现胃癌组织和正常胃上皮组织中PRRX2的表达水平存在差异,而且其表达水平与胃癌患者的总生存率呈负相关。继而,我们通过细胞生物学实验发现,PRRX2能够促进胃癌细胞的生长和迁移能力,而这种作用可能与Wnt/β-catenin信号通路的激活密切相关。这些结果提示PRRX2可能作为癌基因参与胃癌的发生发展,并可能成为一种新的胃癌诊断和判断预后的标志物以及治疗靶点。
[参考文献]
[1]Brenner H,Rothenbacher D,Arndt V.Epidemiology of stomach cancer[J].Methods Mol Biol,2009,472:467-477.
[2]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[3]Mathers CD,Shibuya K,Boschi-Pinto C,et al.Global and regional estimates of cancer mortality and incidence by site:I.Application of regional cancer survival model to estimate cancer mortality distribution by site[J].BMC cancer,2002,2:36.
[4]Lee JH,Kim KM,Cheong JH,et al.Current management and future strategies of gastric cancer[J].Yonsei Med J,2012,53(2):248-257.
[5]Hohenberger P,Gretschel S.Gastric cancer[J].Lancet,2003,362(9380):305-315.
[6]Smyth EC,Verheij M,Allum W,et al.Gastric cancer:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2016,27(suppl 5):v38-v49.
[7]ten Berge D,Brouwer A,Korving J,et al.Prx1 and Prx2 in skeletogenesis:roles in the craniofacial region,inner ear and limbs[J].Development,1998,125(19):3831-3842.
[8]Nikitina AS,Sharova EI,Danilenko SA,et al.Novel RNA biomarkers of prostate cancer revealed by RNA-seq analysis of formalin-fixed samples obtained from Russian patients[J].Oncotarget,2017,8(20)32990-33001.
[9]Juang YL,Jeng YM,Chen CL,et al.PRRX2 as a novel TGF-β-induced factor enhances invasion and migration in mammary epithelial cell and correlates with poor prognosis in breast cancer[J].Mol Carcinog,2016,55(12):2247-2259.
[10] Wu BL,Luo LW,Li CQ,et al.Comprehensive bioinformation analysis of the mRNA profile of fascin knockdown in esophageal squamous cell carcinoma[J].Asian Pac J Cancer Prev,2013,14(12):7221-7227.
[11] Gervais C,Mauvieux L,Perrusson N,et al.A new translocation t(9;11)(q34;p15) fuses NUP98 to a novel homeobox partner gene,PRRX2,in a therapy-related acute myeloid leukemia[J].Leukemia,2005,19(1):145-148.
[12] Feng D,Ye X,Zhu Z,et al.Comparative transcriptome analysis between metastatic and non-metastatic gastric cancer reveals potential biomarkers[J].Mol Med Rep,2015,11(1):386-392.
[13] Ghosn M,Tabchi S,Kourie HR,et al.Metastatic gastric cancer treatment:second line and beyond[J].World J Gastroenterol,2016,22(11):3069-3077.
[14] 滕颖,王秀问,王亚伟,等.小干扰RNA干扰β连环素表达对肺腺癌A549细胞Wnt信号通路的作用[J].中华医学杂志,2010,90(14):988-992.
[15] 陈刚,牟伦盼,姚瑾,等.用RNA干扰腺病毒载体研究Wnt/β-连环蛋白信号途径对人甲状腺细胞增殖的影响[J].中华医学杂志,2008,88(40):2821-2825.
[16] 赵成海,卜献民,张宁,等.Wnt拮抗因子SFRP2在胃癌中的甲基化和异常表达[J].中国病理生理杂志,2009,25(8):1617-1620.
[17] 孙抒,孙百研,智慧兰,等.胃癌及其癌前病变中细胞凋亡及其调控基因的表达[J].中国病理生理杂志,2002,18(4):395-397.

