牵张应力刺激介导间充质干细胞的信使RNA和长链非编码RNA表达谱变化
邹庆宝 靳松 黄爱军
间充质干细胞(mesenchymal stem cell,MSC)是人体内重要的多能干细胞,广泛存在与骨髓、脂肪和肌腱止点等结缔组织中,除了具有支持造血干细胞的作用外,还具有对免疫系统多种细胞的抑制能力[1]。除此之外,MSC还具有强大的多向分化能力,可以在不同条件下分化为骨细胞、脂肪细胞和软骨细胞[2]。新近研究显示,人体内的成骨细胞主要由MSC分化而来[3]。由于具有体外易于扩增、免疫原性低的特点,近年来MSC已在组织修复重建、生物医学工程中广泛使用,具有良好的临床应用前景[4]。
机械应力,特别是牵张应力,是影响人体内骨骼形成与发育的关键原因之一,是维持骨组织应力平衡的重要因素[5]。近年来,许多研究已经证实牵张应力可以通过改变MSC基因表达谱以影响其成骨分化能力,从而参与调控机体内的骨修复与重建平衡,但目前机制尚未完全阐明[6]。
长链非编码RNA(long non-coding RNA,lnc- RNA)是一种长度大于200 nt、不具备编码蛋白质能力的RNA片段。既往认为,非编码RNA只是细胞转录过程中出现的无用物质,然而新近的研究却显示lnc-RNA可以通过多种方式,参与细胞中各种功能的调控[7]。已有研究发现,lnc-RNA可以参与MSC成骨分化的调控,但lnc-RNA是否参与了牵张应力介导的MSC成骨分化,目前尚没有研究[8]。在本研究中,对牵张应力刺激下的MSC成骨分化能力及其lnc-RNA表达谱进行检测,现报道如下。
材料与方法
一、主要材料与仪器
1.主要材料:DMEM培养基、0.25﹪胰蛋白酶-EDTA(美国Gibco公司);胎牛血清(美国Gibco公司);CBA蛋白定量试剂盒(康为公司);碱性磷酸酶检测试剂盒(南京建成公司);PBS缓冲液、RIPA蛋白提取液、Percoll分离液、氯仿、异丙醇、无水乙醇、DEPC水、多聚甲醛溶液(碧云天公司);地塞米松、β-磷酸甘油、抗坏血酸、氯化十六烷基吡啶(CPC)、茜素红染色试剂盒(美国Sigma公司); Trizol提取液(美国Life公司);cDNA逆转录试剂盒(日本TAKARA公司);Affymetrix mRNA+长链非编码RNA表达谱芯片(美国Life公司);FlexCell 6孔细胞培养板(美国FlexCell公司);离心 管(15 ml、50 ml)、25 cm2培养 瓶、96 孔板(美 国Corning公司);移液器(德国Eppendorf公司)。
2.仪器:生物安全柜、CO2恒温培养箱、低温高速离心机、Nano分光光度计、酶标仪、PCR仪(美国Thermo Fisher公司);FlexCell细胞牵张应力系统(美国FlexCell公司);倒置相差显微镜(日本Olympus公司);Hybridization Oven、Fluidics Station、GeneChip Scanner 3000 (美国Affymetrix公司)。
二、方法
1.正常MSC体外分离、培养:本研究获得中山大学附属第八医院伦理委员会审批通过,所有骨髓捐献志愿者均知晓本研究操作所具有的全部风险,并签署知情同意书。
本研究共募集6名骨髓捐献正常志愿者,其中男3人、女3人、年龄(25.6±3.4)岁,排除禁忌症后按照标准方法行骨髓穿刺术。穿刺成功后抽取骨髓5 ml,加入50 ml离心管中,并加入10 ml PBS缓冲液充分混匀。随后将稀释的骨髓样本用注射器缓慢加入等量Percoll分离液,保持两者液面稳定。以500×g离心10 min,离心后可见两液相界面有白色膜状层。用移液器吸取中间白膜层,加入10 ml PBS缓冲液充分混匀,以500×g离心10 min,离心后可见细胞团块沉淀于离心管底部。用含10﹪胎牛血清的DMEM培养基重悬细胞,进行细胞计数后以2×106个/cm2的密度接种于25 cm2培养瓶中,放置于37 ℃、5﹪CO2细胞培养箱中培养。48 h后弃去培养瓶中培养基,用PBS缓冲液轻轻摇晃,洗去未贴壁细胞,加入新的含10﹪胎牛血清的DMEM培养基继续培养。此后每3天换液1次,当细胞达到80﹪~ 90﹪融合时,0.25﹪胰蛋白酶-EDTA消化传代,第3代细胞用于进行下一步实验。MSC分为应力组与非应力组,应力组为接受应力刺激的MSC,无应力组为未接收应力刺激的对照MSC。
2.成骨分化诱导与牵张应力刺激:第3代MSC培养达90﹪融合时,按上述方法进行消化、计数,以1×105个/孔的密度接种于FlexCell 6孔板中,待细胞完全贴壁后换为成骨诱导培养基(含10﹪胎牛血清、50 mg/L抗坏血酸、10 mmol/L β-磷酸甘油、10 nmol/L地塞米松的DMEM),放置于37℃、5﹪CO2环境下的FlexCell细胞牵张应力系统进行培养,牵张应力设置条件为5﹪形变、频率0.1 Hz、作用时间为每天4 h。此后每3天全量更换成骨诱导培养基至相应实验时间。
3.茜素红染色与定量:MSC在牵张应力刺激下进行成骨诱导至相应时间点,弃去上清液,用PBS缓冲液轻轻清洗3次,随后用4﹪多聚甲醛溶液在室温下孵育固定5 min。弃去多聚甲醛溶液,用PBS缓冲液清洗3次,每孔加入茜素红染色液2 ml,于室温下染色10 min。染色完成后加入PBS缓冲液3 ml,于摇床上缓慢清洗5 min(3次),洗去非特异性染色与杂质,于倒置相差显微镜下拍照记录。拍照完成后,每孔加入1 ml的氯化十六烷基吡啶萃取液,于摇床上室温孵育1 h,充分萃取染色。用移液器吸取200 μl萃取液加入96孔板中,于酶标仪下测定吸光度。
4.碱性磷酸酶活性测定:MSC诱导至10 d后,弃去上清液,用PBS缓冲液轻轻清洗3次每孔加入RIPA蛋白裂解液100 μl,冰上放置30 min。随后吸取蛋白裂解液,于4℃下以3 000×g离心10 min。按照试剂盒方法配置碱性磷酸酶反应液,于96孔板中每孔加入反应液100 μl,同时加入蛋白上清30 μl,37 ℃孵育 15 min。随后每孔加入显色液 150 μl,充分混匀后通过酶标仪测吸光度。部分离心后的蛋白上清通过BCA蛋白浓度试剂盒测定蛋白浓度,对碱性磷酸酶进行标准化定量。
5.RNA提取:牵张应力刺激下MSC成骨诱导至第7天,用PBS缓冲液轻轻清洗3次。每孔加入Trizol提取液1 ml,充分混匀后于冰上裂解5 min。将裂解液转移至无酶EP管中,每管加入三氯甲烷200 μl,剧烈震荡混匀后静置 5 min,随后 3 000×g离心10 min。离心后吸取上层水相液体并转移入新的无酶EP管中,每管加入等量异丙醇,室温静置10 min后于3 000×g离心10 min。离心后可见RNA团块沉淀于EP管底部,弃去上清液,加入75﹪乙醇1 ml充分混匀进行洗涤,以1 500×g离心10 min。弃去75﹪乙醇,加入20 μl无酶灭菌水。于Nanodrop紫外分光光度计下检测RNA浓度与纯度。
6.cDNA逆转录:按照逆转录试剂盒方法,取无酶 EP 管,每管加入逆转录试剂 2 μl、RNA 8 μl,于PCR仪中以37 ℃孵育15 min。逆转录后cDNA加入40 μl DEPC水进行稀释备用。
7.表达谱芯片检测:逆转录完成的cDNA经过标记、芯片杂交、清洗、染色、扫描,收集数据后采用AGCC等软件进行分析,实验方法按照既往文献报道方案进行[8]。实验完成后使用Agilent Feature Extraction(v10.7)软件对杂交图片进行分析并提取数据,然后使用 Agilent GeneSpring 软件对数据进行归一化和差异分析。
8.生物信息学分析:对差异表达的mRNA进行 KEGG(https://www.kegg.jp/kegg/pathway.html)信息学分析汇总,筛查差异表达的相关信号通路。根据序列相似性和表达相关性进行比对分析,鉴定lnc-RNA与mRNA共表达子集。通过NCBI-Blast程序比对共表达子集的lnc-RNA和mRNA的序列相关性。
三、统计学分析方法
采用SPSS 13.0软件进行统计,茜素红定量、碱性磷酸酶活性结果以表示,成骨 0天、14天应力组与无应力组的茜素红定量、碱性磷酸酶定量结果采用两样本t检验进行比较,以P< 0.05为差异具有统计学意义。
结 果
一、牵张应力促进MSC成骨分化
将MSC接种于胶原I孵育的6孔板中,置于FlexCell细胞牵张应力系统,在5﹪形变、0.1 Hz、4 h/d条件下进行成骨诱导,发现应力刺激下的MSC在成骨诱导第10天碱性磷酸酶活性达(265.3±31.2) U/L,而无应力组MSC成骨诱导第10天碱性磷酸酶活性仅为(121.2±21.2) U/L,应力组高于无应力组,差异具有统计学意义(P< 0.05)。此外,成骨诱导第14天应力组MSC茜素红染色较无应力组MSC加深,应力组MSC茜素红定量OD值达1.46±0.19,无应力组MSC茜素红定量为0.62±0.08,应力组高于无应力组,差异具有统计学意义(P< 0.05)。这提示牵张应力可以促进MSC成骨分化(图 1)。

图1 应力刺激下MSC成骨分化能力观察(茜素红染色,×40)
二、牵张应力刺激下MSC成骨分化mRNA和lnc-RNA表达谱
在成骨诱导第7天,分别提取无应力组与应力刺激组MSC的RNA进行全基因组mRNA+lnc-RNA表达谱芯片实验。通过实验,发现差异表达的mRNA共有598个,其中上调的mRNA有313个、下调的mRNA有285个(图2A),差异表达的前5 位的mRNA详见表1。此外,发现差异表达的lnc-RNA有329个,其中上调lnc-RNA有151个,下调的lnc-RNA有178个(图2B),差异表达的前5位的lnc-RNA详见表2。对差异表达的lnc-RNA进行分类,其中基因间lnc-RNA有92个、内含子lnc-RNA有64个、正义链lnc-RNA有84个、反义链lnc-RNA有61个,双向lnc-RNA有28个。这些结果提示应力刺激下MSC的mRNA和lnc-RNA表达谱发生显著改变,从而影响其成骨分化能力。
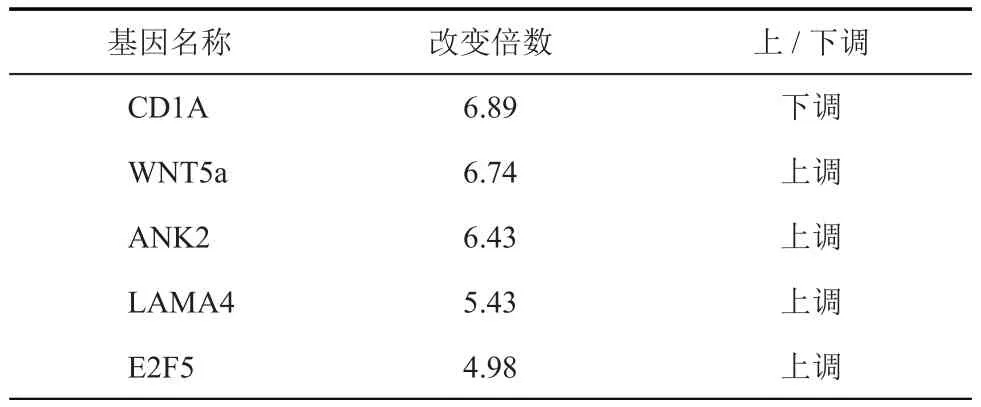
表1 差异表达的前5位的mRNA
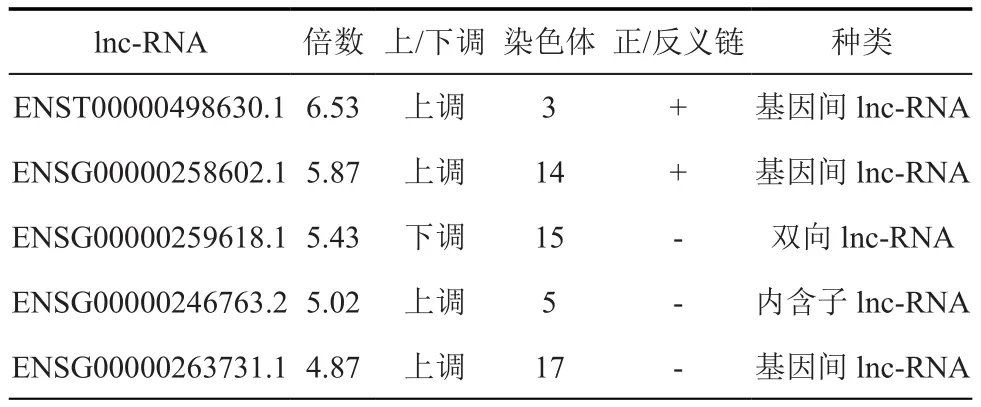
表2 差异表达的前5位的lnc-RNA
三、差异mRNA和Lnc-RNA的生物信息学分析
为了探讨差异mRNA相关的信号通路及其对应功能,进行KEGG生物信息学分析。通过分析,发现有5个信号通路的表达变化具有统计学意义,分别为WNT/β信号通路、Cytokine-Cytokine receptor信号 通路、Cell Cycle信号 通 路、Focal Adhesion信号通路和Lipoic acid metabolism 信号通路。WNT信号通路是差异表达最显著的信号通路,共有11个差异表达基因,其中WNT5a上调最为明显(6.74倍)(表 3)。
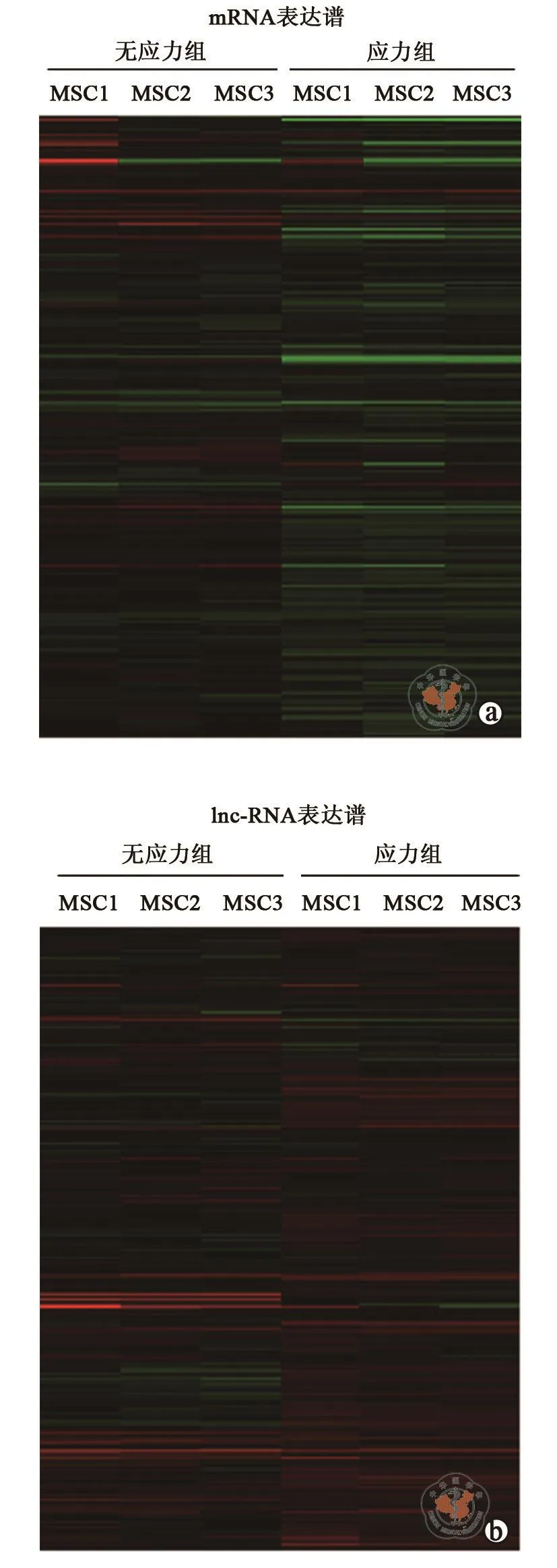
图2 应力刺激下MSC的mRNA和lnc-RNA表达谱
为了探讨WNT5a表达上调的机制,以WNT5a的表达和序列为基础,与差异表达的329个lnc-RNA进行共表达相关性分析和序列比对分析。通过分析,发现有3个差异表达的lnc-RNA与WNT5a具有共表达相关性,分别为 ENSG00000237298.2、ENSG00000241956.5 和ENSG00000187229.3(表4);通过序列对比分析,结果提示ENSG00000237298.2序列中与WNT5a的编码序列有部分结合位点,提示WNT5a可能是受到ENSG00000237298.2表达调控的靶基因,将ENSG00000237298.2命 名 为lnc-RNA-SSR(long non-coding RNA Strain Stimulation Related)。 这 些结果提示在应力刺激下,lnc-RNA-SSR的表达增加,从而上调WNT5a表达、促进MSC成骨分化。
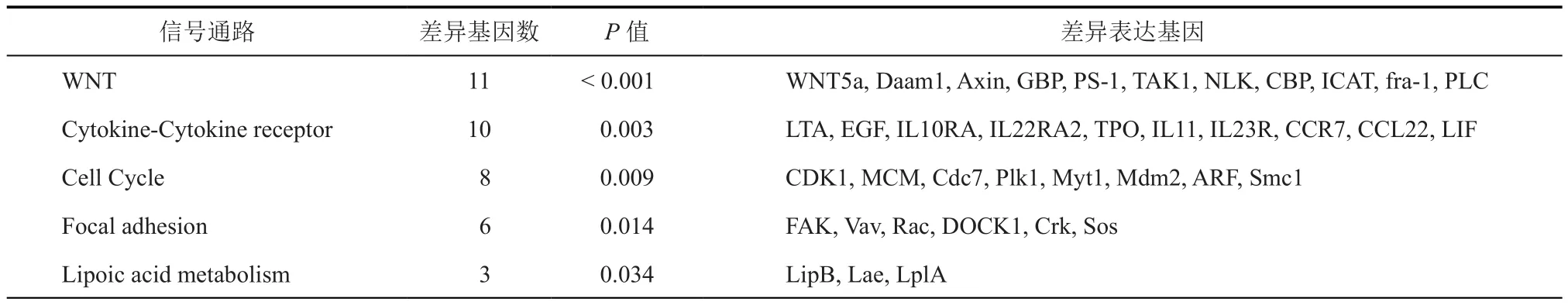
表3 KEGG分析差异表达信号通路

表4 与WNT5a共表达的lnc-RNA分析
讨 论
1974年,国外学者Friedenstein等[9]首次证实在骨髓微环境中存在成纤维细胞样、长梭型细胞,并将其命名为间充质干细胞(MSC),这些细胞作为骨髓微环境壁龛细胞,具有支持造血干细胞的重要功能。随后的研究发现,MSC广泛存在于人体多种组织中,除了在骨髓中含量丰富之外,还存在于脂肪、脐带等多种结缔组织和外周血循环中[1]。新近研究显示,MSC不仅具有强大的免疫调节能力和较低的免疫原性,还具有多项分化的功能,可以分化为成骨细胞、成脂细胞和成软骨细胞。近年来,一系列的实验均证实,MSC是人体内成骨细胞的主要来源[3]。MSC强大的成骨分化功能使其可以广泛应用于骨折修复、损伤重建等组织再生工程中,具有广泛的应用前景[4]。
机械应力是一种广泛存在于人体中的物理刺激信号,而牵张应力是其中最重要的一类机械应力刺激。牵张应力存在于所有细胞微环境中,主要由肌肉产生并直接作用于骨骼,直接对骨骼相关细胞的增殖、凋亡和分化等功能产生重要影响,从而影响局部骨组织骨量[10]。当人体处于低牵张应力情况下(失重、长期卧床),则会导致骨量降低;而当人体处于高牵张应力、骨组织载荷增加情况下(运动员),则会增加机体骨量[11]。这主要是由于牵张应力影响MSC成骨分化所决定的。MSC的成骨分化能力受到环境刺激、炎症因子等多种因素的影响。大量实验结果表明,适当增加牵张应力刺激可以促进MSC成骨分化,牵张应力预刺激下MSC移植后组织修复能力增强,大大提高了其在组织工程修复中的作用[12]。进一步深入探讨牵张应力刺激调控MSC成骨分化功能的机制,对于推动MSC临床应用意义重大。
在本研究中,通过茜素红和碱性磷酸酶实验,进一步证实5﹪形变、0.1 Hz、4 h/d条件下牵张应力刺激可以促进MSC的成骨分化能力,这与既往文献报道的结果一致[12]。此外,笔者也对不同牵张应力刺激条件进行摸索,发现过强的牵张应力刺激会大量诱导MSC凋亡,从而影响其成骨分化。这与临床观察中,适当的应力或受力可以促进骨折愈合,但是过大过强的应力刺激则会导致骨折延迟愈合的现象一致。此外,笔者进一步对成骨诱导分化后、牵张应力刺激下的MSC进行全基因组表达谱芯片分析。经过分析,共发现对比无应力组,牵张应力刺激下MSC共有598个基因差异表达,其中上调的有313个、下调285个。笔者进一步对差异表达的基因进行生物信息学分析,结果发现差异表达的基因汇聚后共有5个信号通路存在异常表达,分别为WNT信号通路、Cytokine-Cytokine receptor信号通路、Cell Cycle信号通路、Focal Adhesion信号通路和Lipoic acid metabolism 信号通路,提示这些信号通路是牵张应力介导MSC成骨分化能力增强的关键。
WNT信号通路是介导MSC成骨分化的重要通路之一。已有研究证实,WNT信号通路激活可以促进MSC成骨分化[13]。WNT5a是WNT家族的一员,作为外分泌分子,WNT5a主要发挥激活WNT通路的作用,广泛调控机体内的多种细胞,参与组织发育、肿瘤生长等多种生理和病理过程[14]。既往已有研究提示WNT5a可以促进MSC成骨分化[12]。在本研究中,发现WNT5a上调达6.74倍,为差异表达倍数最明显的第二位基因。笔者推测,牵张应力刺激导致MSC自分泌WNT5a增加,从而激活WNT信号通路,导致MSC成骨分化能力增强。
长链非编码RNA是近年来研究的热点,是一种长度大于200 nt、不具备编码蛋白质能力的RNA片段。lnc-RNA包括基因间、内含子等多种类型,存在于细胞核内或细胞质中,可以在转录和转录后水平调控多种细胞的功能[7]。已有研究发现lnc-RNA对MSC成骨分化的功能发挥调节作用[8],但在牵张应力下MSC的lnc-RNA表达是否发生改变、是否参与了对MSC成骨分化功能的调控,目前尚未见研究。在本研究中,对成骨诱导分化后、牵张应力刺激下的MSC进行lnc-RNA表达谱芯片分析,发现牵张应力刺激后MSC的lnc-RNA表达谱发生差异改变,差异表达lnc-RNA达329个,提示lnc-RNA参与了牵张应力介导MSC成骨分化的过程。
lnc-RNA可以通过多种方式参与基因表达调控,但是发挥调控功能需具备2个前提:一是lnc-RNA与靶基因具有表达相关性,即具有共表达关系;二是lnc-RNA需存在与靶基因可能结合的位点[15]。基于上述两个条件,笔者对以目标基因WNT5a作为核心进行共表达分析和序列比对分析,以进一步明确具体调控牵张应力刺激下MSC成骨分化的关键lnc-RNA。本研究发现lnc-RNASSR在牵张应力刺激下上调达4.11倍,且其表达与WNT5a的表达具有相关性,这说明2个分子之间存在明显的表达联系。进一步通过生物信息学分析,发现lnc-RNA-SSR与WNT5a编码序列有部分预测结合位点,这个结果提示lnc-RNASSR可能与WNT5a的mRNA序列结合。已有许多研究发现,lnc-RNA可与基因的转录本进行结合,对其发挥转录后修饰与调控作用,从而影响其表达水平[15]。笔者推测,lnc-RNA-SSR可能通过直接结合WNT5a编码序列,以调控其表达水平改变,这需要在未来的研究中通过实验进一步证明。此外,本研究虽还发现ENSG00000241956.5、ENSG00000187229.3与WNT5a有共表达关系,但由于生物信息学预测提示二者之间不存在结合位点,提示 ENSG00000241956.5、ENSG00000187229.3仅仅是成骨过程中伴随出现的转录本,不对WNT5a进行调控。
综上所述,在本研究中进一步证实牵张应力刺激下MSC的lnc-RNA表达谱发现明显变化、成骨分化能力显著增强。这可能是由于lnc-RNA-SSR表达上调,通过特异性调控WNT5a自分泌增加,从而介导WNT信号通路激活,最终导致MSC成骨分化增强。本研究探索了lnc-RNA表达谱在牵张应力介导MSC成骨分化中的作用,对于促进MSC特异性分化及在组织再生工程中的应用,具有重要意义。然而,本研究尚有不足,具体lnc-RNA-SSR调控WNT5a表达及WNT信号通路激活的机制尚未完全阐明,仍需要再未来的研究中进一步探索。

