脐带间充质干细胞介导TLR4/NF-κB炎症通路及氧化应激改善NAFLD大鼠肝脏损伤作用研究
王文清 易文城 林拥华
伴随着社会进步和生活方式改变,非酒精性脂肪肝病(non alcohol fatty liver disease,NAFLD)发病率呈现逐年攀升趋势,而且患者渐趋低龄化,已成为本世纪重要的公共健康问题之一[1]。目前NAFLD确切的发病机制尚未阐明,除了公认的“两次胰岛素抵抗打击”,还有研究提示其发病与机体炎症反应和氧化应激相关[2-3]。而脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)具有独特的直接和间接修复机体多种组织功能的作用[4],但其对NAFLD肝脏受损的作用及机制研究鲜见报道。故本实验设计随机对照动物实验探讨hUC-MSCs对NAFLD大鼠肝脏损伤的作用及其与TLR4/NF-κB和氧化应激的关系。
材料与方法
一、材料
1.动物:清洁级SD大鼠34只,购自上海斯莱克实验动物有限责任公司,基础适应性饲养7 d。
2.hUC-MSCs:hUC-MSCs制备方法为剪取足月产妇脐带基质组织块,采用胶原酶Ⅳ消化,留取悬液,离心、萃取,沉淀,再以0.05﹪胰蛋白酶消化,过滤,留取含有细胞滤液,离心、计数细胞,采用不含血清的低糖DMEM培养基接种、常规培养及传代。本实验选用第3 ~ 7代细胞。
二、方法
1.NAFLD造模方法:采用高糖高脂饲料8周喂养SD大鼠建立NAFLD模型。饲料配方62.5﹪基础饲料、20﹪蔗糖、15﹪猪油和2.5﹪胆固醇。
2.实验大鼠分组:SD大鼠随机分为正常对照组(NC组)和NAFLD造模组。NC组10只以常规饲料喂养。NAFLD造模大鼠20只再次随机分为模型对照组(MC组)和hUC-MSCs治疗组(MC+hUCMSCs组)。MC组和MC+hUC- MSCs组大鼠均继续给予高糖高脂饲料喂养,其中,MC+hUC-MSCs组每两周尾静脉注射含hUC-MSCs数目为5×106个的培养液100 μl,共干预8周。
3.实验大鼠治疗方法:MC+hUC-MSCs组每两周尾静脉注射100 μl含5×106个hUC-MSCs的培养液,NC组和MC组每两周尾静脉注射不含hUC- MSCs的等容积培养液。治疗时间共8周。
4.实验大鼠一般指标观察、血清及肝脏组织标本的采集:密切观察并记录大鼠饮食、精神、活动状态和体重等一般状况;治疗8周后各组大鼠以尾静脉采血方式留取血清标本,并称鼠体重和鼠肝湿重,计算肝指数(﹪)=(肝湿重/体重)×100﹪,剪取肝脏组织标本并给予适宜保存。
5.血清相关指标:甘油三酯(TG)、胆固醇(TC)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、空腹血糖(FPG)和空腹胰岛素(FINS);计算胰岛素抵抗指数(HOMA-IR)=FPG×FINS/22.5(FPG:mmol/L,FINS:mU/L)。
6.大鼠肝脏组织行HE染色并采用光镜和透射电镜观察组织病理:遵循美国国立卫生研究院2011年NASH临床研究网病理工作组指南,评定NAFLD 活动度积分(NAFLD activity score,NAS),分级为 0 ~ 8分,包括:(1)肝细胞脂肪变:0分(< 5﹪);1分(5﹪~ 33﹪);2分(34﹪~ 66﹪);3 分(> 66﹪)。(2)小叶内炎症(20倍镜计数坏死灶):0分,无;1分(< 2个);2分(2 ~ 4个);3分(> 4 个)。(3)肝细胞气球样变:0分,无;1分,少见;2分,多见。
7.Western Blot法检测组织蛋白表达:取大鼠肝脏组织经PBS漂洗,组织裂解液提取总蛋白,聚丙烯酰胺琼脂糖凝胶电泳,将蛋白质转移至PVDF膜,封闭后加 VEGF抗体(1:1 000)、抗 HIF-1α抗体(1:1 000)、β-action(1:5 000)过夜,TBCT 漂洗再加入辣根过氧化物酶标记的二抗,室温孵育,TBGT漂洗,加入ECL暗室曝光,用Fluor-s凝胶系统分析蛋白条带,蛋白的相对含量以目的蛋白吸光密度面积与GAPDH条带的比值表示。检测各组大鼠肝脏组织 8-OHdG、SOD、TNF-α、IL-6、TLR4和 NF-κB等蛋白表达。
三、统计学分析方法
采用SPSS 20.0统计软件,肝指数、谷丙转氨酶、谷草转氨酶、甘油三酯、胆固醇、低密度脂蛋白、高密度脂蛋白和胰岛素抵抗指数用± s表示,组间比较采用单因素方差分析。以P< 0.05为差异具有统计学意义。
结 果
一、比较各组大鼠治疗8周后体重、肝湿重和肝指数
治疗8周后,与NC组比较,MC组和MC+hUC-MSCs组大鼠体重、肝湿重和肝指数均增高(P<0.05),与 MC 组比较,MC+hUC-MSCs组大鼠体重、肝湿重和肝指数均降低(P<0.05,表 1)。
表1 各组大鼠治疗8周体重、肝湿重和肝指数比较(± s)
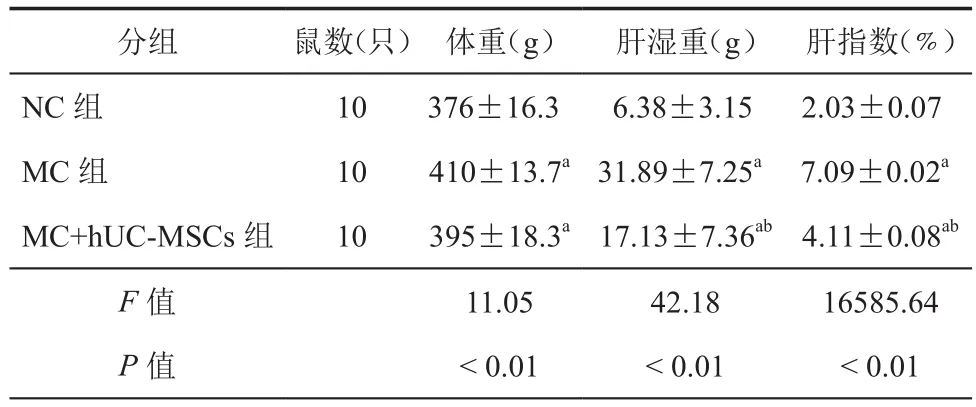
表1 各组大鼠治疗8周体重、肝湿重和肝指数比较(± s)
注:NC组为正常对照组;MC组为模型对照组;hUC-MSCs治疗组为MC+hUC-MSCs组与NC组比较,aP< 0.01;与MC组比较,bP< 0.01
分组 鼠数(只) 体重(g) 肝湿重(g) 肝指数(﹪)NC 组 10 376±16.3 6.38±3.15 2.03±0.07 MC 组 10 410±13.7a31.89±7.25a 7.09±0.02a MC+hUC-MSCs组 10 395±18.3a17.13±7.36ab4.11±0.08ab F值 11.05 42.18 16585.64 P值 < 0.01 < 0.01 < 0.01
二、比较各组大鼠治疗8周后TG、TC、LDL、HDL
治疗8周后,与NC组比较,MC组大鼠TG、TC 和 LDL 增高(P< 0.05),HDL 降低(P< 0.05);与MC组比较,MC+hUC-MSCs组大鼠TG、TC和LDL 均有不同程度降低(P< 0.05),HDL 增高(P<0.05,表 2)。
三、比较各组大鼠治疗8周后ALT、AST和HOMA-IR
治疗8周后,与NC组比较,MC组大鼠ALT、AST和HOMA-IR均升高(P< 0.05);与MC 组比较,MC+hUC-MSCs组大鼠ALT、AST和HOMAIR 均有不同程度的降低(P< 0.05,表 3)。
四、比较各组大鼠治疗8周后HE染色光镜下肝脏组织病理变化
NC组大鼠肝细胞形态正常,细胞核清晰,肝小叶排列有序;MC组大鼠肝细胞呈弥漫性脂肪变性,胞核变形,肝小叶紊乱伴炎症细胞浸润;MC+hUCMSCs组上述肝组织病理改变好转,肝细胞较少脂肪变性,大部分胞核清晰,肝小叶排列紊乱改善,仅少量炎症细胞浸润。(图1)
五、比较各组大鼠治疗8周后NAS积分
干预8周,与NC组比较,MC组大鼠NAS积分增高;与MC组比较,hUC- MSCs治疗组大鼠NAS 积分降低 [(0.36±0.16)分vs(8.72±0.35)分、(4.78±0.51)分,(P< 0.05)]。
表2 各组大鼠治疗8周TG、TC、LDL、HDL比较(mmol/L± s)
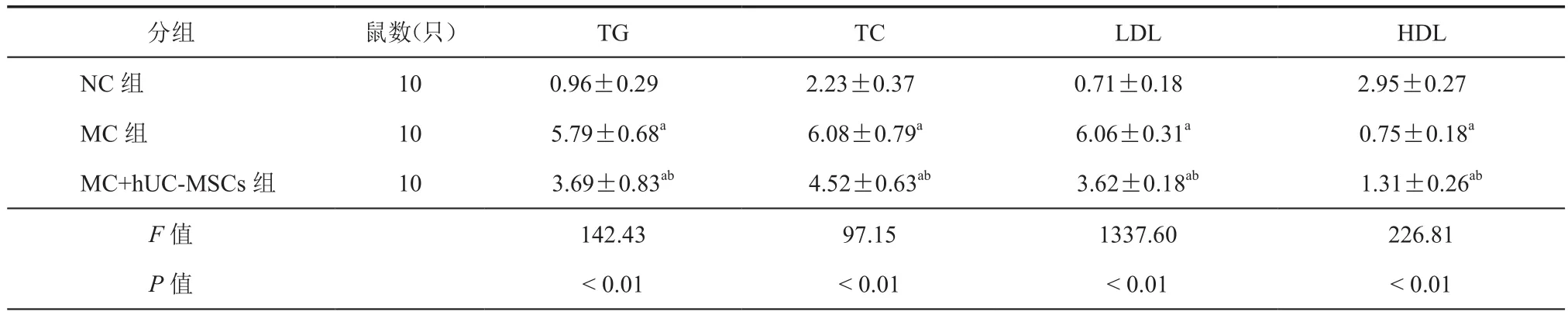
表2 各组大鼠治疗8周TG、TC、LDL、HDL比较(mmol/L± s)
注:与 NC 组比较,aP< 0.01;与 MC 组比较,bP< 0.01
分组 鼠数(只) TG TC LDL HDL NC 组 10 0.96±0.29 2.23±0.37 0.71±0.18 2.95±0.27 MC 组 10 5.79±0.68a 6.08±0.79a 6.06±0.31a 0.75±0.18a MC+hUC-MSCs组 10 3.69±0.83ab 4.52±0.63ab 3.62±0.18ab 1.31±0.26ab F值 142.43 97.15 1337.60 226.81 P 值 < 0.01 < 0.01 < 0.01 < 0.01
六、比较各组大鼠治疗8周后透射电镜肝脏组织病理变化
NC组肝细胞核大而圆,内质网排列整齐,线粒体结构清晰;MC组肝细胞浆内充满脂肪滴,内质网水肿,线粒体结构不同程度破坏如嵴断裂;MC+hUC-MSCs组肝细胞浆脂肪滴减少,内质网水肿减轻,线粒体结构较清楚(图2)。
七、比较各组大鼠治疗8周后Western Blot法检测肝脏组织 TLR4、NF-κB、IL-6、TNF-α、8-OHdG和SOD蛋白表达
与 NC 组比较,MC 组肝组织 TNF-α、IL-6、8-OHdG 、TLR4 和 NF-κB 蛋 白 表 达 均增高(P<0.05),SOD 降 低(P< 0.05); 与 MC 组 比 较,MC+hUC-MSCs组 肝 组 织 TNF-α、IL-6、8-OHdG、TLR4 和 NF-κB 蛋白表达均降低(P< 0.05),SOD增高(P< 0.05)(图 3,图 4)。
表3 各组大鼠治疗8周ALT 、AST和HOMA-IR比较(± s)
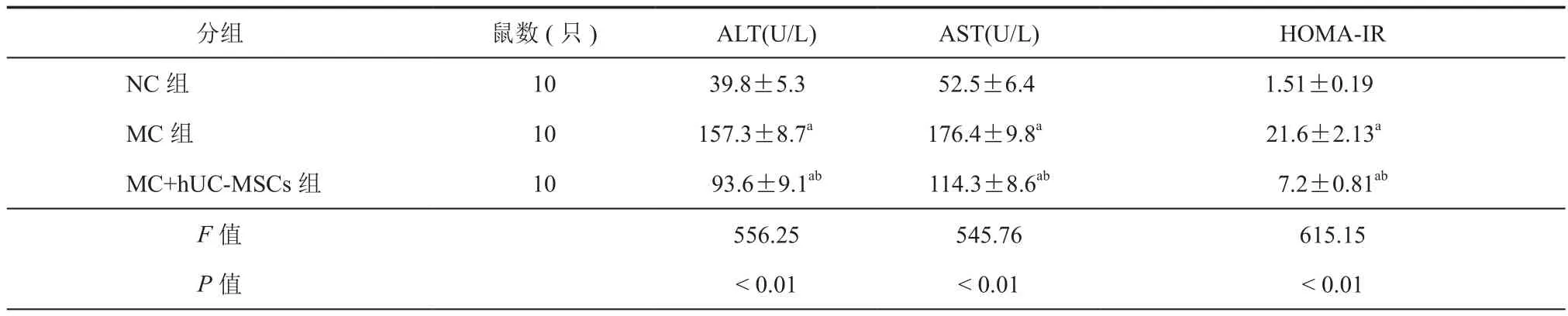
表3 各组大鼠治疗8周ALT 、AST和HOMA-IR比较(± s)
注:与NC 组比较,aP< 0.01;与 MC组比较,bP< 0.01
分组 鼠数(只) ALT(U/L) AST(U/L) HOMA-IR NC 组 10 39.8±5.3 52.5±6.4 1.51±0.19 MC 组 10 157.3±8.7a 176.4±9.8a 21.6±2.13a MC+hUC-MSCs组 10 93.6±9.1ab 114.3±8.6ab 7.2±0.81ab F值 556.25 545.76 615.15 P值 < 0.01 < 0.01 < 0.01

图1 光镜下观察各组大鼠治疗8周肝脏组织病理改变(HE染色,×200)
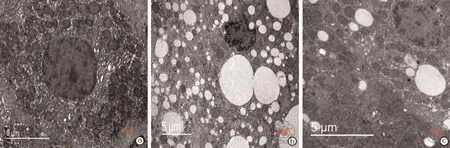
图2 透射电镜下观察各组大鼠治疗8周肝脏组织病理改变(×7 000)

图3 各组大鼠治疗8周Western Blot法检测肝脏组织TLR4、NF-κB、IL-6、TNF-α、8-OHdG 和 SOD 蛋白表达水平
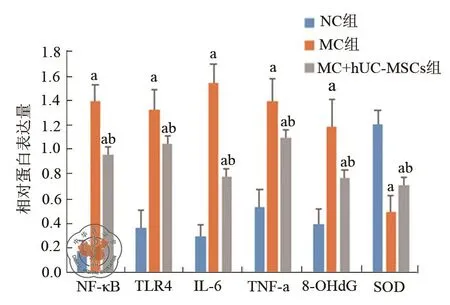
图4 各组大鼠干预8周Western Blot法检测肝脏组织TLR4、NF-κB、IL-6、TNF-α、8-OHdG 和 SOD 相对蛋白水平比较
讨 论
NAFLD指排除酒精和其他明确的肝损害原因、由遗传-环境-代谢应激等所致的脂质在肝细胞沉积为主要病理特征,早期呈现单纯性脂肪性肝病,但目前临床缺乏有效的治疗手段,可进一步进展至脂肪性肝炎、脂肪性肝纤维化、肝硬化甚至肝恶性肿瘤[5]。目前NAFLD的发病机制公认为经典的“两次胰岛素抵抗打击”学说[6],即胰岛素抵抗首次打击可导致肝细胞脂质沉积,过量沉积的脂质可进一步引发胰岛素抵抗,这二次胰岛素抵抗将促使肝脏脂质过氧化[7],可激活细胞膜上Toll样受体-4(tolllike receptor 4,TLR4),刺激核转录因子 -κB(nuclear factor-kappa B,NF-κB),激活 NF-κB 使肝细胞线粒体膜损伤,导致呼吸链功能受损,线粒体结构破坏和功能障碍,最终引发肝细胞发生炎性坏死和肝纤维化[8-9]。胰岛素抵抗、炎症反应和氧化应激形成恶性循环、共同促进NAFLD的病程进展[10-11]。本实验采用高糖高脂饲料喂食SD大鼠诱导NAFLD模型,模型组大鼠胰岛素抵抗指数和肝功转氨酶增高,光镜和电镜下观察到大鼠肝组织呈不同程度脂肪变性和炎性病理改变,Western Blot法检测其肝脏组织TNF-α、IL-6、8-OHdG、TLR4 和 NF-κB 蛋白表达增高,SOD蛋白表达均降低,证实了NAFLD与胰岛素抵抗、炎症反应和氧化应激失衡相关。
药物如胰岛素增敏剂和抗氧化剂等对NAFLD的治疗效果尚不确切[12-13]。NAFLD常伴发肥胖、糖尿病、高尿酸血症等代谢性疾病[14-15]。近年研究提示干细胞具有抗炎症及抗氧化应激的作用,并已成为治疗代谢性疾病及其并发症的研究热点。因此,探讨hUC-MSCs对NAFLD肝脏受损的作用及其机制具有临床应用价值。hUC-MSCs已被证实可直接定向归巢至受损的肝脏组织,通过分泌血管内皮生长因子和肝细胞生长因子等促进肝细胞再生、减少c-Jun氨基末端激酶和p38促分裂原活化蛋白激酶的活化,抑制肝细胞变性及凋亡,改善肝脏功能[16]。hUC-MSCs还可调控免疫炎症稳态,有研究报道其可促进肝脏血红素加氧酶的表达以降低炎症介质如白细胞介质-6和单核细胞趋化因子-1表达,减轻机体系统性和肝脏组织局部炎症反应,从而修复肝功能损伤的作用[17]。此外,干细胞亦可具有旁分泌效应分泌各种体液因子以促进肝细胞再生和功能改善[18]。在本实验中采用hUC-MSCs对NAFLD模型大鼠进行治疗,治疗组较模型组大鼠肝功谷丙转氨酶和谷草转氨酶降低、胰岛素抵抗指数降低,光镜和电镜下观察显示肝组织病理改变改善,尤其是电镜下可见肝细胞浆内脂肪滴、细胞核挤压、线粒体结构模糊及内质网水肿等病变好转,肝组织 TNF-α、IL-6、8-OHdG、TLR4 和 NF-κB 蛋白表达均降低、SOD增高。
综上所述,本研究结果显示hUC-MSCs可能通过抑制TLR4/NF-κB炎症通路及氧化应激机制对NAFLD大鼠受损肝脏功能具有改善作用。

