室内装修挥发性污染物对雄性小鼠生殖功能和精子凋亡的影响
朱 博,满枋霖,刘 鹏,佟海滨,田 丹, 孙 新
(1.北华大学生命科学研究中心,吉林 吉林 132013;2.北华大学附属医院生殖医学中心,吉林 吉林 132011)
近三十年来我国男性的生育能力呈逐年下降趋势,男性生育能力下降及男性不育发病率增加的原因,除了遗传因素、性腺感染、获得性睾丸损伤及免疫性因素等明确原因外,约70%的男性不育病因未明确,有研究者[1-2]认为导致男性精液质量下降的主要原因是近年来工业化带来的不良影响。近年来室内装修引起的室内空气污染问题越来越多地引起了人们的普遍关注,甲醛是一种常见的室内空气污染物,室内装修用的胶合板等人造板材、绝缘保温材料以及为了提高粘合度不可避免地释放一些甲醛[3-4]。在室内环境中苯和苯系物是各种油漆和溶剂型涂料(如聚氨脂树脂等)的添加剂、稀释剂[5]。一些防水材料及家具中多使用氨水作为添加剂和增白剂;氨类物质也存在于混凝土中,随着温度、湿度等环境因素变化而还原成氨气从混凝土中慢慢释放出来,导致室内空气中氨浓度不断增高,形成氨气污染[6]。研究[7]显示:暴露于甲醛环境中雄性小鼠的睾丸间质细胞中睾丸激素(StAR、P450scc和3β-HSD)的表达受到抑制,从而抑制了小鼠的性功能和精子发生。Naghdi等[8]研究发现:甲醛对雄鼠附睾尾部精子造成严重损伤,包括明显增加非运动精子的百分比以及降低性成熟系数。
目前的研究主要集中在甲醛等单一挥发性污染物对雄鼠生殖系统及生殖功能的影响方面,然而在新装修室内甲醛伴随着其他挥发性污染物共同存在,因此本研究采用甲醛、二甲苯和氨复合气体(formaldehyde,xylene and ammonia,FXA)模拟室内装修主要挥发性污染物环境,探讨其与雄鼠不育的关系。本研究通过雄性小鼠静式染毒动物实验,初步阐明装修污染与雄性小鼠精子质量的关系,尤其是与雄鼠少精症和弱精症的关系,在此基础上分析其可能的机制。本研究旨在为探索构建有益于人类健康的生活空间提供有利的依据,并为装修污染物导致男性不育的治疗药物的开发提供新的靶点。
1 材料与方法
1.1实验动物、主要试剂和仪器健康清洁级ICR雄性小鼠20只,购于吉林省长春市亿斯实验动物技术有限公司,动物生产许可证号:SCXK(吉)-2011-0004,7周龄,体质量(20±2)g。饲养于北华大学生命科学中心动物房,环境温度为(23±3)℃,相对湿度为35%~55%,每天12 h日光与12 h黑暗交替,清洁卫生按本实验室相关标准操作规程要求进行。Caspase-9抗体、Cleaved-Caspase-3抗体和β-Actin抗体购于美国Abcam公司,Goat anti-Mouse IgG(HRP)第二抗体和Goat anti-Rabbit IgG(HRP)第二抗体购于美国ProteinTech公司。CX31生物显微镜和CX21FS1光学显微镜(日本Olympus公司),WLJY-9000精子质量分析仪(北京伟力公司),FACS Aria流式细胞仪(美国BD公司)。
1.2实验分组将20只ICR雄性小鼠随机分为实验组(染毒组)和对照组(未染毒组),每组10只,采用3%~5%苦味酸(黄色)在小鼠背部皮毛上染色标记,将每只小鼠标号。于2个鼠笼分别饲养,实验期间小鼠自由饮食。
1.3染毒方法装修后室内挥发性有机污染物甲醛、二甲苯和氨复合气体浓度分别波动于0.1~4.0 mg·m-3、0.05~5.00 mg·m-3和≤0.4 mg·m-3[9]。由于考虑到种系差异系数和接触作用时间及空间的差异,将参考文献[9]结果中浓度最大值的100倍设为实验组染毒浓度。甲醛、二甲苯和氨复合气体浓度分别为60、50和40 mg·m-3。根据染毒浓度、受试物比重及染毒柜的容积采用下列公式计算出加入液态受试物的量。M= n×L/100×ρ。公式中:n表示实验设计受试物量(mg·L-1),L表示染毒柜容积(L),ρ表示受试物密度,M表示应加入受试物的量(mL)。将得到的浓度换算整理后,甲醛、二甲苯和氨复合气体的使用量分别为28、29和22 μL·m-3。自制硬质塑料透明染毒柜(正在申报专利),容积为50 L,适用于10只小鼠2 h呼吸量。将实验组小鼠逐一放入染毒柜中,分别取甲醛、二甲苯和氨于烧杯中,将烧杯置于染毒柜进行受试物的混配吸入染毒,每天密闭静式染毒2 h,小鼠染毒期间禁食水,其余时间自由饮食;同时对照组小鼠每天放于充满空气的受试物染毒柜中,每天密闭2 h,期间禁食水,其余时间自由饮食。35 d后处死,进行各项指标检测。
1.4小鼠行为学观察染毒期间,每天观察并记录小鼠的外观特征、毛发光亮程度、食水量、行为、大小便及中毒情况。观察小鼠是否有笼顶爬行、悬挂、后翻和高跳等异常行为。
1.5小鼠体质量观察染毒期间每天固定时间(16:00)称小鼠体质量,记录其体质量增长情况,以染毒第1天的体质量增长率为0.00%,分别计算对照组和实验组每7 d的体质量增长率。第n个7 d体质量增长率=[第n个7 d的体质量-第(n-1)个7 d的体质量]/[第(n-1)个7 d的体质量]×100%。实验组和对照组雄性小鼠每7 d的平均体质量增长率可说明2组小鼠体质量差异及染毒期间雄性小鼠体质量变化情况。
1.6小鼠精子浓度、活力和畸形率测定染毒35 d后,小鼠颈椎脱臼处死,固定于鼠板,75%乙醇消毒小鼠下腹部,剖开腹腔,取出睾丸及附睾,剔除周边筋膜组织,生理盐水漂洗,滤纸吸干,准确称量附睾质量,置于1 mL、37℃预热的PBS中,用眼科剪将附睾剪碎,放置于37℃恒温箱静置15 min,待精子游离出来,300目尼龙网过滤入1.5 mL EP管中。然后取10 μL精子悬液置于精子计数板,用精子质量分析仪进行分析,并记录精子密度和活力[10]。根据Cooper等[10]提供的小鼠精子畸形率判定标准计算精子畸形率。精子畸形率=(畸形精子数)/(计数精子总数)×100%。
1.7小鼠精子凋亡率测定实验组和对照组各取3只小鼠,按1.6分别制作精子悬液,然后用PBS(4℃预冷)调整精子浓度为2×106mL-1。取1 mL精子悬液,预冷PBS洗涤,离心(300 g,10 min),弃上清重复2次,加入1 mL Annexin Ⅴ Binding Buffer 重悬混匀,取出100 μL放入EP管中,加入FITC-Annexin Ⅴ 5 μL和PI 10 μL染色,室温下避光15 min后加入400 μL孵育缓冲液,1 h内采用流式细胞仪检测。结果以细胞凋亡率表示。细胞凋亡率=凋亡细胞数/总细胞数×100%。每组做3次平行试验并进行统计学分析。
1.8Western blotting法检测睾丸组织中Caspase-9和Cleaved Caspase-3蛋白水平按照上述步骤解剖小鼠,取出睾丸组织,提取小鼠睾丸组织总蛋白。在96孔板中依次加入不同浓度的蛋白标准品和蛋白样品10 μL,再加入200 μL BCA工作液,将酶标板放在振荡器上震荡30 s,37℃孵育15 min。用酶标仪测定562 nm处波长的吸光度(A)值,绘制标准曲线,根据标准曲线和使用的样品体积计算出样品的蛋白浓度。
Western blotting法参照Sun等[11]的实验方法。一抗:分别用Caspase-9抗体、Cleaved Caspase-3抗体和β-actin抗体。二抗:Goat anti-Rabbit IgG抗体。对电泳条带采用Image J软件进行灰度值扫描,与β-actin条带进行对比获得各自蛋白的相对表达水平,并对各目的蛋白进行半定量分析。

2 结 果
2.12组小鼠的行为学染毒开始,实验组小鼠受到FXA的刺激有明显的抓耳、搔鼻现象,并且有兴奋(跳跃、躁动不安)及多动行为;30 min后大多数小鼠表现为直立、持续跳动和狂躁等行为,个别小鼠出现神经刺激症状,但无死亡与中毒现象;1 h后小鼠基本处于抑制状态(群居和少动),出现皮毛蓬松和稀便等症状。对照组小鼠未受到受试物的刺激,小鼠表现为眺望、修饰、游走和探究等正常行为。
2.22组小鼠体质量增长率与对照组比较,实验组小鼠在染毒后的第1周(0~7 d)、第2周(8~14 d)、第3周(15~21 d)和第4周(22~28 d)小鼠体质量增长缓慢(P<0.05);在染毒的第5周(29~35 d)2组小鼠体质量增长率差异无统计学意义(P>0.05)。见表1。
2.32组小鼠精子浓度、活力和畸形率实验组小鼠精子浓度、活力及畸形率与对照组比较差异有统计学意义(P<0.05)。染毒35 d后,取对照组和实验组小鼠附睾精子,精子浓度分别为(28.03±2.03)×106mL-1和(20.23±1.96)×106mL-1,2组比较差异有统计学意义(P<0.05);精子活力分别为(62.70±4.00)%和(38.24±8.03)%,2组比较差异有统计学意义(P<0.01);精子畸形率分别为(31.21±6.61)%和(24.20±4.29)%,2组比较差异有统计学意义(P<0.05)。实验组小鼠精子中出现断头精子比率明显多于对照组。见图1。
表12组小鼠体质量增长率
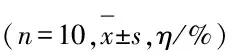

GroupIncreaserateofbodyweight1-7d8-14d15-21d22-28d29-35dControl20.04±4.9913.09±4.5612.26±3.0011.29±2.268.08±2.17Experimental9.09±2.97∗6.85±0.75∗7.63±1.78∗7.99±1.42∗6.54±1.40
*P<0.05 compared with control group.

A: Control group; B: Experimental group.
Fig.1Morphology of epididymal sperms of mice in two groups
2.42组小鼠附睾中精子凋亡率染毒35 d后实验组小鼠附睾精子凋亡率(53.95%±0.57%)明显高于对照组(1.03%±0.01%)(P<0.01)。见图2。

A: Control group; B: Experimental group.
Fig.2Apoptosis of epididymal sperms of mice in two groups
2.52组小鼠睾丸组织中Caspase-9和Cleaved Caspase-3蛋白表达水平实验组Caspase-9蛋白和Cleaved Caspase-3蛋白表达量与对照组比较差异无统计学意义(P>0.05),内参蛋白β-actin表达量基本相同。见图3。通过Image J软件进行灰度分析结果显示:实验组Caspase-9蛋白表达水平(45.73±1.47)与对照组(47.11±4.98)比较差异无统计学意义(P>0.05);而Cleaved Caspase-3蛋白表达条带很浅,几乎无表达(4.22±0.20vs4.18±1.33)。

Lane 1:Control group;Lane 2:Experimental group.
图32组小鼠睾丸组织中Caspase-9和Cleaved Caspase-3蛋白表达电泳图
Fig.3Electrophoregram of expressions of Caspase-9 and Cleaved Caspase-3 proteins in testis tissue of mice in two groups
3 讨 论
人类处于室内环境的时间可长达生命的87%[12],而老弱病残者、孕产妇和婴幼儿等敏感人群在室内的时间更长,因此室内环境的居住质量直接影响着人类的学习与工作,关系着人类的生存与健康。近年来,由于含有能够挥发出有害化学物质的建筑、人造板装饰及家具材料的大量使用使得室内环境的污染日益严重[13]。民居中常见且被大家熟知的室内挥发性有机物主要有甲醛、苯及苯系物和氨。企业在生产人造板材过程中使用以甲醛为主要成分的脲醛树脂胶黏剂,板材中残留的和未参与反应的甲醛会逐渐向周围环境释放,导致室内环境空气污染严重。甲醛释放期:一般板材(夹芯板)3~5 年;人造密度板(高密纤维板)则长达15 年[14];在室内环境中苯和苯系物是各种油漆和溶剂型涂料的添加剂、稀释剂[5];一些防水材料及家具中多使用氨水作为添加剂和增白剂,另外混凝土的防冻剂、高碱混凝土膨胀剂和早强剂中多使用氨水作为添加剂[6]。新房装修后,甲醛以很高的浓度共存于室内,可能对暴露人群发挥着联合毒性效应[14-15]。
本研究结果显示:染毒开始受到甲醛、二甲苯及氨刺激的实验组小鼠有明显的抓耳、搔鼻且有兴奋(跳跃、躁动不安)及多动行为。30 min后大多数小鼠表现为直立、持续跳动和狂躁等行为,但无死亡与中毒现象。1 h后基本处于抑制状态(群居和少动),出现皮毛蓬松、稀便等症状。对照组小鼠未受到受试物的刺激,小鼠表现为眺望、修饰、游走和探究等正常行为。此类不良反应可能是由受试物刺激小鼠呼吸道导致的呼吸道黏膜刺激症状和神经系统刺激症状所致。
目前关于室内挥发性污染物的生殖发育毒性的研究主要是研究单一毒物的作用,各种污染物的联合生殖与发育毒性研究相对较少,这与现实人群联合暴露的实际环境不相符合。因此本实验以3种主要室内装修污染物模拟装修污染内环境,实验结果显示:染毒28 d后室内装修污染物能够明显抑制雄性小鼠体质量增长,降低雄性小鼠附睾尾部精子数量和活力、增加雄性小鼠附睾尾部精子畸形率,同时导致雄性小鼠附睾尾部精子凋亡率增加。本研究结果显示:本实验所用的染毒剂量和暴露时间,未造成雄性小鼠睾丸组织中凋亡蛋白Caspase-9和Cleaved Caspase-3表达变化。邹学敏等[14]研究发现:苯与甲醛联合染毒可观察到睾丸组织结构出现曲细精管形态不规则,边缘极度不完整,各级精母细胞有不同程度的变性、缺失和管腔发育成熟的精子明显减少等病变。考虑本实验可能是由于染毒剂量小、染毒时间短,尚未引起睾丸组织中凋亡相关因子改变。另一方面,室内装修主要污染物损伤雄鼠附睾精子,但其睾丸组织未发生损伤时,若及时脱离污染环境是否会使雄鼠附睾精子质量得以恢复有待于进一步深入研究。
[参考文献]
[1] 李裕民,韩云贤,罗志彬.男性不育与生活环境[J].中外医学研究,2011,9(32): 152-156.
[2] 汪瑶瑶,曾向阳,孙建明.精子DNA损伤在男性不育症中的研究进展[J].现代泌尿外科杂志,2014,19(6):419-422.
[3] Bob M,Stephen E,David L,et al.Bob M,Stephen E,David L,et al.Committee on the medical effects of air pollutants(Comeap): handbook on air pollution and health[M].London:Department of Health,2010.
[4] Jurvelin J,Vartiainen M,Jantunen M,et al.Personal exposure levels and microenvironmental concentrations of formaldehyde and acetaldehyde in the Helsinki metropolitan area Finland[J].Air Waste Manag Assoc,2001,51(1):17-24.
[5] 张平.杭州市空气中苯系物的污染特征、来源及健康风险[D].杭州:浙江大学,2007:19-36.
[6] Koistinen K,Kotzias D,Kephalopoulos S,et al.The INDEX project:executive summary of a European Union project on indoor air pollutunts[J].Allergy,2008,63(7):810-819.
[7] Zang ZJ,Fang YQ,Ji SY,et al.Formaldehyde inhibits sexual behavior and expression of steroidogenic enzymes in the testes of mice[J].J Sex Med,2017, 14(11):1297-1306.
[8] Naghdi M,Maghbool M,Seifalah-Zade M,et al.Effects of common fig (Ficus carica) leaf extracts on sperm parameters and testis of mice intoxicated with formaldehyde[J].Evid Based Complement Alternat Med,2016,2016:2539127.
[9] 刘佳.室内空气污染物对雌鼠生殖性能的影响[D].沈阳:东北林业大学,2012.
[10]Cooper T,Castilla JA.WHO laboratory manual for the examination and processing of human semen[J].Int Congress Androl,2010,30 (2) :9.
[11]Sun X,Yasuda O,Takemura Y,et al.Akt activation prevents Apop-1-induced death of cells[J].Biochem Biophys Res Commun,2008,377(4):1097-1101.
[12]Klepeis NE,Nelson WC,Ott WR,et al.The national human activity pattern survey (NHAPS): a resource for assessing exposureto environmental pollutants[J].J Exp Anal Environ Epidemiol,2001,11(3): 231-252.
[13]Bulavka IUA.The development of a comprehensive assessment of occupational risk by taking into account the total hazard of working conditions[J].Gig Sanit,2013(4):47-54.
[14]邹学敏,张英彪,朱乐玫,等.苯与甲醛联合染毒对小鼠睾丸及精子的损伤作用[J].中华全科医学,2016,14(6):925-927,972.
[15]石春养,于萍.“甲醛-网净”治理室内空气污染的效果探讨[J].中国环境卫生,2005,8(3/4):21-26.

