五味子脂A联合卡铂对人卵巢癌Skov3细胞增殖、迁移和侵袭的抑制作用及其机制
上官梦原,赵 菁,杨艳荣,张佳悦,陈俊宇,赵淑华
(1.吉林大学第二医院妇产科,吉林 长春 130041; 2.延边大学附属医院妇产科,吉林 延吉 133000;3.吉林大学基础医学院病理生理学系,吉林 长春 130021)
卵巢癌是病死率最高的妇科恶性肿瘤,侵袭和转移是患者治疗失败的主要原因,有效控制肿瘤的侵袭和转移是治疗的关键。铂类是治疗卵巢癌的主要化疗药物,但具有选择性差、不良反应强和易产生耐药等缺点。近年来,从中药材中筛选有效成分逆转肿瘤多药耐药、增强肿瘤细胞化疗敏感性成为研究热点。研究[1-3]发现:五味子有效成分可发挥抗肿瘤作用。本研究选取五味子化学成分五味子脂A(gomisin A,GA)作为研究对象,观察其与卡铂(carboplatin,CBP)联合应用对卵巢癌Skov3细胞增殖、侵袭和转移能力的影响,并初步探讨其作用机制,为更加合理、有效的临床化疗联合用药方案提供实验依据。
1 材料与方法
1.1细胞和主要试剂人卵巢浆液性乳头状囊腺癌Skov3细胞株由吉林大学前列腺疾病防治中心保存。GA(纯度98%)购于上海源叶生物制品有限公司,注射用卡铂注射液为齐鲁制药有限公司生
产,IMDM 培养基和胎牛血清购自美国Gibco公司,RT-PCR试剂盒购于大连宝信生物工程有限公司,Transwell侵袭转移实验试剂盒购于美国Millipore公司。
1.2细胞培养和分组人卵巢癌Skov3细胞株用含10% FBS 的IMDM培养液,并置于37℃、5%CO2培养箱中培养,每隔3 d传代1次,传代比率 1∶3,取对数生长期状态良好的细胞进行实验。研究分2步:首先选择不同浓度GA和CBP(GA浓度分别为0、0.01、0.02、0.04、0.08和0.16 μmol·L-1,CBP浓度分别为0、4、8、16、32和64 mg·L-1)单独应用和分别组合后观察其对Skov3细胞增殖能力的影响,然后根据其结果选择联合用药的合适浓度,分为对照组、GA(0.04 μmol·L-1)组、CBP(16 mg·L-1)组、GA(0.04 μmol· L-1)联合CBP(16 mg·L-1)组(GA+CBP组)进行后续实验。
1.3MTT法检测细胞增殖能力取对数生长期细胞,消化细胞后制备单细胞悬液,细胞计数,调整细胞密度为3 000个/孔,接种于96孔板,每孔100 μL,于37℃、5%CO2培养箱中孵育24 h。分为对照组、GA组、CBP组和GA+CBP组,每组设6个复孔。加药后5%CO2、37℃条件下继续孵育。细胞给药48 h后,每孔加入MTT(5 g·L-1) 10 μL,37℃孵育4 h,小心吸去培养液,每孔加入DMSO溶液150 μL。振荡10 min,用酶标仪于490 nm波长处检测各孔吸光度(A)值。实验重复3次。细胞增殖抑制率=(1/实验组A值-1/对照组A值)×100%。
1.4平板克隆形成实验检测细胞形成克隆能力将Skov3细胞接种至6孔板,细胞密度为500个/孔,实验分为对照组、GA组、CBP组和GA+CBP组,48 h后吸去培养基,PBS洗涤3次,结晶紫染色。观察各组集落形成情况,在显微镜(低倍镜)下计数大于10个细胞的克隆数。按公式计算克隆形成率,并拍照记录。克隆形成率=(细胞克隆数/接种细胞数)×100%。
1.5细胞划痕实验检测细胞迁移能力将Skov3细胞接种于6孔板,细胞密度为3×105个/孔,待细胞生长至约80%融合,用200 μL移液枪头沿无菌格尺在每孔中央部纵向划痕,除去培养液,加入2 mL PBS仔细洗涤3次,37℃、5% CO2继续培养24 h后给药。实验分为对照组、GA组、CBP组和GA+CBP组,给药后观察细胞生长迁移情况,并拍照记录。
1.6Transwell实验检测细胞侵袭和转移能力无血清培养基饥饿细胞12~18 h后,消化细胞并用无血清IMDM重悬细胞,调整细胞浓度为2×104mL-1。Transwell试剂盒室温放置30 min预温,将小室置于24孔板中,加入300 μL无血清培养基至上室内部,室温下水化细胞外基质(ECM)30 min后,吸弃250 μL培养基。向每个上室加入无血清细胞悬液250 μL,向下室加入含10%胎牛血清的IMDM 500 μL。上室、下室分别加药至同等浓度,继续孵育30 h。取出小室移除残留培养液,PBS洗涤2次,瑞氏-姬姆萨染色后,倒置显微镜观察并拍照记录。
1.7Real-time PCR检测Skov3细胞中MMP-2和MMP-9 mRNA表达水平将Skov3细胞接种于6孔板,给药孵育48 h后,使用Trizol试剂盒提取各组细胞总RNA,紫外分光光度计测定RNA水平,逆转录成cDNA。PCR引物序列:MMP-2上游引物5′-TGATCTTGACCAGAATACCATCGA-3′,下游引物5′-GGCTTGCGAGGGAAGAAGTT-3′;MMP-9上游引物5′- CCTGGAGACCTGAGAACCAATC-3′,下游引物5′-CCACCCGAGTGTAACCATAGC-3′;GAPDH 上游引物5′-GGAAAGGCTGGGGCTCATTTG-3′,下游引物5′-AGAAGGGGCCATCCACAGTCTTC-3′。以cDNA为模板进行Real-time PCR检测,扩增条件:94℃、3 min;94℃、30 s,55℃、30 s,72℃、45 s,40个循环;72℃、5 min。以GAPDH为内参照,通过2-ΔΔCt计算各基因的mRNA表达水平。
1.8Western blotting法检测Skov3细胞中MMP-2、MMP-9、AKT1和pAKT1蛋白表达水平在100 mm培养皿中接种细胞,给药后继续孵育48 h。离心收集细胞,加入细胞裂解液,充分裂解细胞,离心收集上清,采用BCA 法测定蛋白含量。SDS-PAGE 电泳分离蛋白样本中不同相对分子质量蛋白,将蛋白转印到PVDF 膜上。5%脱脂奶粉封闭1 h,TBST洗3次,孵育一抗,抗体稀释比例分别为MMP2(1∶1 000)、MMP9(1∶1 000)、AKT1(1∶1 000)、pAKT1(1∶1 000)和β-actin(1∶500),4℃过夜。TBST洗3次后,加入过氧化物酶标记二抗,37℃孵育1 h,TBST洗3次。DAB显色,凝胶成像系统拍照。以各实验组与对照组灰度值之比表示蛋白相对表达水平。

2 结 果
2.1各组细胞增殖抑制率随着浓度的增加,GA和CBP对Skov3细胞增殖抑制率明显升高。单独应用GA(0.01、0.02、0.04、0.08和0.16 μmol·L-1)干预后,Skov3细胞增殖抑制率为9.4%~21.3%;单独应用CBP(4、8、16、32和64 mg·L-1)干预后,Skov3细胞增殖抑制率为14.6%~27.2%,而联合作用后细胞增殖抑制率最高为52.1%,高于同浓度GA组和CBP组(P<0.01),且GA和CBP浓度分别为0.04 μmol·L-1和16 mg·L-1时量效比最佳。见图1。

n=6,*P<0.01 compared with GA group;△P<0.01 compared with CBP group.
图1不同浓度GA和CBP组Skov3细胞增殖抑制率
Fig.1 Inhibitory rates of proliferation of Skov3 cells in GA and CBP groups with different concentrations
2.2各组细胞克隆形成率对照组、GA组、CBP组和GA+CBP组克隆形成率分别为60%、42%、31%和19%。与对照组比较,GA组Skov3细胞克隆形成率有所降低,但差异无统计学意义(P>0.05);CBP组和GA+CBP组克隆形成率明显降低 (P<0.05或P<0.01)。与GA组和CBP组比较,GA+CBP组细胞克隆形成率明显降低(P<0.01)。见图2。
2.3各组细胞的转移能力与对照组比较,GA和CBP组Skov3细胞转移的数量均减少,划痕的愈合面积减少;GA+CBP组Skov3细胞迁移的数量明显低于GA和CBP组,且细胞呈现明显受抑制状态。见图3。

A:Control group;B:GA group;C:CBP group;D:GA+CBP group.

A:Control group;B:GA group;C:CBP group;D:GA+CBP group.
2.4各组细胞的侵袭能力与对照组比较,GA和CBP组Skov3细胞穿过ECM的能力降低,穿过并黏附于QCM TM膜的细胞减少;GA+CBP组Skov3细胞穿过ECM的能力进一步降低,穿过并黏附于QCM TM膜的Skov3细胞进一步减少。见图4(插页五)。
2.5各组细胞中MMP-2和MMP-9 mRNA表达水平与对照组比较,GA和CBP组MMP-2和MMP-9 mRNA表达水平降低(P<0.05);与GA组和CBP组比较,GA+CBP组MMP-2和MMP-9 mRNA表达水平明显降低(P<0.01)。见表1。
表1各组Skov3细胞中MMP-2和MMP-9 mRNA表达水平

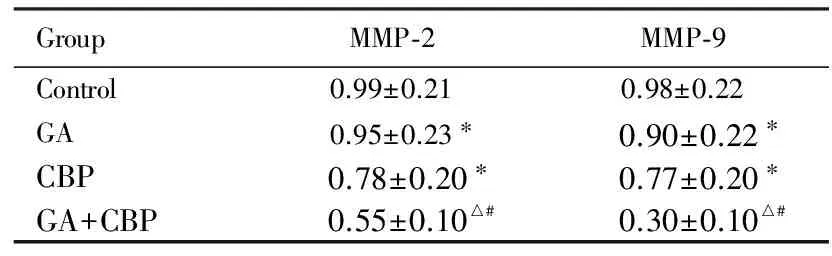
GroupMMP⁃2MMP⁃9Control0.99±0.210.98±0.22GA0.95±0.23∗0.90±0.22∗CBP0.78±0.20∗0.77±0.20∗GA+CBP0.55±0.10△#0.30±0.10△#
*P<0.05 compared with control group;△P<0.01 compared with GA group;#P<0.01 compared with CBP group.
2.6各组细胞中MMP-2和MMP-9蛋白表达水平与对照组比较,GA和CBP组细胞中MMP-2和MMP-9蛋白表达水平降低(P<0.05或P<0.01);与GA组和CBP组比较,GA+CBP组细胞中MMP-2和MMP-9蛋白表达水平明显降低(P<0.01)。见图5和表2。

Lane 1:Control group;Lane 2:GA group;Lane 3:CBP group;Lane 4:GA+CBP group.
图5Western blotting法检测各组Skov3细胞中MMP-2和MMP-9蛋白表达电泳图
Fig.5Electrophoregram of expressions of MMP-2 and MMP-9 proteins in Skov3 cells in various groups
表2各组Skov3细胞中MMP-2和MMP-9蛋白表达水平

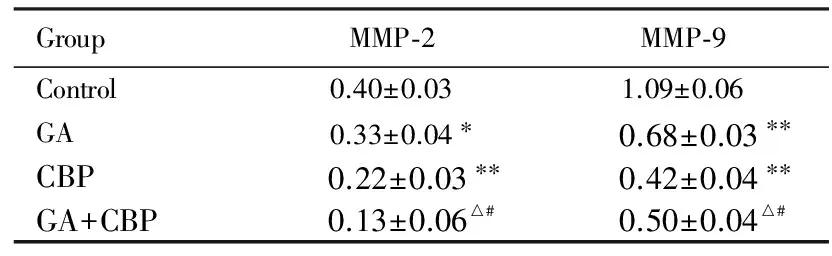
GroupMMP⁃2MMP⁃9Control0.40±0.031.09±0.06GA0.33±0.04∗0.68±0.03∗∗CBP0.22±0.03∗∗0.42±0.04∗∗GA+CBP0.13±0.06△#0.50±0.04△#
*P<0.05 compared with control group;△P<0.01 compared with GA group;#P<0.01 compared with CBP group.
2.7各组细胞中AKT1和pAKT1蛋白表达水平与对照组比较,GA和CBP组细胞中AKT1和pAKT1蛋白表达水平降低(P<0.05);与GA和CBP组比较,GA+CBP组细胞中AKT1和pAKT1蛋白表达水平明显降低(P<0.01)。见图6和表3。
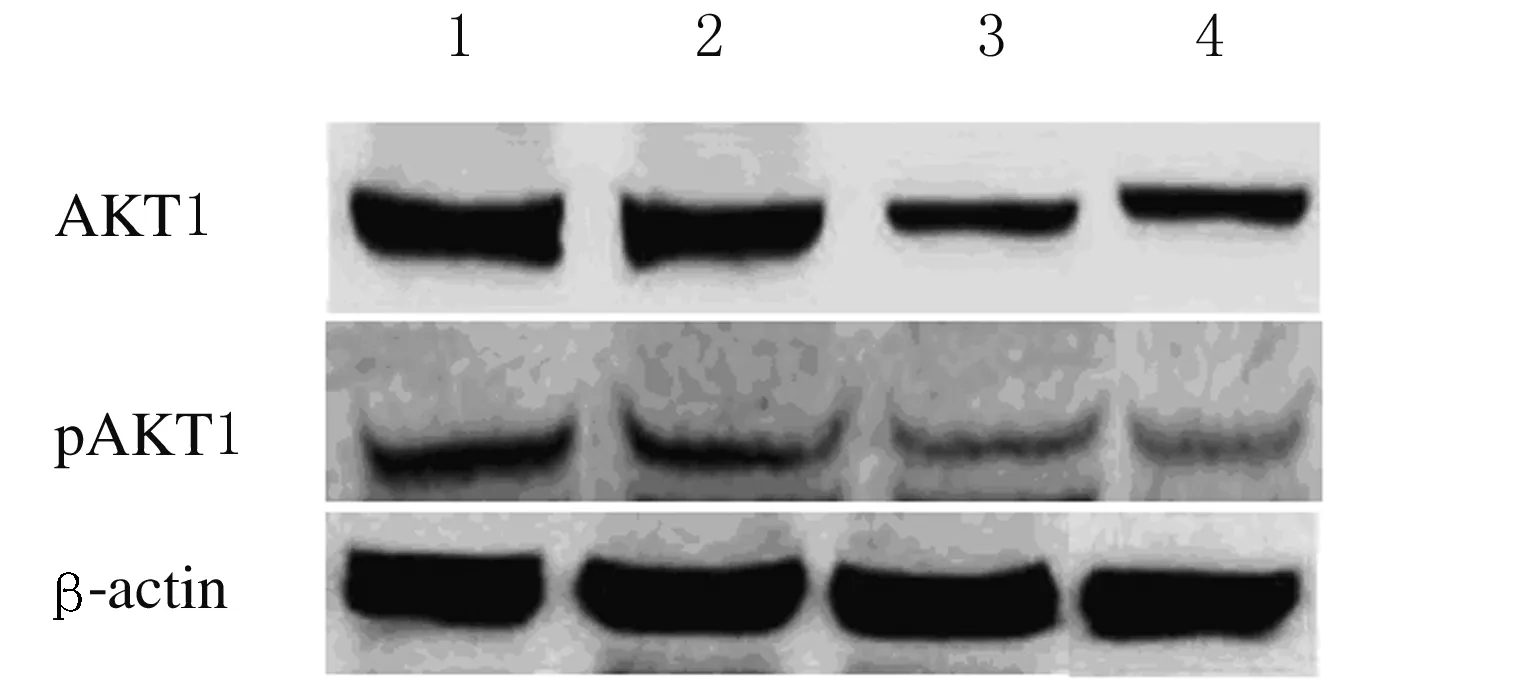
Lane 1:Control group;Lane 2:GA group;Lane 3:CBP group;Lane 4:GA+CBP group.
图6各组Skov3细胞中AKT1和pAKT1蛋白表达电泳图
Fig.6Electrophoregram of expressions of AKT1 and pAKT1 proteins in Skov3 cells in various groups
表3各组Skov3细胞中AKT1和pAKT蛋白表达水平


GroupAKT1pAKT1Control0.69±0.030.44±0.05GA0.60±0.03∗0.54±0.02∗CBP0.30±0.02∗0.27±0.02∗GA+CBP0.23±0.01△#0.14±0.02△#
*P<0.05 compared with control group;△P<0.01 compared with GA group;#P<0.01 compared with CBP group.
3 讨 论
化疗是卵巢癌辅助治疗的重要手段,虽然术后辅助化疗药物不断创新,但是对卵巢癌的治疗效果并不理想。CBP是目前广泛应用的化疗药物之一 ,但存在严重的不良反应并易产生耐药,因此急需开发毒性小、治疗效果好的新型抗肿瘤药物,以降低肿瘤患者死亡率。近年来,天然、高效、低毒和来源广泛的中草药受到国内外学者的青睐。五味子具有广泛的药理成分,其抗肿瘤活性已被许多研究[4-6]所证实。
肿瘤的发生发展与细胞的增殖能力有关。Kim等[7]研究发现:五味子脂可抑制乳腺癌细胞增殖,其机制可能是抑制细胞周期蛋白Cyclin D1、Cyclin E和细胞周期蛋白依赖性激酶CDK2、CDK4的表达。有研究[8]显示:随着五味子多糖浓度升高可明显抑制卵巢癌Skov3细胞增殖。本课题组前期实验[9]显示:单独使用GA和CBP均可抑制人卵巢癌Skov3细胞增殖,二者联合应用后抑制作用更为明显,进一步证实GA可增强CBP对人卵巢癌Skov3细胞增殖的抑制作用,即以低浓度CBP与微量GA联合用药可达到高浓度CBP所产生的抑瘤效果,从而降低CBP的用量、减少其不良反应。克隆形成率可反映细胞群体依赖性和增殖能力2个重要性状,多被用于抗癌药物的敏感性试验[10]。本研究通过平板克隆实验发现:GA+CBP组Skov3细胞增殖能力被明显抑制。PI3K-AKT信号通路是重要的细胞信号转导通路,通过激活多个下游效应分子,与多种肿瘤的发生发展密切相关。研究[11]显示:与正常肝组织比较,肝癌细胞中AKT和pAKT的表达水平明显升高,且随肿瘤组织的临床病理分期、分化程度不同而变化。在卵巢癌中,AKT过表达增加细胞的侵袭和转移能力[12];目前研究[13-15]表明:PI3K-AKT信号通路促进肿瘤发生的机制可能是某些因素导致了蛋白激酶B(AKT)的过度活化。通过应用PI3K-AKT抑制剂阻断PI3K-AKT途径,可提高卵巢癌细胞株对化疗药物的敏感性[16]。本研究采用Western blotting法检测药物处理后Skov3细胞中AKT1和p-AKT1蛋白水平,结果显示:GA+CBP组细胞中AKT1和p-AKT1蛋白表达水平明显降低,提示GA可增强CBP对PI3K-AKT途径的抑制作用,从而发挥协同抗肿瘤作用。
肿瘤细胞的迁移是肿瘤细胞生长和扩散的一种方式,黏附和侵袭过程增加了恶性肿瘤的增殖、转移能力。肿瘤细胞体内转移需穿过ECM,继而向组织浸润,因此ECM和基底膜的降解是肿瘤侵袭、发展和转移扩散过程的重要组成部分[17]。 本研究通过细胞划痕实验和Transwell实验发现:联合用药后细胞迁移能力明显减弱,提示联合用药后抑制细胞侵袭、转移的能力增强。肿瘤细胞降解ECM主要依赖蛋白水解酶,其中基质金属蛋白酶(MMPs)可降解胞外基质和基底膜,诱导肿瘤扩散和转移,其中最具代表性的是MMP-2和MMP-9。研究[18]发现:当MMP-2和MMP-9的表达或活性降低时,高转移性的细胞侵袭能力会明显减弱。已有研究[19-21]表明:在卵巢恶性肿瘤中,MMP-2和MMP-9的过表达与肿瘤浸润、转移扩散和预后不良密切相关。本研究结果显示:GA+CBP组细胞内MMP-2和MMP-9 mRNA及蛋白表达水平降低更加明显,支持联合用药增强细胞的抗侵袭和抗转移能力的结论。
综上所述,GA可通过抑制肿瘤细胞的增殖、侵袭和迁移等多个环节从而增强CBP的抑瘤作用,其机制可能为抑制MMP-2和MMP-9 mRNA及蛋白的表达,但其调控表达的分子机制还需进一步研究。
[参考文献]
[1] Waiwut P,Shin MS,Yokoyama S,et al.Gomisin A enhances tumor necrosis factor-α-induced G1 cell cycle arrest via signal transducer and activator of transcription 1-mediated phosphorylation of retinoblastoma protein[J].Biol Pharm Bull,2012,35(11): 1997-2003.
[2] 孙雨薇,闫冬梅.五味子多糖对体外培养肝癌SMMC-7721细胞Bcl-2和Bax蛋白表达的影响[J].中国处方药,2016,14(7):21-22.
[3] 陈海芳,戚进,余伯阳.生脉散中人参、麦冬和五味子提取物体外抗氧化作用[J].中国实验方剂学杂志,2016,22(19):37-42.
[4] Leong PK,Chiu PY,Chen N,et al.Schisandrin B elicits a glutathione antioxidant response and protects against apoptosis via the redox-sensitive ERK/Nrf2 pathway in AML12 hepatocytes[J].Free Radical Res,2011,45(4): 483-495.
[5] 安琳,苏慎勇,杨卫东,等.参芪五味子片口服降低胃癌化疗后胃肠道抑制及对患者免疫功能的影响[J].中药药理与临床,2017(2):226-229.
[6] Zhao T,Mao G,Mao R,et al.Antitumor and immunomodulatory activity of a water-soluble low molecular weight polysaccharide from Schisandra chinensis (Turcz.) Baill[J].Food Chem Toxicol,2013,55: 609-616.
[7] Kim SJ,Min HY, Lee EJ,et al.Growth inhibition and cell cycle arrest in the G0/G1 by schizandrin,a dibenzocyclooctadiene lignan isolated from Schisandra chinensis,on T47D human breast cancer cells[J].Phytother Res,2010,24(2):193-197.
[8] 赖一鸣,许娜,陈晓杰,等.五味子多糖抑制卵巢癌SKOV3细胞增殖的研究[J].中华中医药学刊,2014(4):856-857.
[9] 上官梦原.五味子脂A增强紫杉醇和卡铂对Skov3的抑瘤作用及机制研究[D].长春:吉林大学,2014.
[10]齐乃松,郭建,王雪,等.软琼脂克隆形成实验评价药物体外抑瘤性与成瘤性[J].药物分析杂志,2017,37(3):444-450.
[11]章尤权,王清泰,陈旭征,等.白花蛇舌草对人肝癌HepG2细胞裸鼠皮下移植瘤PI3K/Akt信号通路的影响[J].肿瘤基础与临床,2015,28(4):277-280.
[12]刘文涓,王前,李凤杰,等.p-Akt-mTOR-p70S6K信号通路蛋白与卵巢癌临床病理特征及化疗耐药的相关性[J].中南大学学报:医学版,2017,42(8):882-888.
[13]刘慧,李鑫,胡腾鹏,等.PI3K/AKT/mTOR信号通路抑制剂在淋巴瘤中的研究进展[J].中国肿瘤临床,2016,43(5):211-215.
[14]曾莉,唐小珂,周琦.PI3K/AKT信号通路及抑制剂的研究进展[J].现代妇女:医学前沿,2015(1):309.
[15]Markman B,Dienstmann R,Tabernero J.Targeting the PI3K/Akt/mTOR pathway-beyond rapalogs[J].Oncotarget,2010,1(7):530-543.
[16]张瑶.PI3K/AKT信号通路与人上皮性卵巢癌耐药性的相关性研究[D].南昌:南昌大学,2014.
[17]喻学桥.细胞外基质重构对肿瘤浸润转移的影响[J].肿瘤学杂志,2015,21(5):428-431.
[18]Huo X,Liu C,Bai X,et al.Aqueous extract of Cordyceps sinensis potentiates the antitumor effect of DDP and attenuates therapy-associated toxicity in non-small cell lung cancer via IκBα/NFκB and AKT/MMP2/MMP9 pathways[J].RSC Advances,2017,7(60):37743-37754.
[19]杨苏钰,唐德才,曹子丰,等.黄芪甲苷配伍姜黄素对人卵巢癌HO-8910原位移植瘤转移的抑瘤作用[J].中国实验方剂学杂志,2017,23(6):155-160.
[20]张展,朱海,宋华,等.Lgr5、β-catenin在卵巢上皮性癌组织中的表达及对SKOV3细胞增殖迁移的影响[J].郑州大学学报:医学版,2017,52(2):138-142.
[21]杨蓉,高婷婷,姚念玲,等.沉默IFITM1基因对卵巢癌CP70细胞增殖和侵袭能力的影响[J].西安交通大学学报:医学版,2016,37(4):544-546,577.

