Wnt5a对人肺腺癌A549细胞凋亡的调控作用及其机制
杨 易,包康达,周彦兵,袁 超,李 勇,刘晓明,徐金瑞
(宁夏大学生命科学学院 西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021)
肺癌是全球发病率和死亡率最高的一类癌症[1-3]。肺腺癌占非小细胞肺癌(NSCLC)的50%,其主要特征是无限增殖,因此抑制肺癌细胞增殖、诱导其凋亡是治疗肺癌的主要策略[4-5]。Wnt5a是一种旁分泌、自分泌型糖蛋白,Wnt5a配体与细胞跨膜受体结合,可将信号传递至细胞内,进而产生一系列反应。研究[6-8]显示:Wnt5a参与不同肿瘤细胞的发生发展。Wnt5a可介导不同受体参与调节不同Wnt信号转导通路,并最终导致不同的结果。目前尚未见有关Wnt5a信号调控人肺腺癌细胞作用的文献报道,因此本研究探讨Wnt5a对人肺腺癌细胞A549凋亡的作用并阐明其机制,旨在为深入研究靶向抑制药物和肺腺癌治疗提供理论依据。
1 材料与方法
1.1细胞来源小鼠Wnt 5a过表达细胞系(L Wnt-5a ATCC○RCRL-2814TM)和对照细胞系(L Cell ATCC○RCRL-2648TM)来源于ATCC细胞库,人肺腺癌A549细胞来源于中国科学院上海细胞库。
1.2主要试剂和仪器RPMI-1640培养基(Gibco 公司,美国),Annexin Ⅴ-FITC/PI双染试剂盒(BD 公司,美国),线粒体膜电位检测试剂盒(碧云天公司,中国),活性氧(ROS)检测试剂盒(Sigma 公司,美国),TUNEL原位末端凋亡检测试剂盒(Roch公司,德国),反转录试剂盒和qPCR检测试剂盒和羊抗兔IgG-HRP(全式金公司,中国)。Wnt5a、C-Capase3 和C-PARP1(CST公司,美国),Bcl-2、Bax、AIF、Mcl-1和CtyoC(Proteintech公司,美国),胎牛血清(Thermo公司,美国),青霉素和链霉素(Hyclone公司,美国)。CyFlow○RCube流式细胞仪(Partec公司,德国),iQ5荧光定量PCR仪和BioRAD凝胶成像系统(BioRAD公司,美国)。
1.3Wnt5a和C条件培养液制备和细胞培养参考文献[9] 的方法制备Wnt5a和C条件培养液(Wnt5a条件培养液富含Wnt5a蛋白,而C条件培养液中检测不到Wnt5a蛋白表达),-20℃保存备用,使用时按1∶1加入新鲜培养液用于细胞培养。A549细胞培养于含 10% 胎牛血清、100 U·mL-1青霉素和100 U·mL-1链霉素的RPMI 1640培养液中,置于37℃、饱和湿度、5% CO2培养箱中培养,每 2~3 d 传代1次。
1.4Wnt5a蛋白表达检测将收集的C和 Wnt5a条件培养液离心取上清,定量后煮沸,蛋白上样量为30 μg。经SDS-PAGE后,湿转至PVDF膜上,用含5%脱脂牛奶的TBS室温封闭2 h,TBST洗涤3次,4℃过夜孵育Wnt5a一抗,TBST洗涤3次,加羊抗兔IgG-HRP,继续室温孵育1.5 h后TBST洗涤3次,显影和定影,X 光片显色,检测Wnt5a蛋白表达情况。
1.5Wnt5a mRNA表达检测A549细胞以3×105mL-1接种于6孔板培养皿中,待细胞贴壁6~8 h,对照组和实验组分别加入C和Wnt5a培养液,培养24 h后,收集细胞,Trizol法提取总RNA,采用RT-PCR法检测Wnt5a mRNA表达。反应体系为20 μL,β-actin mRNA退火温度为58℃,F:5′-GGCACCCAGCACAATGAAG-3′,R:5′-GCCGATCCACACGGAGTACT-3′;Wnt5a mRNA退火温度为60℃,F: 5′-ACTGTGCCACTTGTATCAGG-3′,R: 5′-CTTCGATGTC-
GGAATTGATA-3′。
1.6A549细胞形态学检测以3×105mL-1细胞密度将A549细胞接种于6孔板培养皿中,待细胞贴壁6~8 h,分别加入Wnt5a(实验组)和C(对照组)条件培养液培养24 h后,采用TUNEL试剂盒检测细胞凋亡情况,在荧光显微镜下观察细胞形态并记录拍照。
1.7A549细胞凋亡率检测以3×105mL-1细胞密度将A549细胞接种于6孔板培养皿中,待细胞贴壁6~8 h,C培养液培养2 h作为对照组,处理组Wnt5a条件培养液培养2、4、12、24和48 h后,离心收集细胞,按说明书方法检测细胞凋亡率,独立重复3次实验。
1.8A549细胞中ROS水平检测以3×105mL-1细胞密度将A549细胞接种于6孔板培养皿中,待细胞贴壁6~8 h, C培养液培养2 h作为对照组,同时处理组Wnt5a条件培养液培养2、12、24和48 h后,离心收集细胞,吸弃培养液,用PBS缓冲液冲洗2次,按说明书方法采用流式细胞术检测ROS水平,独立重复3次实验。
1.9线粒体膜电位检测以3× 105mL-1细胞密度将A549细胞接种于6孔板培养皿中,待细胞贴壁6~8 h, C培养液培养2 h作为对照组,同时处理组Wnt5a条件培养液培养2、12、24和48 h,按说明书方法采用用流式细胞术检测线粒体膜电位。
1.10Western blotting法检测蛋白表达A549细胞以3×105mL-1细胞密度接种于6孔板培养皿中,待细胞贴壁6~8 h,依次加入C和Wnt5a条件培养液,培养 24 h 后,按照全蛋白提取试剂盒说明提取各组全蛋白,并参考BCA蛋白检测试剂盒说明进行定量。SDS-PAGE电泳后,湿转至PVDF膜,含5%脱脂奶粉TBS室温封闭2 h,加入特异性一抗于4℃过夜孵育,次日平衡至室温,TBST漂洗(酶标二抗) ,室温孵育1.5 h;TBST洗涤3次,用Western Enhance Bright ECL底物显色,BioRAD成像系统曝光。

2 结 果
2.1Wnt5a条件培养液中Wnt5a蛋白的表达Wnt5a处理组能检测到Wnt5a蛋白的表达,而对照组未检测到Wnt5a蛋白表达。见图1。

图1 2组条件培养基中Wnt5a蛋白表达
Fig.1Expressions of Wnt5a protein in conditioned mediums in two groups
2.2 2组A549细胞中Wnt5a mRNA表达实时荧光定量PCR结果显示:Wnt5a处理12 h组和24 h组Wnt5a mRNA表达水平高于对照组,其中24 h组高出对照组6倍(P<0.05),且Wnt5a的刺激呈现时间依赖性。见图2。
2.32组A549细胞形态学对照组未见TUNEL阳性细胞,经DAPI染色,核呈圆形或卵圆形,且大小均一。Wnt5a处理组能观察到一定数量的TUNEL染色细胞,但与DNAase阳性处理组比较,TUNEL染色细胞明显减少。见图3(插页三)。
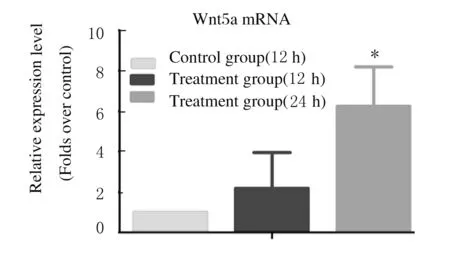
*P<0.05 compared with control group.
Fig.2Expression levels of Wnt5a mRNA in A549 cells in two groups
2.4 2组A549细胞凋亡率在双变量流式细胞术检测散点图中可见:细胞分落在4个象限:左下(LL)象限、右下(LR)象限、右上(UR)象限和左上(UL)象限,其中AV阳性细胞(右上和右下象限)为凋亡细胞,PI染色单阳细胞(左上象限)为坏死细胞。Wnt5a处理A549细胞后随时间的延长,细胞凋亡率呈现增加的趋势;与对照组比较,处理12、24和48 h时,Wnt5a处理组细胞凋亡率明显升高(P<0.01);处理2和4 h时与对照组比较差异无统计学意义(P>0.05)。见图4和表1。

A:Control group;B-F:Treatment group(2,4,12,24, and 48 h).


GroupApototicrate(η/%)ROSMitochondrialmembranepotentialControl3.70±1.3339.30±1.210.008±0.001Treatment(t/h)24.02±0.4940.72±2.890.013±0.00345.54±1.13-0.036±0.0016--0.078±0.0011212.00±1.111606.51±43.590.097±0.0022410.25±1.56380.77±31.860.117±0.0014812.03±0.431557.51±47.30-
“-”:No data.
2.5 2组A549细胞中ROS水平流式细胞术检测结果显示:Wnt5a组A549细胞中ROS水平高于对照组,但是Wnt5a处理不同时间产生的ROS水平不同。Wnt5a处理12 h时处理组A549细胞产生的ROS水平最高(Geo mean值=1 605.51),24 h时Wnt5a处理组ROS水平下降(Geo mean值=263.77),48 h时处理组ROS水平又回升但未超过12 h时(Geo mean值=1 557.51)。见图5和表1。
2.62组A549细胞线粒体膜电位与对照组比较,处理组 A549细胞线粒体膜电位明显降低(P<0.01) 。见图6和表1。

A:Control group;B-E:Treatment group(2,12,24,and 48 h).

A:Control group;B-F:Treatment group(2,4,6,12, and 24 h).
2.72组A549细胞中凋亡相关蛋白表达Western blotting法检测结果显示:Wnt5a处理组凋亡相关蛋白Bcl-2家族的促凋亡蛋白BAX表达量明显高于对照组,AIF蛋白表达量明显下调,而抗凋亡蛋白Bcl-2和Mcl-1 表达量与对照组比较无明显变化(P>0.05)。见图7。
3 讨 论
NSCLC占肺癌的85%,大多数NSCLC就诊时已处于ⅢB期或Ⅳ期,失去根治的机会,只能通过化疗方法缓解症状、延长生存。但化疗毒副作用大,寻找有效的分子靶向治疗是目前肿瘤专家和科研工作者共同关注的焦点。目前已有针对Wnt信号通路的抑制剂被用于抑制肿瘤细胞增长,Wu等[10]证实抑制剂XAV939可以抑制Wnt信号通路进而抑制结肠癌细胞的生长。Jia等[11]研究发现:DKK1表达水平直接反映了胃癌发展进程,miR-493介导的DKK1下调了胃癌细胞的增殖侵袭。Vuga等[12]研究发现:Wnt5a基因在普通间质性肺炎中高表达,在正常的肺成纤维细胞中Wnt5a能明显促进细胞增殖,并抑制由H202诱导的凋亡。Zhang等[13]研究发现:牛皮癣患者高表达Wnt5a 基因;在HaCaT和NHK细胞中采用Knockdown法降低Wnt5a表达后,抑制了细胞增殖且诱导细胞凋亡发生。Yao等[14]研究发现NSCLC患者Wnt5a高表达预示预后不良。

图7 2组A549细胞中凋亡相关蛋白表达
Fig.7Expressions of apoptosis-related proteins in A549 cells in two groups
本研究结果显示:与对照组比较,Wnt5a处理组早期凋亡小体明显增多,利用AV/PI双染流式术检测Wnt5a组凋亡率较对照组有增高趋势,随处理时间延长细胞凋亡率明显升高,Wnt5a组A549细胞中ROS水平高于对照组,差异有统计学意义,尤其是12和48 h时。Wnt5a处理组线粒体膜电位低于对照组,且随处理时间延长膜电位下降更明显。促凋亡蛋白Bax在Wnt5a处理组高表达,活化的Caspase3蛋白亦为高表达。
本实验结果表明:Wnt5a可导致人肺腺癌A549细胞线粒体膜破坏,JC-1不能聚集到线粒体内,而是以单体的形式游离在细胞质内,使R3 荧光强度增强,因此 JC-1 单体与多聚体的比值高于对照组,且随Wnt5a处理时间延长而表现为线粒体膜电位降低更明显。由此可见,Wnt5a是通过降低线粒体膜电位来诱导细胞的凋亡。Wnt5a通过降低抗凋亡蛋白的表达水平,提高促凋亡蛋白的含量使线粒体膜孔打开,活化的Caspase3蛋白表达上调,活化的PRAP1蛋白表达上调,积累放大使细胞色素C(CytoC)进入细胞,故检测到CytoC蛋白表达上调,从而引发细胞凋亡发生。
综上所述,Wnt5a可以成为肺腺癌的分子靶向基因之一,通过激活Wnt5a诱导癌细胞凋亡,从而达到治疗肺腺癌的作用。本实验结果为进一步研究治疗肺腺癌提供了理论依据。
[参考文献]
[1] Baykara O,Tansarikaya M,Bulut P,et al. CHD5 is a potential tumor suppressor in non small cell lung cancer (NSCLC)[J].Gene,2017,618: 65-68.
[2] Bu L,Li W,Ming Z,et al.Inhibition of TrxR2 suppressed NSCLC cell proliferation,metabolism and induced cell apoptosis through decreasing antioxidant activity[J].Life Sci,2017,178: 35-41.
[3] Cortinovis D,Gregorc V,Migliorino MR,et al.New perspectives in the second-line treatment of non squamous NSCLC patients: Results from a large Italian Lung Cancer Working Group[J].Crit Rev Oncol Hematol,2017,109:35-41.
[4] Li F,Zhang S,Zhang Q,et al.CYP1B1 G199T polymorphism affects prognosis of NSCLC patients with the potential to be an indicator and target for precise drug intervention[J].Biomed Res Int,2017,2017: 1529564.
[5] Alongi F,Arcangeli S,Ramella S,et al.From chemotherapy to target therapies associated with radiation in the treatment of NSCLC: a durable marriage[J].Expert Rev Anticancer Ther,2017,17(2): 157-165.
[6] Zhou Y,Kipps TJ,Zhang S.Wnt5a signaling in normal and cancer stem cells[J].Stem Cells Int,2017,2017: 5295286.
[7] Zhao L,Liu Y,Tong D,et al.MeCP2 promotes gastric cancer progression through regulating FOXF1/Wnt5a/β-catenin and MYOD1/caspase-3 signaling pathways[J].EBio Medicine,2017,16:87-100.
[8] Prasad CP,Södergren K,Andersson T.Reduced production and uptake of lactate are essential for the ability of WNT5A signaling to inhibit breast cancer cell migration and invasion[J].Oncotarget,2017, 8(42): 71471-71488.
[9] Maiti G,Naskar D,Sen M.The Wingless homolog Wnt5a stimulates phagocytosis but not bacterial killing[J].Proc Natl Acad Sci USA,2012,109(41): 16600-16605.
[10]Wu X,Luo F,Li J,et al.Tankyrase 1 inhibitior XAV939 increases chemosensitivity in colon cancer cell lines via inhibition of the Wnt signaling pathway[J].Int J Oncol,2016,48(4): 1333-1340.
[11]Jia X,Li N,Peng C,et al.miR-493 mediated DKK1 down-regulation confers proliferation,invasion and chemo-resistance in gastric cancer cells[J].Oncotarget,2016,7(6): 7044-7054.
[12]Vuga LJ,Ben-Yehudah A,Kovkarova-Naumovski E,et al.WNT5A is a regulator of fibroblast proliferation and resistance to apoptosis[J].Am J Respir Cell Mol Biol,2009,41(5):583-589.
[13]Zhang Y,Tu C,Zhang D,et al.Wnt/β-Catenin and Wnt5a/Ca pathways regulate proliferation and apoptosis of keratinocytes in psoriasis lesions[J]. Cell Physiol Biochem,2015,36(5): 1890-1902.
[14]Yao L,Sun B,Zhao X,et al.Overexpression of Wnt5a promotes angiogenesis in NSCLC[J].Biomed Res Int,2014,2014: 832562.

