P16和Ki-67在宫颈鳞状上皮内病变中的表达*
丁莉利,牛海艳,杨 丞,郑 晶
(海南医学院病理学教研室,海口 571199)
《WHO女性生殖器官肿瘤学分类(第4版)》对宫颈鳞状细胞癌前病变采用二级分类法,即分为低度鳞状上皮内病变(LISL)和高度鳞状上皮内病变(HISL)[1]。该分类法更能反映病变的生物学行为,且与临床治疗方案相关,因此临床要求在宫颈组织学活检诊断中应明确区分LSIL与HSIL。新分类的HSIL包括宫颈上皮内瘤变(CIN)2和CIN3病变,但以往根据形态诊断的CIN2可能部分为LSIL、部分为HSIL,笼统将CIN2都归入HSIL,可能导致HSIL的扩大化。研究提示P16和Ki-67是有助于区分宫颈鳞状上皮内病变的免疫标志物,但不同文献采用不同的判读标准[2-6]。本研究将探讨P16和Ki-67在宫颈鳞状上皮内病变中的表达水平和表达方式,分析它们在宫颈鳞状上皮内病变中的诊断意义。
1 资料与方法
1.1一般资料 收集海南医学院第一附属医院病理科2015年1月至2015年12月的宫颈组织石蜡包埋标本,选取诊断明确的LSIL、HSIL标本各 40例。所有宫颈组织均为宫颈活检和LEEP刀标本。
1.2方法 所有标本经4%中性缓冲甲醛液固定,常规脱水,石蜡包埋,4 mm厚切片,HE染色,光镜观察。免疫组织化学染色采用EnVision法,抗原修复采用高压高温煮沸法,所用单克隆抗体P16、Ki-67和显色试剂盒均购于福州迈新生物技术开发有限公司,操作步骤按说明书进行。
1.3结果判定 P16染色定位于细胞核和细胞质,Ki-67染色定位于细胞核。P16染色结果判读依阳性细胞在鳞状上皮分布的垂直平面行半定量报告:P16染色以超过上皮层下1/3以上弥漫且强的染色为1+,超过上皮层下2/3以上弥漫且强的染色为2+。Ki-67染色结果判读依阳性细胞数行半定量报告:阳性细胞数占11%~30%为1+,31%~50%为2+,>50%为3+。Ki-67阳性细胞数小于或等于10%或仅基底及基底旁细胞着色均判为阴性。所有病例均经2位高年资病理医生在多投显微镜下讨论,并确定诊断。
1.4统计学处理 采用SPSS17.0统计软件对数据进行处理。计数资料以频数或百分率表示,比较采用χ2检验,等级资料采用秩和检验,以P<0.05 为差异有统计学意义。
2 结 果
2.1P16在不同宫颈鳞状上皮内病变中的表达情况 P16在LISL组、HSIL组中阳性表达率分别为17.5%(7/40)、100%(40/40),两组之间差异有统计学意义(χ2=56.17,P<0.01),P16在HSIL组中的阳性表达率显著高于LSIL组,见表1。P16在LISL组中虽有7例染色阳性,但强染色均未超过上皮层下2/3。另有18例LISL病例P16出现斑驳或弱的染色,均判为阴性(图1)。P16在HSIL组中染色均超过上皮层下l/3,且34例呈超过上皮层2/3或全层表达,呈连续、弥漫强表达(图2)。
2.2Ki-67在不同宫颈鳞状上皮内病变中的表达情况 Ki-67在LISL组、HSIL组中总阳性表达率分别为87.5%(35/40)、100%(40/40),在两组之间差异无统计学意义(χ2=3.41,P>0.05),见表1。但Ki-67染色细胞数在两组之间有显著性差异(Z=7.60,P<0.01),Ki-67在HSIL组中染色阳性细胞数比LSIL组多。LISL组Ki-67阳性病例的染色细胞不仅数量上以1+为主,而且染色细胞主要位于上皮层的下1/3,中上层仅个别细胞表达(图3)。HSIL组病例的Ki-67染色细胞数量上以2+及以上为主,且上皮层1/3以上、甚至全层有大量染色细胞分布(图4)。
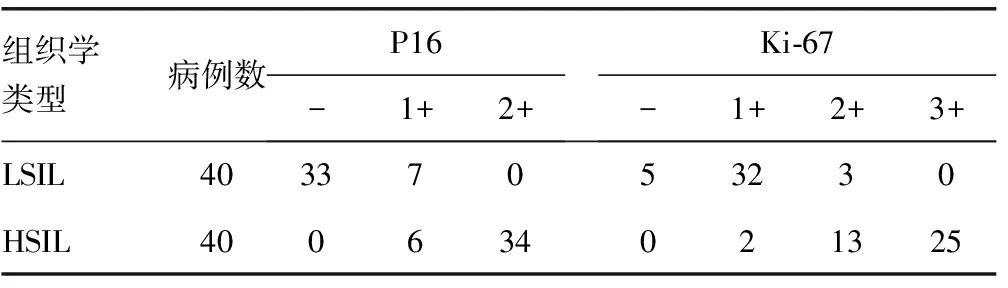
表1 P16和Ki-67在宫颈鳞状上皮内病变中的表达(n)
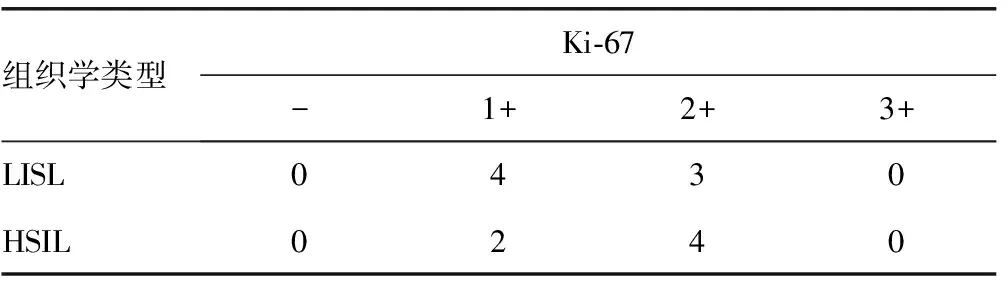
表2 Ki-67在 P16 1+表达的宫颈鳞状上皮内病变中的表达(n)
2.3Ki-67在 P16 1+表达的宫颈鳞状上皮内病变中的表达情况 P16在LSIL组、HSIL组分别有7例和6例为1+表达,占全部病例数的16.25%(13/80)。若P16 1+表达的病例以Ki-67 1+表达为标准判为LSIL,以Ki-67 2+及以上表达为标准判为HSIL,则分别有4例LSIL和4例HSIL的组织学类型与免疫表型相符合,仅5例P16 1+表达的病例免疫表型与组织学类型不符,占全部病例数的6.25%(5/80)。见表2。
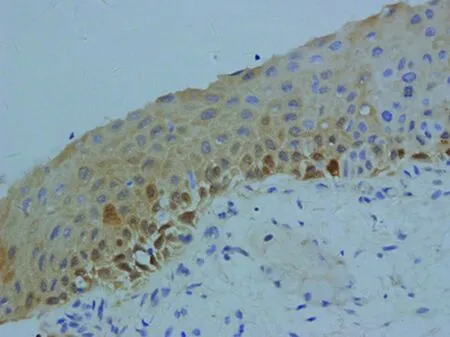
图1 LISL中P16呈弱的染色(×400)
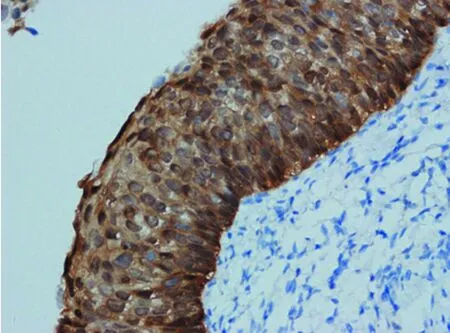
图2 HISL中P16呈弥漫、强染色(×400)

图3 LISL中Ki-67呈1+表达(×400)
3 讨 论
宫颈鳞癌的癌前病变与高危人类乳头瘤病毒(HPV)感染关系密切。患者在感染高危HPV后,HPV的DNA在机体内以2种形式存在,即游离形式和整合形式。HPV DNA在细胞内以游离状态存在时,组织学形态上表现为正常或LSIL,绝大部分感染者将通过自身免疫机制清除病毒。大量的回顾性研究显示,经活检证实的LSIL整体预后良好,大部分病例会在1年之内消失。若持续性高危型HPV感染,病毒的DNA可发生断裂,并与宿主细胞的基因整合,组织学形态上常表现为HSIL。如果不经过恰当的治疗,大约1/3的HSIL可以在30年间进展为癌。因而从临床目前规范的宫颈病变处理的流程来看,对于病理诊断为LSIL的患者仅需随诊观察,而HSIL患者则需要根据情况进行临床治疗[7]。因此宫颈组织学活检诊断区分LSIL与HSIL有重要的临床意义。CIN分为3级:CIN1、CIN2和CIN3。第4版WHO(2014)女性生殖系统肿瘤分类将CINl 病变归入LSIL,将CIN2和CIN3病变归入HSIL[1]。有文献报道,不同病理医师对于CIN2级病变的诊断一致性仅为43%[8]。因此不能简单地将活检诊断的CIN2都归入HSIL,需要对这样的病变进行进一步的区分。
当HPV DNA整合到宿主细胞基因组中,病毒DNA上的E6、E7癌基因表达蛋白能引起自身调节和宿主调节基因表达失调,从而影响正常细胞周期调控,导致宫颈上皮细胞发生恶变。其中E7蛋白能结合pRb蛋白,失活的pRb可以反馈性刺激抑癌基因P16表达,研究认为P16的强阳性表达即意味着HPV在细胞中的整合[9],这提示P16可作为HSIL诊断的标志物。本研究中P16在HSIL组中的表达阳性率明显高于LISL组,且在HSIL中呈连续、弥漫强阳性表达,并以超过上皮层下2/3或达全层的表达模式为主。而P16在LISL组中不但表达阳性率低,且阳性表达病例的染色也主要位于上皮层下2/3以内。因此在对宫颈鳞状上皮内病变进行诊断时,不仅应慎重判断P16 的阴阳性,应还对阳性病例仔细观察P16在上皮中的表达模式。
Ki-67是一种检测细胞增殖的标志物,在除G0期外所有细胞周期上都有表达,它在非肿瘤性宫颈鳞状上皮中限于基底层及副基底层。HPV感染会导致上皮细胞增殖,且以往的研究显示Ki-67染色的强度与宫颈鳞状上皮异型增生的级别呈正比[10]。虽在本研究中Ki-67在LSIL组和HSIL均有很高的阳性表达率,但在染色细胞数量和分布模式上有很大不同。Ki-67在LISL组病例中的染色细胞不仅数量上以1+为主,而且染色细胞主要位于上皮层的下1/3,中上层仅个别细胞表达,而在HSIL组中Ki-67染色细胞数量上以2+及以上为主,且上皮层1/3以上、甚至全层有大量染色细胞分布。因此在对宫颈鳞状上皮内病变进行诊断时,对Ki-67染色结果的判断应着重于判断Ki-67染色细胞数量和分布模式。
本研究也发现若单独行P16免疫组织化学检测,虽大部分LSIL和HSIL病变能得到明确区分,但部分LSIL和HSIL病变的P16在表达强度上存在重叠。文献报道在病理形态典型的 LSIL 中,大约有 1/3 病例显示累及基底层和副基底层的弥漫性 P16 免疫染色[11]。因此P16 阳性不能作为判读 HISL 的绝对指征,在宫颈鳞状上皮内病变中单独行P16免疫组织化学检测将会影响诊断的准确性。本研究发现Ki-67染色细胞的数量和分布模式在LSIL和HSIL中有明显不同。在HSIL组中Ki-67染色细胞的数量以2+及以上为主,且上皮层1/3以上、甚至全层有大量染色细胞分布。以Ki-67 2+及以上表达为标准将P16 1+表达的宫颈鳞状上皮内病变判为HSIL,可对这部分病例做进一步区分,降低诊断不明的病例数比率。因此P16和Ki-67免疫组织化学联合检测在宫颈鳞状上皮内病变中具有重要的诊断价值。
[1]KURMAN R J,CARCANGIU M L,HERRINGTON C S,et al.WHO classification of tumours of female reproductive organs(4th Eds)[M].Lyon:IARC,2014:172-176,183-184.
[2]张燕,王一,王建华,等.P16、Ki-67在440例宫颈病变中的表达及其病理诊断价值[J].诊断病理学杂志,2013,20(3):171-175.
[3]刘艳君,臧春逸.P16INK4a、Ki-67在宫颈上皮病变组织中的表达规律及其与HPV负荷量的相关性研究[J].北京医学,2011,33(11):904-907.
[4]杨其昌,刘宏斌,朱燕,等.ProEXC、P16和Ki-67在宫颈鳞状上皮内肿瘤形成诊断中的应用[J].中华病理学杂志,2012,41(6):405-407.
[5]MANIAR KP,SANCHEZ B,PAINTAL A,et al.Role of the biomarker P16 in downgrading 2 diagnoses and predicting higher-grade lesions[J].Am J SurgPathol,2015,39(12):1708-1718.
[6]刘彤,崔莉,许丽娟,等.P16、Ki-67蛋白表达及HPV检测在宫颈上皮内瘤变中的诊断意义[J].诊断病理学杂志,2009,16(5):343-345.
[7]中华人民共和国国家卫生和计划生育委员会.宫颈癌及癌前病变规范化诊疗指南(试行)[J].中国医学前沿杂志:电子版,2013,5(8):40-49.
[8]CASTLE P E,STOLER M H,SOLOMON D,et al.The relationship of community biopsy-diagnosed cervical intraepithelial neoplasia grade 2 to the quality control pathology-reviewed diagnoses:an ALTS report[J].Am J ClinPathol,2007,127(5):805-815.
[9]TRINGLER B,GUP C J,SINGH M,et al.Evaluation of p16INK4a and pRb expression in cervical squamous and glandular neoplasia[J].Hum Pathol,2004,35(6):689-696.
[10]WONG FW.Immunohistochemical detection of proliferating tumor cells in cervical cancer using monoclonal antibody ki-67[J].Gynecol Obstet Invest,1994,37(2):123-126.
[11]沈丹华.解读第4版WHO(2014)女性生殖系统肿瘤分类中宫颈癌前期病变的命名及分级变化[J].诊断病理学杂志,2015,22(3):129-132.

