DFT泛函在自由环合反应的选择性方面的可靠性研究
尹 龙,刘 鲲
1 简介
自由基由于具有高活性、高选择性和反应条件温和并且对反应物质的功能团没有影响等特点,受到化学研究者广泛的关注。它们有广泛的应用,特别是在有机合成领域中[1]。并且在近年来也逐步应用到一些天然产物的合成中。现今,自由基反应被认为是合成杂环化合物的有效手段。在各类杂原子自由基中,以氮为中心的自由基反应在有机合成领域有着越来越重要的作用[2-3]。它的优点在于能够在环化过程中引入氮原子,可以用于有机转化反应,由于其高反应活性和富电子性可以在碳碳不饱和键上加成从而直接形成C-N键,为含氮杂环化合物例如β-内酰胺类抗生素和环状胺的生成提供了方法和策略。这些含氮的分子不仅引起了学术界的广泛兴趣,而且在工业方面也占有突出的地位。在氧化作用中能够直接引入N-H酰胺与过渡态物质作用,使得这种合成方式更具有应用价值。
我们试图找到一种合适的DFT泛函去解决自由基环化反应问题。该课题选取了对计算精度比较敏感有代表性的伯氮自由基(见图1)为研究对象,通过控制R基的不同来控制反应的选择性,并以文献中的实验数据为参考,系统地评价DFT泛函的可靠性。
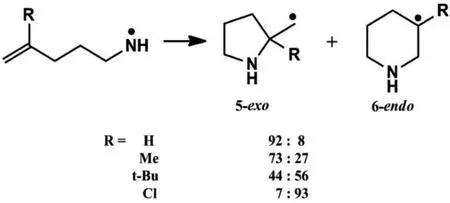
图1 伯氨氮自由基环化反应方程式
2 计算细节
本研究的氮自由基环化反应所涉及的各个反应物以及产物相应的过渡态的结构都是在6-31+g*分裂基组水平上,运用过渡态理论,运用一系列的DFT泛函来完成的。依据实验合成将温度定为80 ℃来计算某一产物的产率比值,并且和实验数据相比较。所有的几何结构优化都是应用Berny分析梯度法来完成的。一旦达到收敛,紧着就在该点上进行谐波频率分析来检验达到的结构是一个最小值(鞍点)还是一阶鞍点(驻点)。
为了确定合适的基组,我们选用计算上一步准确度较高的Cam-B3lyp,PBE0和BhandHlyp 3种泛函,研究DFT泛函在不同基组下的计算精度和振动分析的时间。为了研究在苯溶剂下对产率的影响,所有的几何结构都是在大量溶剂存在下同等机组水平上采用连续介质模型进行重优化的。并分别加以不同的关键字SMD和PCM来研究了溶剂化作用对计算结果的影响。所有的计算均采用G09完成[4-6]。
在前面的论文中,我们已经系统地报道了这些环化反应的细节。但是为了评估目前使用的密度泛函DFT对于描述环化反应的情况,我们计算了在温度80 ℃时产率5-exo产物和6-endo产物的产率。并与实验数据相比较。
通过假定氮自由基的反应是动力学控制的,其发生环化反应时的区域选择性可以用过渡态理论来处理。根据Eyring公式(公式2),产物的产率比值P[%]可以用活化自由能(ΔG≠) 计算得到公式1。
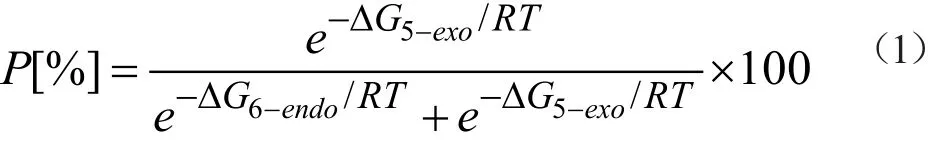
公式1中P[%]指的是5-exo产物的产率比值,R是理想气体常数(R=8.314 J·K-1·mol-1, T是反应温度(T=353.15 K)。

k代表反应的常数,公式2中所有涉及过渡态的物理量都用上角标“≠”标注,h是普朗克常量(h=6.626×10-34 J·s),к是传输系数。
3 结果讨论
在我们之前的研究中,该环化反应在B3LYP/6-31g*水平上在实验与理论上已经被研究过,之前获得的实验数据作为参考,氮含有孤对电子碳碳双键,是富电子的,从学术上来讲,该反应可认为是发生了碳碳双键上的亲电加成从而形成含氮的自由基,并且通过比较5-exo产物和6-endo产物的轨道能量和反应能垒,发现该自由基发生环合反应的时候是C=C的π轨道提供电子,流向氮自由基的单占的pN轨道,从而引发了C=C双键的断裂和C-N键的生成。这样,氮自由基上的电子密度越小越有利于反应的发生,C=C的π轨道上电子能量愈高,愈有利于这一过程进行。
在计算过程中稳定的中间结构,即船式构象和椅式构象,都在Cam-B3lyp/6-31+g*水平上优化,并比较各个结构下的反应活化能以及5-exo产物的产率比(见表1)。在整个的计算过程中,椅式构象作为过渡态的初始结构进行优化。
实验中计算了不同取代基取代的时候该自由基发生环化反应在353.15 K时,5-exo产物的产率比值(见表1)并与实验数据相比较,来评价各DFT泛函的可靠性。
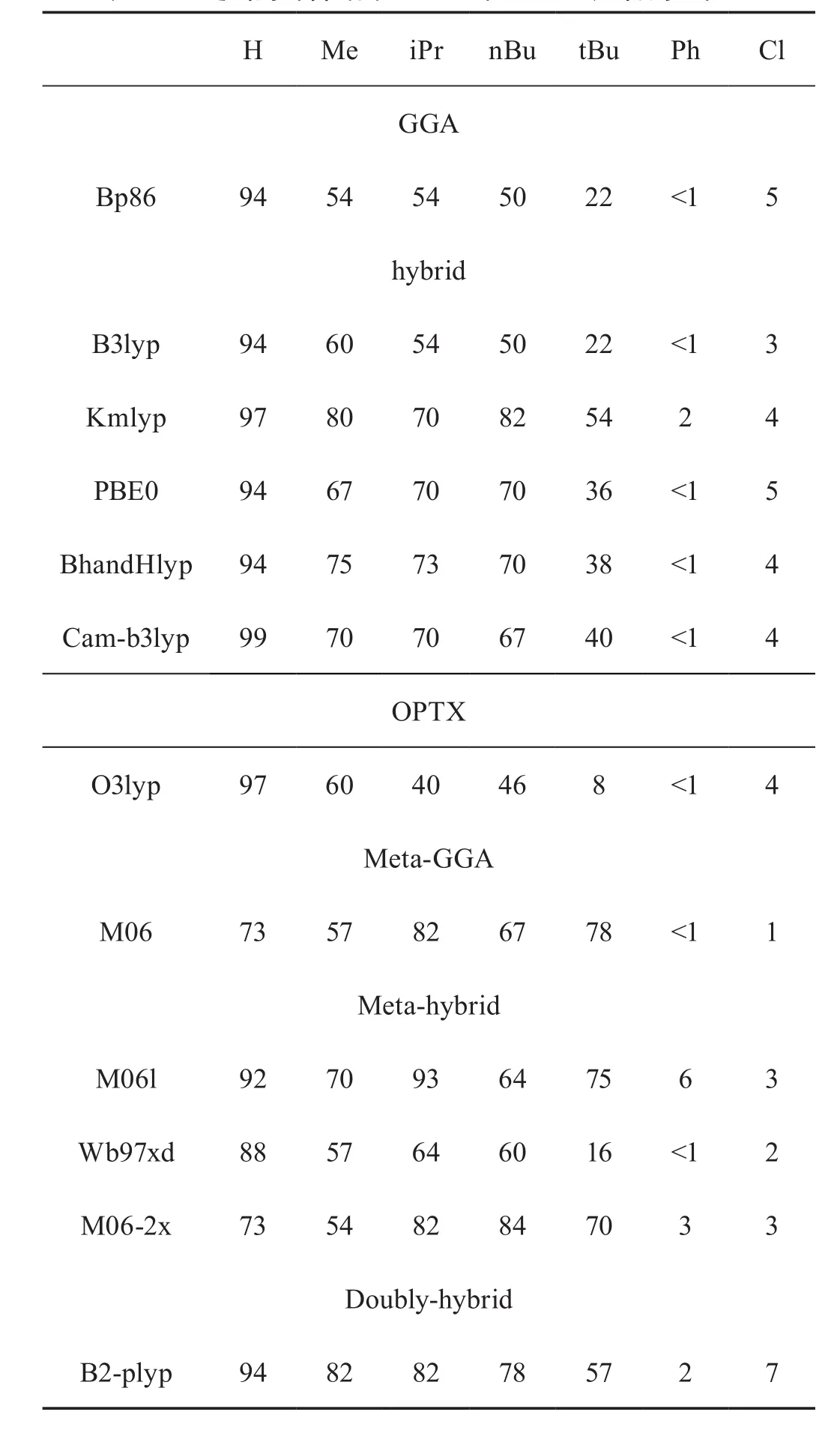
表1 DFT泛函的计算结果(5-exo和6-endo产物的比值)
从表1数据可以发现,当取代基R=Ph和Cl的时候,5-exo和6-endo的产物比值分别为<1和7,此时的反应具有较好的选择性。各DFT泛函的计算结果跟实验参考值几乎一样,即对于选择性较好的反应而言,各个系列的DFT泛函无论是pure还是杂化泛函等,对于该类反应都能给出合理的描述并且可以取得较好的定性结果,这与我们的预期是相一致的。因此可以说,如果对某类自由基反应的定量描述要求不十分严格,那么几乎所有的DFT泛函都是可以胜任的。
下面我们将重点讨论,对于定量描述要求较高,反应选择性差并且非常敏感的体系,如:当取代基R=H,Me,iPr,nBu和tBu时,这才是对DFT方法可靠性的真正挑战。
由表1数据可知,当R为上述取代基的时候,5-exo和6-endo产物的比值相差不大,即反应不具有较好的化学选择性,由前面提到的自由反应的特点和DFT泛函本身的缺点可知,这类反应是对DFT泛函计算准确度的最大考验,也是我们做这项研究的目的所在。计算结果表明,现阶段的DFT泛函是足以应对这个挑战的,GGA系列泛函中的BP86和Meta-GGA系列中的M06的计算结果总体相差不大,而metahybrid一类泛函相比较而言则是误差最大的一类,Hybrid一类泛函是最为准确的,尤其是cam-b3lyp,BhandHlyp 和PBE0泛函。
4 结语
(1)大多数的DFT泛函能够与实验数据保持一致,尤其是Cam-B3lyp,BhandHlyp和PBE0泛函。然而,计算化学中最为常用的B3lyp泛函与上述3种泛函相比,则计算精度较差。通过比较B3lyp和Cam-B3lyp两种泛函的数据可知,长程力矫正可以有效地提高计算准确度。
(2)极化和弥散波函数对于计算氮自由基环合反应是必须的,即2-ζ劈裂基组(6-31+g*)对于包含C,H,O,N的自由基体系是足够的。
(3)对于不包含离子的自由基体系,在计算过程中无需考虑溶剂化作用。
因此,对于具有区域选择性的自由基环合反应体系,我们强烈推荐Cam-B3lyp泛函6-31+g*基组。
[参考文献]
[1] MCCARROLL A J,WALTON J C.Programming organic molecules: design and management of organic syntheses through free-radical cascade processes[J].Cheminform,2001,40(12):2224-2228.
[2] BAR G,PARSONS A F.Stereoselective radical reactions[J].Tetrahedron Asymmetry,2003,32(5):251-263.
[3] LIU L Q,CHEN Y D,WU C Z,et al.8-endo versus 7-exo cyclization of alpha-carbamoyl radicals. a combination of experimental and theoretical studies[J].Journal of Organic Chemistry,2005,70(5):1539-1544.
[4] GIESE B.Radicals in organic synthesis: formation of carbon -carbon bonds[M].Oxford:Pergamon Press,1986.
[5] CURRAN D P,RAKIEWICZ D M.Radical-initiated polyolefinic cyclizations in linear triquinane synthesis. model studies and total synthesis of (±)-hirsutene[J].Tetrahedron,1985,41(19):3943-3958.
[6] GUINDON Y,PRÉVOST M,MOCHIRIAN P,et al.Synthesis of 2,3-anti-3,4-anti and 2,3-anti-3,4-syn propionate motifs: a diastereoselective tandem sequence of Mukaiyama and freeradical-based hydrogen[J].Cheminoform,2002,4(6):1019-1022.

