多发性骨髓瘤患者血清IL-6、IL-6R、MCL1的检测分析及与预后的关系
朱 婕,张 磊,张葆康,牛爱荣
(山东省青岛市中心医院检验科 266042)
多发性骨髓瘤(MM)是一种浆细胞恶性增殖的血液系统肿瘤,其临床表现主要为骨质破坏[1]。MM随人口老龄化其发病率递增,严重影响人类健康。白细胞介素-6(IL-6)是骨髓瘤细胞增殖的关键因子,可抑制细胞凋亡[2]。白细胞介素-6受体(IL-6R)存在于骨髓瘤细胞表面,可增加骨髓瘤细胞对IL-6R的敏感度[3]。髓样细胞白血病蛋白1(MCL1)是骨髓瘤细胞重要的生长因子,可调节信号转导,参与骨髓瘤细胞的增殖[4]。骨代谢标志物N-端骨钙素(N-MID)、Ⅰ型前胶原氨基端延长肽(PINP)、Ⅰ型胶原蛋白羧基端β降解产物(β-CTX)可用于评价MM患者骨损伤程度及预后[5]。本研究通过电化学发光免疫分析法(ECILA)检测MM患者血清中IL-6、IL-6R、MCL1、β-CTX、PINP、N-MID的表达水平,分析IL-6、IL-6R、MCL1水平与骨损伤的相关性,并探讨IL-6、IL-6R、MCL1与MM预后的关系。现报道如下。
1 资料与方法
1.1一般资料 选取本院2010年4月至2015年4月收治的120例MM患者纳入MM组。所有患者经骨X线片、骨髓象、血免疫球蛋白等临床指标检查确诊,均符合《血液病诊断及疗效标准》(第3版)中的诊断标准。依据Durie-Salmon分期法将MM组患者按临床分期分为3个亚组,即Ⅰ、Ⅱ、Ⅲ期组,Ⅰ期组年龄42~73岁,平均(53.73±4.51)岁;Ⅱ期组年龄40~74岁,平均(54.62±4.78)岁;Ⅲ期组年龄41~75岁,平均(52.89±3.65)岁。选择本院同期健康体检者为对照组,年龄43~72岁,平均(53.67±3.94)岁。各组均为40例。
1.2方法 各组均在空腹(禁食≥12 h)状态下采集肘前静脉血5 mL,注入真空采血管中,室温静置60 min,将低温离心机温度调至4 ℃,预冷后离心15 min,转速为3 000 r/min,分离上清液置于-80 ℃冰箱保存。待标本收集完毕后,利用ECLIA,通过全自动电化学发光免疫分析仪(型号:CobasE601;德国)同批次测定各组血清IL-6、IL-6R、MCL1,以及骨代谢标志物N-MID、PINP、β-CTX水平,分析血清IL-6、IL-6R、MCL1水平与MM临床分期的相关性。以上试剂均为仪器配套试剂盒,操作步骤严格依照说明书进行。

2 结 果
2.1各组血清IL-6、IL-6R、MCL1的表达水平 MM组患者血清IL-6、IL-6R、MCL1水平均明显高于对照组(P<0.05),其中Ⅲ期组明显高于Ⅱ期组(P<0.05),Ⅱ期组明显高于Ⅰ期组(P<0.05)。见表1。

表1 各组血清IL-6、IL-6R、MCL1的表达水平
注:与对照组相比,aP<0.05;与Ⅰ期组相比,bP<0.05;与Ⅱ期相比,cP<0.05
2.2各组血清N-MID、PINP、β-CTX的表达水平 MM组患者血清N-MID、PINP水平明显低于对照组(P<0.05),其中Ⅲ期组明显低于Ⅱ期组(P<0.05),Ⅱ期组明显低于Ⅰ期组(P<0.05)。MM组患者血清β-CTX明显高于对照组(P<0.05),其中Ⅲ期组明显高于Ⅱ期组(P<0.05),Ⅱ期组明显高于Ⅰ期组(P<0.05)。见表2。
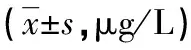
表2 各组血清N-MID、PINP、β-CTX的表达水平
注:与对照组相比,aP<0.05;与Ⅰ期组相比,bP<0.05;与Ⅱ期相比,cP<0.05
2.3MM组血清IL-6、IL-6R、MCL1水平与临床分期的相关性 经Spearman相关分析,MM患者血清IL-6水平与临床分期呈正相关(r=0.68,P<0.05);IL-6R水平与临床分期呈正相关(r=0.56,P<0.05);MCL1水平与临床分期呈正相关(r=0.72,P<0.05)。
3 讨 论
3.1MM与骨损伤 MM细胞的存活依赖于一定的骨髓微环境,二者相互作用可激活破骨细胞活化因子、成骨细胞抑制因子引起骨细胞代谢失衡[6],导致溶骨性骨质破坏,进而影响MM患者的生存质量及预后[7]。血清中骨代谢标志物如N-MID、PINP、β-CTX可用来评价骨质损伤及其预后[5]。本研究结果表明,MM组患者血清N-MID、PINP水平明显低于对照组(P<0.05),N-MID、PINP水平与MM临床分期有关,临床分期越晚,N-MID、PINP表达水平越低;MM组患者血清β-CTX水平明显高于对照组(P<0.05),且β-CTX水平也与MM临床分期有关,临床分期越晚,β-CTX表达水平越高。此结果与欧阳清等[5]的研究结果一致。
3.2IL-6、IL-6R与MM 成熟的IL-6由184个氨基酸组成,相对分子质量为26×103,其编码基因位于7号染色体。IL-6分子中4个半胱氨酸残基形成两对二硫键,这对IL-6的生物学活性极为重要。IL-6是一种具有多种生物学功能的细胞因子,参与调节如T淋巴细胞、B淋巴细胞、造血干细胞、破骨及成骨细胞等的增殖与分化。细胞表面的IL-6R以异二聚体形式存在,由相对分子质量为80×103的α链与130×103的β链组成。IL-6的生物活性由其受体IL-6R所介导,IL-6R的α链以低亲和力与IL-6特异性结合,而后IL-6Rα-IL-6复合物以高亲和力与IL-6Rβ结合,形成具有信号转导功能的IL-6-IL-6R复合物[8]。在MM疾病进程中,IL-6可由MM细胞、破骨细胞、成骨细胞、骨髓基质细胞等以自分泌或旁分泌形式产生,从而促进细胞增殖并阻碍细胞凋亡[2];IL-6可刺激骨髓瘤细胞异常分泌免疫球蛋白,引起机体免疫紊乱及免疫病理损伤;血清IL-6水平升高可使肿瘤负荷增大,并加重MM患者病情。IL-6可在MM细胞中持续产生,以抵抗化疗药物诱导细胞凋亡[9]。本研究结果表明,MM组患者血清IL-6、IL-6R水平均明显高于对照组(P<0.05),IL-6、IL-6R水平与MM临床分期有关,临床分期越晚,IL-6、IL-6R表达水平越高,此结果与崔为发等[10]的研究结果一致。
3.3MCL1与MM MCL1是一种抗凋亡蛋白,属于BCL-2家族成员,该蛋白由350个氨基酸组成,其编码基因位于染色体1q21。MCL1基因可在多种组织中正常表达,对维持细胞的分化、成熟等具有重要意义。MCL1主要通过抗凋亡、阻断自杀信号通路等途径在肿瘤方面发挥癌基因作用[11];MCL可在多种恶性肿瘤中高表达,与肿瘤的分化程度及预后有密切关系[12-13];下调MCL1水平则可促进肿瘤细胞的凋亡。本研究结果表明,MM组患者血清MCL1水平明显高于对照组(P<0.05),MCL1水平与MM临床分期有关,临床分期越晚,MCL1表达水平越高。
综上所述,MM患者血清IL-6、IL-6R、MCL1均有高表达,并与MM临床分期呈正相关,可用于评价MM患者骨损伤及预后。
[1]YANG J,HE J,WANG J,et al.Constitutive activation of p38 MAPK in tumor cells contributes to osteolytic bone lesions in mutiple myeloma[J].Leukemia,2012,26(9):2114-2123.
[2]ROSE-JOHN S,SCHELLER J,ELSON G,et al.Interleukin-6 biology is coordinated by membrane-bound and soluble receptors:role in inflammation and cancer[J].J Leukoc Biol,2006,80(2):227-236.
[3]ZHANG H L,ZHANG X M,MAO X J,et al.Altered cerebrospinal fluid index of prealbumin,fibrinogen,and haptoglobin in patients with Guillain-Barré syndrome and chronic inflammatory demyelinating polyneuropathy [J].Acta Neurol Scand,2012,125(2):129-135.
[4]YOUNES H,LELEU X,HATJIHARISSI E,et al.Targeting the phosphatidylinositol 3-kinase pathway in multiple myeloma[J].Clin Cancer Res,2007,13(13):3771-3775.
[5]欧阳清,刘健,石青峰,等.骨代谢标志物在多发性骨髓瘤中的临床应用[J].国际检验医学杂志,2017,38(3):305-306.
[6]MORGAN G J,DAVIES F E,GREGORY W M,et al.Effects of induction and maintenance plus long-term bisphosphonates on bone disease in patients with multiple myeloma:the medical research council myeloma IX Trial[J].Blood,2012,119(23):5374-5383.
[7]Roodman G D.Pathogensis of myeloma bone disease [J].Leukemia,2009,23(3):435-441.
[8]刘晋玮,魏秀珍,李欣,等.多发性骨髓瘤患者血清可溶性白细胞介素-6受体水平的临床意义[J].国际输血及血液学杂志,2014,37(2):102-105.
[9]CHAUHAN D,NERI P,VELANKAR M,et al.Targeting mitochondrial actor Smac/DIABLO as therapy for multiple myeloma[J].Blood,2007,109(3):1220-1227.
[10]崔为发,李大启,杨金平,等.IL-2、IL-6及其受体与多发性骨髓瘤的研究[J].山东医药,2000,40(6):1-2.
[11]PERCIAVALLE R M,STEWART D P,KOSS B,et al.Anti-apoptotic MCL-1 localizes to the mitochondrial matrix and couples mitochondrial fusion to respiration[J].Nat Cell Biol,2012,14(6):575.
[12]CZABOTAR P E,LESSENE G,STRASSER A,et al.Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy[J].Nat Rev Mol Cell Biol,2014,15(1):49-63.
[13]PERCIAVALLE R M,OPFERMAN J T,DELVING D,et al.MCL-1′s contributions to normal and cancer biology[J].Trends Cell Biol,2013,23(1):22-29.

