不同体重指数患者血糖、血脂及血清因子水平的变化
周 卉,张学军,李蓬秋,鲜 杨,吴冀川,杨 艳
随着物质生活水平的提高,人们的生活方式和饮食结构发生改变,肥胖的患病率正日趋增加且愈发低龄化[1]。肥胖症患者患高血压、糖尿病、冠心病、阻塞性呼吸睡眠暂停综合症、肿瘤等疾病的风险显著增加[2]。2005年,全球处于超重状态的成年人近14亿,其中肥胖者约占30%[3]。调查显示,我国超重和肥胖的患者为23.2%[4]。肥胖患者可能存在低滴度的慢性炎症,在肥胖症患者中,多种血清因子可能在其中发挥了重要作用。本文选取到我院就诊的不同体重指数的患者作为研究对象,观察患者代谢指标及血清因子水平的变化。
1资料与方法
1.1一般资料选取到本院体检中心就诊的50例肥胖者作为肥胖组,体重超重的患者50例作为超重组、50例体重正常的患者作为正常体重组。肥胖组50例,其中男26例、女24例,年龄38~66岁,平均年龄(47.5±2.1)岁。超重组50例,其中男28例、女22例,年龄36~67岁,平均年龄(50.6±2.4)岁。正常组50例,其中男32例、女18例,年龄33~58岁,平均年龄(46.5±1.5)岁。测量身高、体重、收缩压(SBP)、舒张压(DBP),检测总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖(FPG)、空腹胰岛素(FINS)、C反应蛋白(CRP)、肿瘤坏死因子-ɑ(TNF-ɑ)、磷脂酰基醇蛋白聚糖-4(GPC-4)及鸢尾素(irisin)的水平。计算体重指数(BMI)=体重/身高2(kg/m2)、腰臀比:WHR。胰岛素抵抗指数:HOMA-IR=(FINS×FPG)/22.5。公式中FINS单位为uIU/ml,FPG单位为mmol/L。
1.2纳入排除标准
1.2.1纳入标准[5]:(1)肥胖组均为单纯性肥胖,肥胖、超重、体重正常的诊断标准依据中华医学会内分泌学分会肥胖学组定义:肥胖(BMI28kg/m2)、超重(BMI24-27.9kg/m2),正常(BMI 18.5-23.9kg/m2);(2)签署知情同意书。
1.2.2排除标准:(1)合并急慢性感染(2)合并心血管疾病、肾脏疾病、糖尿病患者(3)正在服用抗生素类药物的患者。
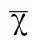
2结 果
2.1三组患者的临床及生化指标比较 肥胖组患者的SBP、DBP、TG、LDL-C、FINS、HOMA-IR均显著高于超重组及正常组患者(P<0.05);肥胖组患者的HDL-C低于超重组及正常组(P<0.05);超重组的SBP、DBP、TG、LDL-C、FINS、HOMA-IR均高于正常组(P<0.05);超重组的HDL-C显著低于正常组(P<0.05)。(表1)。肥胖组的TC、FPG高于超重组及正常组,超重组的TC、FPG高于正常组,但无统计学意义(P>0.05)

表1 三组临床及生化指标的比较(±s)
2.2三组患者的血清因子的比较
肥胖组患者的CRP、GPC-4、Irisin、TNF-ɑ测定值均显著的高于超重组及正常组(P<0.05);超重组患者的CRP、GPC-4、Irisin、TNF-ɑ测定值均显著高于正常组(P<0.05)。(表2)。

表2 三组血清因子水平比较(±s)
3讨 论
随着肥胖和超重人数增多,肥胖和超重已是全球第五大死亡的危险因素[6]。研究证明,肥胖是多种疾病的直接或间接诱因,可导致人体出现血糖、血脂异常及胰岛素分泌异常,导致糖尿病、高血压或其他代谢异常疾病,而胰岛素抵抗是肥胖发生代谢紊乱的病理生理基础。HOMA-IR反应胰岛素抵抗状态,HOMA-IR2.6[7]定为存在胰岛素抵抗。HOMA-IR越高,胰岛素抵抗越严重。本研究中肥胖组HOMA-IR为3.07±3.86,明显高于超重组及正常组,提示肥胖患者存在胰岛素抵抗。肥胖的本质是一种全身性慢性低度炎症[8,9],研究认为[10,11]肥胖的发生是由先天免疫因素所介导,在免疫因子、脂肪组织及多种炎症因子等各种因素交叉影响下产生。CRP主要由肝脏合成和分泌,作为人体内分布广泛炎性因子之一,是机体受到各种损伤或发生炎症反应后的一种急性期反应蛋白。而TNF-α是一种多效应的炎症因子,是脂肪组织分泌的多种促炎细胞因子中起促进作用的重要因子之一,调控脂肪组织中的炎性反应,TNF-α也有调控脂质生成、脂质代谢和胰岛素通路的作用[12].动物实验[13]证实高脂饮食肥胖大鼠体内脂肪组织中TNF-α水平较高,提示肥胖脂肪组织内伴有炎性因子的释放。本研究中,肥胖组患者的CRP、TNF-ɑ高于超重组及正常组;超重组患者的CRP、TNF-ɑ均高于正常组,证明随着体重指数的增加,炎症因子表达较正常水平显著改变。TNF-ɑ可直接导致胰岛β细胞损伤,诱发肥胖患者血糖上升及胰岛素抵抗,导致CRP分泌量增多,高表达CRP可致血管内皮凝血功能障碍及纤溶活性下降,导致血栓形成损伤血管。文献报道,GPC-4能够通过直接与胰岛素受体结合,并影响胰岛素信号转导通路,发挥类似胰岛素的作用,促进葡萄糖的摄取和前脂肪细胞的分化。GPC-4与BMI及正常葡萄糖胰岛素钳夹实验评价的胰岛素抵抗分别呈独立的正相关[14]。血清GPC-4随着BMI的增加而显著增加,尤其是在腹型肥胖的女性和腹型超重的男性中。多因素分析显示高浓度的血清GPC-4水平与更强的胰岛素抵抗是相关的。因此,血清GPC-4不仅是BMI的标记物,更是胰岛素抵抗的独立的标记物[15]。本研究发现,随BMI增加,血清GPC-4浓度呈逐渐上升趋势,与既往研究结果一致。Bostrom[16]等发现和报道了具有减肥作用的新激素irisin。irisin可促进白色脂肪棕色化,还能促进解耦连蛋白的表达,促进能量的消耗[17]。目前irisin在肥胖患者中的水平存在争议,国内研究[18]显示超重/肥胖者循环irisin水平较正常体重者偏低,推测可能与超重/肥胖者骨骼肌内过氧化物酶体增殖物激活受体γ辅助激活因子-1表达受损或者功能障碍有关。而Stengel等[19]对于不同肥胖程度的患者测定irisin的水平,发现irisin水平与体重及BMI水平呈显著正相关,与本研究结果一致。这可能与本研究中样本量较少,且选取的人群中男性居多,男性肌肉含量比女性更高,而irisin分泌自肌肉组织,可能与肌肉含量呈正相关。
综上所述,肥胖患者存在全身慢性炎症状态及胰岛素抵抗,代谢指标及血清因子水平高于超重患者及正常体重者,多种血清因子参与了其发生、发展,但它们的具体作用机制还需进一步研究,本研究不足之处在于样本量较少,需进一步扩大样本量及进行组织中血清因子的浓度测定,为肥胖患者的治疗提供新的思路。
[1]FLEGALKM,KITBK,ORPANAH,etal.Associationofall-causemortalitywithoverweightandobesityusingstandardbodymassindexcategories:asystematicreviewandmetaanalysis[J].JAMA2013,309(1):71-82.
[2]周北凡. 我国成人体重指数和腰围对相关疾病危险因素异常的预测价值:适宜体重指数和腰围切点的研究[J].中华流行病学杂志,2002,23(1):5-10.
[3]WorldHealthOrganization.Factsheet:obesityandoverweight[EB/OL].Avialableonline:http://www.who.int/mediacentre/factsheets/fs3ll/en/(accessedon5october2009).
[4]GAOY,RANXW,XIEXH,etal.PrevalenceofoverweightandobesityamongChineseYinationality:across-sectionalstudy[J].BMCPublicHealth,2011,11:919.
[5]中华医学会内分泌学分会肥胖学组. 中国成人肥胖症防治专家共识[J].中华内分泌代谢杂志,2011,27(9):711-717.
[6]PANDITAA,SHARMAD,PANDITAD,etal.Childhoodobesity:preventionisbetterthancure[J].DiabetesMetabSyndrObes, 2016, 9:83-89.
[7]ASCASOJF,PARDOS,REALJT,etal.Diagnosinginsulinresistancebysimplequantitativemethodsinsubjectswithnormalglucosemetabolism[J].DiabetesCare,2003,26(12):3320-5.
[8]HOTAMISLIGILGS.Inflammatorypathwaysandinsulinaction[J].IntJObesRelatMetabDisord., 2003, 27Suppl3:S53-5.
[9]MAURIZIG,DELLAGUARDIAL,MAURIZIA,etal.Adipocytespropertiesandcrosstalkwithimmunesysteminobesity-relatedinflammation[J].JCellPhysiol,2018, 233(1):88-97.
[10]OSAKAM,ITOS,HONDAM,etal.CriticalroleoftheC5a-activatedneutrophilsinhigh-fatdiet-inducedvascularinflammation[J].SciRep., 2016, 6:21391.
[11]VARMAMC,KUSMINSKICM,AZHARIANS,etal.Metabolicendotoxaemiainchildhoodobesity[J].BMCObes, 2016, 3:3.
[12]SMITKAK,MAREšOVáD.AdiposeTissueasanEndocrineOrgan:AnUpdateonPro-inflammatoryandAnti-inflammatoryMicroenvironment[J].PragueMedRep, 2015, 116(2):87-111.
[13]王琳琳,富宏,黎巍威,等. 地锦草改善2型糖尿病模型KK-Ay小鼠胰岛素抵抗的机制研究[J]. 中国中药杂志, 2015, 40(10):1994-1998.
[14]GESTAS,BLUHERM,YAMAMOTOY,etal.Evidenceforaroleofdevelopmentalgenesintheoriginofobesityandbodyfatdistribution[J].ProcNatlAcadSciUSA, 2006,103(17): 6676-81.
[15]USSARS,BEZY0,BLOHERM,etal.Glypican-4enhancesinsulinsignalingviainteractionwiththeinsulinreceptorandservesasanoveladipokine[J].Diabetes, 2012 ,61(9): 2289-98.
[16]BOSTRöMP1,WUJ,JEDRYCHOWSKIMP,etal.APGC1 -alpha-dependentmyokinethatdrivesbrown-fat-likedevelopmentofwhitefatandthermogenesis[J].Nature,2012,481(7382):463-8.
[17]WRANNCD,WHITEJP,SALOGIANNNISJ,etal.ExerciseinduceshippocampalBDNFthroughaPGC-1alpha/FNDC5pathway[J].CellMetab,2013,18(5): 649-59.
[18]杨梅丽,王宏涛,陈培红,等,Irisin与超重/肥胖及相关代谢参数的研究[J].中华内分泌代谢杂志, 2015,31(5) : 417-420.
[19]STENGELA,HOFMANNT,GOEBEL-STENGELM,etal.Circulatinglevelsofirisininpatientswithanorexianervosaanddifferentstagesofobesity-correlationwithbodymassindex[J].Peptides,2013,39:125-130.

