双水环境中Phe分子的手性转变机制
祝 颖, 曹殿钧, 陈洪斌
(吉林医药学院 生物医学工程学院, 吉林 吉林 132013)
苯丙氨酸(Phe)是人体蛋白质的重要组成部分之一, 是人体的必需氨基酸, 常温下为粉末状固体, 其分子一端的苯环有疏水性, 因此Phe为非极性分子. 人体无法自行合成Phe, 必须由饮食摄取, 通常由植物生成[1]. 文献[2]以手性Phe为前驱体, 于油酸中合成了多肽聚合物, 为多肽聚合物的合成提供了一条新途径; 文献[3]提出了一种新型手性催化合成L-Phe的方法, 以甘氨酸为反应底料, 经催化反应生成具有手性结构的烃化产物, 再经酸性水解得到L-Phe, 产率为40.1%, 旋光纯度为53.5%; 文献[4]在单晶中子衍射实验中实现了丙氨酸手性对映体构型的转变; 文献[5]研究了α-丙氨酸分子在不同环境下的手性转变机制, 但Phe分子在2个水分子依序分别协助羧基内质子与手性C上质子迁移过程, 实现Phe两种对映体转变机制的理论研究目前尚未见文献报道. 基于此, 本文对Phe分子在水环境中手性转变的过渡态性质进行理论研究, 进而完善双水环境下Phe分子手性转变反应机制的理论体系.
1 理论和计算方法
文献[6]研究表明, 分子手性对映体转变过程中H迁移为最佳反应路径. 本文以S-Phe为反应底物得到产物R-Phe手性转变过程中H迁移形成的过渡态[7-9]及中间体为研究对象, 描述该过程反应路径. 基于密度泛函理论(DFT)中的B3LYP[10-11]方法, 在6-311+G(2df)基组水平上对Phe单重态反应势能面的各极小值进行优化计算, 并在6-311++G(3df,3dp)基组水平上计算Phe单点能, 量化计算在Gaussian 09软件[12]包内进行.
2 结果与讨论
2.1 Phe分子对映体的结构
Phe分子在双水环境下S和R型手性对映体的基态稳定构型分别如图1和图2所示.

图1 S-3-Phe&2H2O型的分子结构Fig.1 Molecular structure of S-3-Phe&2H2O

图2 R-3-Phe&2H2O型的分子结构Fig.2 Molecular structure of R-3-Phe&2H2O
2.2 Phe分子S和R型手性对映体转变路径的构成
用S-3-Phe&2H2O,R-3-Phe&2H2O,TSX-S-3-Phe&2H2O,TSX-R-3-Phe&2H2O,INTX-S-3-Phe&2H2O,INTX-R-3-Phe&2H2O分别表示双水环境下Phe手性转变过程中各阶段的分子状态.
Phe分子手性转变路径可表示为S-3-Phe&2H2O→TS1-S-3-Phe&2H2O→INT1-S-3-Phe&2H2O→TS2-S-3-Phe&2H2O→INT2-S-3-Phe&2H2O→TS*-3-Phe&2H2O→INT2-R-3-Phe&2H2O→TS2-R-3-Phe&2H2O→INT1-R-3-Phe&2H2O→TS1-R-3-Phe&2H2O→R-3-Phe&2H2O. 图3为Phe分子手性转变路径示意图.
2.3 Phe分子中H转移的反应机制
本文仅给出INT2-R-3-Phe&2H2O→TS2-R-3-Phe&2H2O→INT1-R-3-Phe&2H2O等两个反应过程中H迁移的势能面示意图, 其余各过渡态反应过程势能面示意图略.
2.3.1 INT2-R-3-Phe&2H2O→TS2-R-3-Phe&2H2O→INT1-R-3-Phe&2H2O的反应过程 INT2-R-3-Phe&2H2O→TS2-R-3-Phe&2H2O→INT1-R-3-Phe&2H2O反应过程中各中间体结构及过渡态振动模式如图4所示, 其中以INT2-R-3-Phe&2H2O的能量为参考零势面. 在4H原子由27O向3C原子迁移过程中, 29H原子由25O迁移到27O原子, 24H原子由22O迁移到25O原子, 形成过渡态TS2-R-3-Phe&2H2O, 其唯一虚频为1 248.40i, 根据该虚频模式优化得到INT1-R-3-Phe&2H2O. INT2-R-3-Phe&2H2O→TS2-R-3-Phe&2H2O→INT1-R-3-Phe&2H2O反应过程中各稳定点能量及过渡态虚频列于表1.

图3 Phe分子手性转变路径示意图Fig.3 Schematic diagram of chiral transition path of Phe molecule

图4 INT2-R-3-Phe&2H2O→TS2-R-3-Phe&2H2O→INT1-R-3-Phe&2H2O的反应过程Fig.4 Reaction process of INT2-R-3-Phe&2H2O→TS2-R-3-Phe&2H2O→INT1-R-3-Phe&2H2O

表1 INT2-R-3-Phe&2H2O→TS2-R-3-Phe&2H2O→INT1-R-3-Phe&2H2O反应过程中各稳定点能量及过渡态虚频
2.3.2 INT2-S-3-Phe&2H2O→TS*-3-Phe&2H2O→INT2-R-3-Phe&2H2O的反应过程 INT2-S-3-Phe&2H2O→TS*-3-Phe&2H2O→INT2-R-3-Phe&2H2O反应过程中各中间体结构及过渡态振动模式如图5所示, 其中以INT2-R-3-Phe&2H2O的能量为参考零势面. 24H原子振动并伴随氨基等基团振动形成过渡态TS*-3-Phe&2H2O, 其唯一虚频为807.56i, 根据该虚频模式优化得到INT2-R-3-Phe&2H2O. INT2-S-3-Phe&2H2O→TS*-3-Phe&2H2O→INT2-R-3-Phe&2H2O反应过程中各稳定点能量及过渡态虚频列于表2.
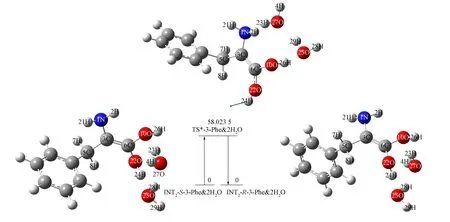
图5 INT2-S-3-Phe&2H2O→TS*-3-Phe&2H2O→INT2-R-3-Phe&2H2O的反应过程Fig.5 Reaction process of INT2-S-3-Phe&2H2O→TS*-3-Phe&2H2O→INT2-R-3-Phe&2H2O

表2 INT2-S-3-Phe&2H2O→TS*-3-Phe&2H2O→INT2-R-3-Phe&2H2O反应过程中各稳定点能量及过渡态虚频
由图5可见, 当双水作为H转移桥梁时, INT2-S-3-Phe&2H2O→INT2-R-3-Phe&2H2O反应过程中需越过的能垒为58.023 5 kJ/mol, 远小于孤立情况下需越过的能垒154.904 5 kJ/mol. 在该反应过程中, 双水构成的水链起桥梁作用, 具有较好的催化作用. 在B3LYP/6-311+G(2df)基组水平上, 对过渡态TS*-3-Phe&2H2O进行内禀反应坐标(IRC)分析, 进一步验证了过渡态的可靠性.
2.4 Phe分子手性转变过程中各过渡态的结构性质
2.4.1 Phe分子手性转变过渡态的振动模式 Phe分子手性转变过程中4个过渡态TS1-S-3-Phe&2H2O,TS2-S-3-Phe&2H2O,TS2-R-3-Phe&2H2O和TS1-R-3-Phe&2H2O的振动模式如图6所示.
2.4.2 Phe手性转变中各过渡态的前线分子轨道 以过渡态TS1-S-3-Phe&2H2O为例, 其前线分子轨道如图7所示. 由图7可见, 过渡态TS1-S-3-Phe&2H2O的最高占据分子轨道(HOMO)与最低未占分子轨道(LUMO)可体现过渡态的键特性.
2.5 Phe分子手性对映体的转变势能面
Phe分子手性对映体转变过程中各过渡态、 中间体、 反应物和产物的EB3L,ESP,ΔE,I列于表3. 由表3可得Phe分子手性转变过程的势能面能级图, 结果如图8所示. 经相同水平计算分析, 各过渡态均存在唯一虚频, 进而证明其为所寻找的过渡态.
综上可见, 2个水分子分别协助羧基内23H原子与手性C原子上的4H原子迁移完成手性转变过程, 该路径4个中间体和5个过渡态, 所得结果进一步完善了Phe分子双水环境下手性转变机制的理论体系.

图6 Phe分子手性转变过程中过渡态的振动模式Fig.6 Vibration modes of transition states during chiral transition of Phe molecule

图7 过渡态TS1-S-3-Phe&2H2O的前线分子轨道Fig.7 Frontier molecular orbits of TS1-S-3-Phe&2H2O

图8 Phe分子手性转变过程的势能面Fig.8 Potential energy surface for chiral transition process of Phe molecule

表3 反应过程中各稳定点和过渡态的EB3L,ESP,Δ E,I
[1] 高丽红, 赵平, 柴逸峰, 等. HPLC(CMPA)法分析苯丙氨酸对映体的研究 [J]. 第二军医大学学报, 2001, 22(11): 1046. (GAO Lihong, ZHAO Ping, CHAI Yifeng, et al. Analysis of Phenylalanine Enantiomers by HPLC (CMPA) Method [J]. Acad J Sec Mil Med Univ, 2001, 22(11): 1046.)
[2] 马杰, 杨建涛, 曾小玲, 等. 苯丙氨酸衍生类多肽聚合物纳米棒的制备及表征 [J]. 应用化工, 2015, 44(2): 261-263. (MA Jie, YANG Jiantao, ZENG Xiaoling, et al. Preparation and Characterization of Phenylalanine-Derived Peptide-Like Polymer Nanorods [J]. Applied Chemical Industry, 2015, 44(2): 261-263.)
[3] 吴建一, 谢亚杰. 新型手性相转移催化合成L2-苯丙氨酸 [J]. 精细石油化工, 2014(1): 14-17. (WU Jianyi, XIE Yajie. New Chiral Phase Transfer Supported Catalyst for Asymmetric Synthesis ofL2-Phenyalanine [J]. Speciality Petrochemicals, 2014(1): 14-17.)
[4] 王文清, 刘轶男, 龚. 手性分子的宇称破缺:D-和L-丙氨酸的变温中子结构研究 [J]. 物理化学学报, 2004, 20(11): 1345-1351. (WANG Wenqing, LIU Yinan, GONG Yan. Parity Violations on Molecular Chiality: Neutron Crystal-Structure ofD- andL-Alanine [J]. Acta Phys-Chim Sin, 2004, 20(11): 1345-1351.)
[5] 王佐成, 刘凤阁, 吕洋, 等. 孤立条件下α-丙氨酸分子手性转变机制的密度泛函理论 [J]. 吉林大学学报(理学版), 2014, 52(4): 825-830. (WANG Zuocheng, LIU Fengge, LÜ Yang, et al. Chiral Transformation Mechanism ofα-Alanine under Isolated Condition by Density Functional Theory [J]. Journal of Jilin University (Science Edition), 2014, 52(4): 825-830.)
[6] TIAN Chuanjin, XIU Peng, MENG Yan, et al. Enantiomerzation Mechanism of Thalidomied and the Role of Water and Hydroxide Ions [J]. Chem: A Eur J, 2012, 18(45): 14305-14313.
[7] Eyring H. The Activated Complex and the Absolute Rate of Chemical Reaction [J]. Chemical Reviews, 1935, 17(1): 65-77.
[8] Garrett B C, Truhlar D G. Generalized Transition State Theory. Classical Mechanical Theory and Applications to Collinear Reavtions of Hydrogen Molecules [J]. The Journal of Physical Chemistry, 1979, 83(8): 1052-1079.
[9] Garrett B C, Truhlar D G. Criterion of Minimum State Density in the Transition State Theory of Bimolecular Reactions [J]. The Journal of Chemical Physics, 1979, 70(4): 1593-1598.
[10] Becke A D. Density-Functional Thermochemistry. Ⅲ. The Role of Exact Exchange [J]. The Journal of Chemical Physics, 1993, 98(7): 5648-5652.
[11] 徐光宪. 量子化学 [M]. 北京: 科学出版社, 1999: 95-112. (XU Guangxian. Quantum Chemistry [M]. Beijing: Science Press, 1999: 95-112.)
[12] Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09. Revision A.01 [CP/CD]. Pittsburgh, PA: Gaussian Inc, 2009.

