JNK信号通路在长期游泳训练下巨噬细胞极化过程中的作用与探讨
杨志英
(华侨大学体育学院, 福建 泉州 361021)
巨噬细胞广泛分布于全身各个组织和器官,是机体固有免疫系统的重要成分之一,具有吞噬、抗原提呈和分泌多种细胞因子的功能,在保持内环境稳定、机体防御、炎症调控、促进损伤修复等方面起着重要作用[1]。巨噬细胞具有较强的可塑性,静息巨噬细胞在不同微环境下可激活分化为表型和功能迥异的两大类型:炎症型巨噬细胞和抗炎型巨噬细胞,又称M1巨噬细胞和M2巨噬细胞,这一过程成为巨噬细胞的极化[2]。
运动的健康促进、疾病防治效应与运动免疫调节作用密切相关,有报道表明长期运动能够通过影响巨噬细胞的极活性从而改善机体免疫力[3]。然而巨噬细胞的极化是一个多因子相互作用的复杂过程,受到细胞内多种信号分子及其通路的调控。c-Jun氨基末端激酶(c-Jun NH2-terminal kinase,JNK)是有丝分裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)家族成员之一,已有研究表明,JNK信号通路的激活与体外培养巨噬细胞凋亡有密切关系[4]。本文旨在研究JNK信号通路在长期有氧运动对巨噬细胞极化调节机制中的作用。
1 材料与方法
1.1 试剂与仪器
Hank's液(北京索来宝);胎牛血清,1640培养液(美国Gibco);流式周期试剂盒(上海碧云天);CD206探针(天津三箭);BCA蛋白浓度检测试剂盒(上海碧云天);JNK抗体、β-actin抗体、二抗、ECL发光液(上海碧云天);小鼠白介素4(IL-4)ELASA试剂盒(上海沪宇生物);SP600125(上海碧云天);Morris水迷宫(北京智鼠多宝DB001型);高速冷冻离心机(上海卢湘TGL-20M );超声破碎器(上海生析FS-250N);凝胶成像系统(美国伯乐Gel Doc XR+);流式细胞仪(美国BD FACSCanto II)。
1.2 动物实验分组级运动方案
选取健康6周龄ICR雄性小鼠48只,随机分为3组各16只,分别为:正常对照组,低强度游泳训练组和高强度游泳训练组。运动方案:游泳训练组先适应性游泳1周,低强度游泳训练组:每天20分钟,连续45天;高强度游泳训练组:每天40分钟,负重3g,连续45天;正常对照组不做运动训练;游泳场地:池直径120cm,高50cm,水温25℃。
1.3 巨噬细胞的分离及标本收集
运动训练结束后各组随机选取10只小鼠,每只小鼠腹腔注射0.2 ml 2%绵羊血红细胞以激活小鼠巨噬细胞4天后乙醚麻醉小鼠,腹腔注射加5%胎血清的Hank's液5ml/只,充分洗出腹腔巨噬细胞,吸取腹腔洗液用300目滤网过滤至试管内待测。其余每组6只小鼠运动训练结束后,麻醉,腹主动脉取血。
1.4 巨噬细胞周期检测
各组分离的细胞标本取106个细胞,离心,1*PBS洗2遍,80%冷甲醇-20℃固定16小时,PBS洗2遍,100ulPBS混匀细胞,各加入500ul/份 PI染液(RNA酶:Tri-X-100:PI:PBS=1:5:5:69),室温避光反应30分钟,流式细胞仪检测周期。
1.5 巨噬细胞极化分型检测
根据文献确定CD206阳性为M2型巨噬细胞分型标志[5],各组分离的细胞标本取106个细胞,离心,1*PBS洗2遍,200ul PBS重悬,各组加入CD206探针 5ul/样,室温避光反应30分钟,PBS洗2遍后,上机检测。
1.6 血清中IL-4检测
各组小鼠取血后分离血清,按照试剂盒说明书步骤进行操作。
1.7 JNK信号通路抑制体外实验
细胞系:小鼠巨噬细胞RAW264.7,实验分组:空白对照组,M2模型组(高强度运动训练组血清:培养液=1:4),抑制剂组(SP600125,10uMz终浓度),联合用药组(血清稀释液+ SP600125),培养24小时后,收集标本待测。
1.8 巨噬细胞JNK蛋白免疫印迹检测
收集各组细胞,提取总蛋白,BCA法测定蛋白浓度,定量,上样,电泳,转膜,抗原-抗体反应,ECL发光,凝胶成像系统拍照。
1.9 统计方法
统计学分析采用SPSS 17.0软件进行统计分析。计数资料以百分率表示,计量资料以均数士标准差表示。组间比较采用单因素方差分析,率比较采用卡方检验。P< 0.05为差异具有统计学意义。
2 结果
2.1 巨噬细胞周期检测
与正常对照组相比较,低强度游泳训练组腹腔提取的巨噬细胞G0/G1期数量增加、G2M期细胞减少,p<0.05,有统计学差异;高强度游泳训练组G0/G1期数量减少、S期和G2M期细胞增加,p<0.05,有统计学差异。

a.正常对照组 b.低强度训练组 c.高强度训练组图1 游泳训练各组巨噬细胞周期检测图

组别G0/G1期S期G2/M期正常对照组73.4%5.3%21.3%低强度训练组77.3%∗5.1%17.6%∗高强度训练组64.8%∗7.7%∗23.5%∗
注:*与正常对照组比较, p<0.05
2.2 血清中IL-4检测
与正常对照组比较,低强度游泳训练组血清中IL-4略升高,高强度游泳训练组血清中IL-4升高,p<0.05,有统计学差异。

表2 游泳训练各组血清中Il-4含量
注:*与正常对照组比较, p<0.05
2.3 巨噬细胞极化分型检测
与正常对照组比较,高强度游泳训练组CD206表达增高,p<0.05,有统计学差异。与空白对照组比较,模型组CD206表达增高,抑制剂组CD206表达降低,p<0.05,有统计学差异。

注:*与对照组比较,p<0.05.图2 各组巨噬细胞CD206+细胞比例
2.4 巨噬细胞JNK蛋白免疫印迹检测
与正常对照组比较,高强度游泳训练JNK蛋白表达含量增高,p<0.05,有统计学差异,见图3。体外实验中,与空白对照组比较,模型组JNK蛋白表达增加,抑制剂组JNK表达下降,p<0.05,有统计学差异,见图4。
2.5 巨噬细胞形态学观察
体内实验中,与正常对照组比较,低强度游泳训练组腹腔巨噬细胞形态变化不大,高强度游泳训练组中形态直径较大的巨噬细胞数量增多,见图5。体外实验中,空白对照组细胞称多角形,模型组细胞较圆钝,抑制剂组出现明显的伪足,联合作用组部分细胞出现较短的伪足,见图6。
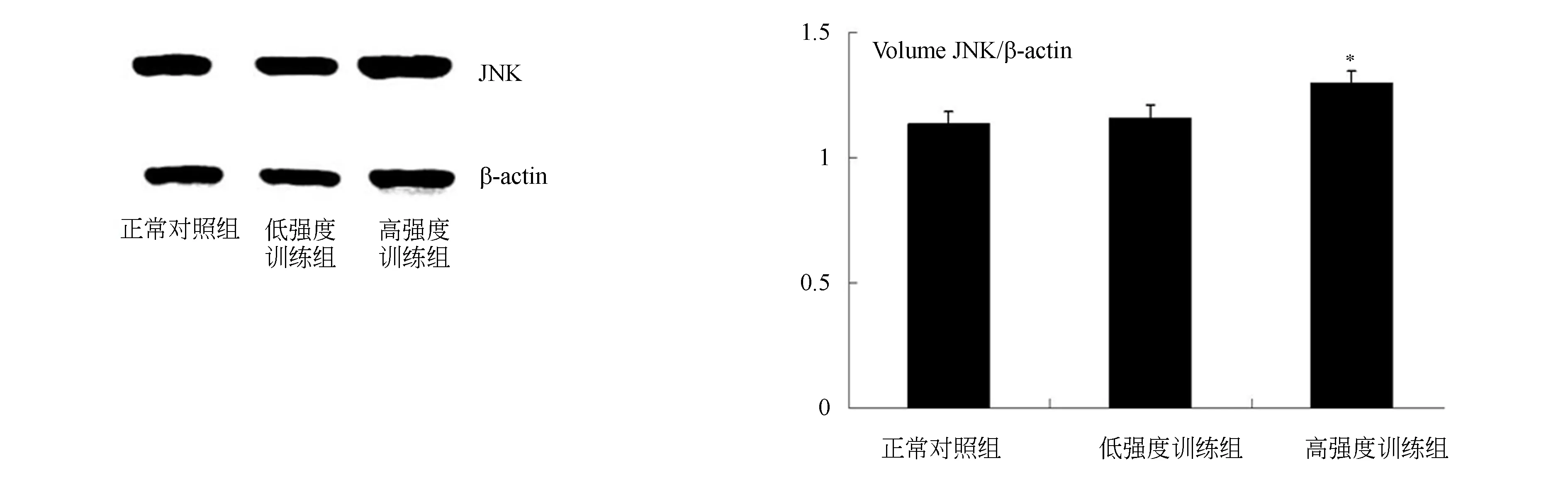
图3 游泳训练各组巨噬细胞JNK蛋白表达结果

图4 体外实验各组巨噬细胞JNK蛋白表达结果
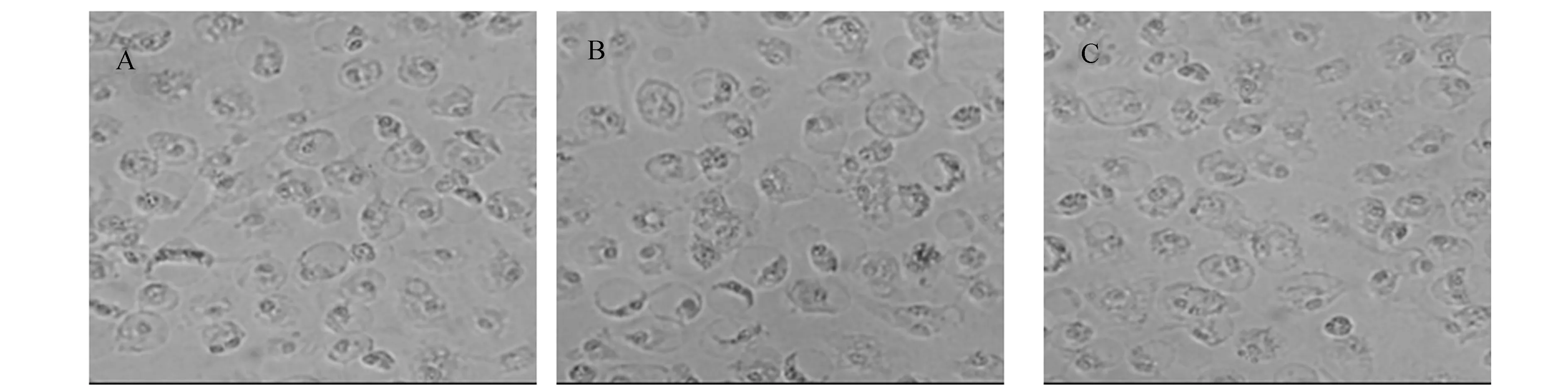
A:正常对照组 B:低强度训练组 C:高强度训练组图5 游泳训练各组巨噬细胞1×100倍视野
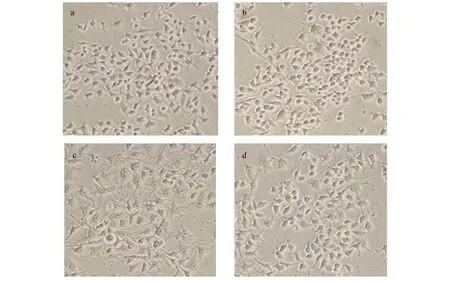
a:空白对照组 b:模型组 c:抑制剂组 d:联合作用组图6 体外实验各组RAW246.7细胞1×100倍视野
3 讨论
巨噬细胞在体内几乎参与所有的生物学过程,从机体发育、内环境稳态和组织修复,到对病原体进行免疫反应等。当机体的内环境稳态发生变化时,不同类型的巨噬细胞从血液中的单核细胞存储池、脾和骨髓中聚集,组织中的巨噬细胞也可以通过自身增殖而增加。在持续性损伤及微环境改变的作用下,为了应对组织的生理性变化和环境对组织的刺激,巨噬细胞不断地转换自己的功能表型从而使机体达到一个新的稳定状态[6]。多年来的研究已经表明,长期适度游泳运动可以增强机体免疫力,然而长期高强度的游泳训练也可以对身体造成多方面的组织损伤和生理变化[7-9]。运动性应激会引发机体神经-内分泌-免疫系统一系列急性反应,对机体的免疫机能会产生不同影响,研究表明,长时间大强度运动后抑制机体免疫机能,主要表现为淋巴细胞数量减少,增殖活化能力能力降低,延迟性超敏反应降低,Th1向Th2偏离,导致免疫细胞功能降低[10]。也有研究表明长期高强度游泳训练可引起巨噬细胞M2型极化[11]。本实验的结果显示,长期高强度游泳训练可以导致小鼠巨噬细胞CD206高表达,M2型巨噬细胞数量增多。M2型巨噬细胞可参与调节机体的炎症反应、适应性免疫反应和碎片清除,并有助于血管发生、组织重建和组织修复[12],亦可以分泌多种细胞因子促进Th2型免疫反应。本实验结果高强度游泳训练组M2型巨噬细胞数量的增加也说明长期高强度游泳训练导致了组织受损,巨噬细胞需通过M2型极化来进行组织修复。
IL-4是具有典型代表意义的Th2细胞因子,是具有多种生物学功能的细胞因子,其经典的作用包括刺激细胞和促使B细胞向浆细胞分化以及诱导B细胞分泌IgE,促使Th1型细胞向Th2型细胞分化,同时对多种免疫细胞均有调节作用[13]。近年来的研究也发现,IL-4是诱导巨噬细胞M2型极化的效应物[14]。实验结果表示,长期高强度游泳训练可导致实验动物体内IL-4水平上升,而IL-4水平的升高也可能和长期高强度游泳训练对多系统造成的损伤有关。本次实验通过检测运动训练后动物血清中IL-4水平,并成功采用稀释性血清诱导巨噬细胞M2型极化,也和其他研究者通过IL-4诱导小鼠巨噬细胞RAW246.7产生M2型极化的结果相一致。
MAPK是哺乳动物细胞内广泛存在的一类丝氨酸/苏氨酸蛋白激酶,目前已鉴定出4种家族成员,分别为细胞外信号调节激酶(extracelluiar signal regulated kinase 1/2, ERK1/2)、JNK、p83及ERK5。MAPK通路的基本组成是高度保守的三级激酶模式,包括MAPK激酶激酶(MAP kinase kinase kinase,MKKK)、MAPK激酶(MAP kinase kinase,MKK)和MAPK,这三种激酶能依次激活,共同调节着细胞的生长、分化、对环境的应激适应、炎症反应等多种重要的细胞生理与病理过程,在多种MKKK激酶中,有14种可以激活MKK4/MKK7/JNK信号通路[15]。JNK又被称为应激活化蛋白激酶(stress-activatedki-nases, SAPK), 是1990年被发现的促分裂原活化蛋白激酶。JNK信号转导通路作为MAPK通路的一重要分支,它在细胞周期、生殖、凋亡和细胞应激等多种生理和病理过程中起重要作用,可被应激如电离辐射、渗透压、热体克和氧化损伤等多种因素以及多种细胞因子所激活[16]。SP600125也称Anthrapyrazolone或1,9-Pyrazoloanthrone,是一种常用的泛JNK抑制剂,可显著抑制JNK介导的c-Jun磷酸化,抑制多个相关基因的表达。有研究表明JNK信号通路与巨噬细胞活化相关[4],本实验的结果显示巨噬细胞通过诱导发生M2型极化过程中,出现了JNK蛋白的高表达,随着抑制剂SP600125的干预,巨噬细胞M2极化过程也受到抑制。
细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,包括间期和分裂期。细胞分裂期称为M期,间期分为三期,即 DNA 合成前期(G1期)、DAN合成期(S 期)与 DNA 合成后期(G2 期)。细胞周期的调控受多种因素和各种不同的细胞周期蛋白因子的调节,研究表明,JNK信号通路受抑制可导致细胞周期阻滞[17]。本实验的结果显示,长期高强度游泳训练可导致巨噬细胞出现周期阻滞,这一过程也可能是和长期高强度游泳训练所导致机体组织损伤,细胞内活性氧水平改变有关[18],而活性氧的改变又可抑制JNK活性[19]。
4 结论
1)长期高强度游泳训练可导致小鼠巨噬细胞发生M2型极化;
2)小鼠巨噬细胞M2型极化与JNK信号通路相关。
[1] Matteo Santoni, Stefano Cascinu,Charles D Mills.Altering macrophage polarization in the tumor environment:the role of response gene to complement 32[J].Cellular & Molecular Immunology, 2014, 62(6):783-784.
[2] 周宪宾,姚成芳.巨噬细胞M1 /M2极化分型的研究进展[J].中国免疫学杂志,2012,28(10):957-961.
[3] 赵影,田萌,毛丽娟.运动与免疫衰老的研究进展[J].武汉体育学院学报,2015,49(6):70-74.
[4] 李斌,曾勉,何婉媚等.Ghrelin通过JNK信号通路抑制LPS诱导的肺泡巨噬细胞凋亡[J].中山大学学报(医学科学版),2015,36(2):181-188.
[5] 戴良成,袁保红,罗晓春等.黄芪甲苷促M2型巨噬细胞极化的作用研究[J].广东药学院学报,2016,32(4):494-499.
[6] FRANKEN L, SCHIWON M, KURTS C. Macrophages: sentinels and regulators of the immune system[J].Cell Microbiol.2016, 18 (4) :475-487.
[7] 吴琳,陈为,胡惕.不同强度游泳训练对雄性小鼠生精能力的影响[J].北京体育大学学报,2015,38(6):77-81.
[8] 赵歌,章前,许琦,李俊平.高强度训练对游泳运动员血乳酸及相关指标的影响[J].北京体育大学学报,2009,32(2):80-82.
[9] Oláh A,Németh BT,Mátyás C,et al.Cardiac effects of acute exhaustive exercise in a rat model[J].Int J Cardiol.2015,3(182):258-266.
[10] 吴卫兵,陈佩杰,刘晓丹,等. 5周递增负荷训练对内分泌免疫机能影响的研究[J].体育科学,2007, 27(4): 59-63.
[11] 贺强,季浏.一次急性耐力游泳运动对DIO小鼠脂肪组织巨噬细胞介导的慢性炎症的影响[J].北京体育大学学报,2016,38(2):61-68.
[12] 徐志鹏,左国平,靳建亮.巨噬细胞异质性及其在炎症调控中的研究进展[J].细胞与分子免疫学杂志,2015,31(12):1711-1714.
[13] Yamanishi Y, Karasuyama H.Basophil-derived IL-4 plays versatile roles in immunity[J].Semin Immunopathol,2016,38(5):615-22.
[14] Orihuela R, McPherson CA, Harry GJ.Microglial M1/M2 polarization and metabolic states[J].Br J Pharmacol,2016,173(4):649-65.
[15] Rauch N, Rukhlenko OS, Kolch W, Kholodenko BN.MAPK kinase signalling dynamics regulate cell fate decisions and drug resistance[J].Curr Opin Struct Biol, 2016,10(41):151-158.
[16] 李佳殷,林丽珠.JNK信号通路在恶性肿瘤中的研究进展[J].实用中医内科杂志,2012(18):10-11.
[17] 李恒元,孙凌凌,李冰皓等.雷公藤红素通过ROS/JNK通路诱导骨肉瘤细胞周期阻滞、凋亡和自噬的研究[J].中华骨科杂志,2016,36(8):490-503.
[18] 于加倍,衣龙彦,胡扬.间歇低氧运动对模拟海拔5000m人体氧化应激和抗氧化能力的影响[J].武汉体育学院学报,2015,49(9):97-100.
[19] 肖卫华,陈佩杰.过度训练对大鼠腹膜巨噬细胞活性氧生成能力的影响及其相关机制研究[J].中国运动医学杂志,2011,30(8):736-739.

