猪瘟C株疫苗诱导PBMCs中SLA等位基因差异性表达分析
李守杰,贾怀杰,成温玉,王春燕,金启旺,景志忠
(中国农业科学院兰州兽医研究所/家畜疫病病原生物学国家重点实验室/农业部兽医公共卫生重点实验室,甘肃兰州 730046)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起的高度接触性、致死性传染病,在许多国家呈地方性流行,对世界养猪业造成了巨大的经济损失。当前,猪瘟仍是危害养猪业的重要疫病之一,其持续性感染和疫苗接种失败现象比较普遍,给猪瘟的防控和净化带来了较大困难[1]。为研制安全、高效的猪瘟疫苗,实施免疫控制与净化,其免疫调节机制研究显得尤为重要。
20世纪30年代中期,Snell等在近交系小鼠中发现了主要组织相容性复合体 (major histocompatibility complex,MHC)基因。自此概念提出以后,MHC的研究引起了科技工作者极大兴趣。MHC是一类存在于脊椎动物染色体特定区域的紧密连锁的具有高度多态性的基因群,不同动物的MHC及其编码产物名称均不相同,其编码产物命名以LA加上物种开头字母,如人MHC分子简称为HLA(human leucocyte antigen),猪MHC分子称为SLA(swine lymphocyte antigen)。
Viza D等[2-4]于1970年首次发现猪的MHC分子即SLA。猪是接近人类的模式动物,因此引起了人们对SLA研究的极大兴趣[5-8]。研究发现,猪的SLA与人的HLA基因组结构基本相似[9],由SLA Ⅰ、SLA Ⅱ和SLA Ⅲ 3个基因簇组成,其中发现SLA Ⅰ和 SLA Ⅱ与病原抗原加工、递呈以及T细胞活化有关[10]。虽然每个基因簇都含有数目不等的同源性基因,但很多为假基因或无功能基因,如在SLA Ⅰ基因中只有SLA-1、SLA-2和SLA-3基因被称为功能性基因,其与内源性抗原递呈有关[11-12];SLA Ⅱ类基因簇中SLA-DQA、SLA-DQB、SLA-DRA和SLA-DRB基因在蛋白质水平上表达,参与外源抗原递呈[13-14];此外,每个基因座含有数目不等的复等位基因,且各复等位基因之间表现为单核苷酸多态性,其中SLA Ⅰ类基因簇含有116个复等位基因,SLA Ⅱ类基因簇含有167个复等位基因[15]。
由于MHC编码的蛋白参与抗原加工及递呈、免疫识别、免疫排斥和免疫应答,并与疾病的发生发展具有高度相关性,在免疫应答反应中发挥重要作用[10]。自1970年首次发现SLA以来,已证实SLA与疾病易感性、生产性能、经济性状等关系密切,其中SLA Ⅰ和 SLA Ⅱ类分子等位基因的表达类型和表达量变化,可间接反映机体免疫与抗病状态。因此,本试验以猪SLA为研究对象,结合RT-qPCR分析猪瘟C株疫苗毒免疫后诱导猪外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)中SLA的表达变化规律,初步探讨SLA表达差异与免疫抗病的关系。
1 材料与方法
1.1 材料
1.1.1 试验用动物 实验室近交培育12代(F12)的合作小型猪,同窝4头10周龄仔猪,CSFV、口蹄疫病毒(Foot-and-mouth disease virus,FMDV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪圆环病毒2型(Porcine circovirus type 2,PCV2)、猪伪狂犬病病毒(Pseudorabies virus,PRV)和猪细小病毒(Porcine parvovirusPPV)等血清学检测均为阴性,且无其他病原感染,临床表现健康。其中3头仔猪(P1、P2、P3)作为免疫组,1头仔猪(P4)作为对照。免疫组每头仔猪背部皮下注射4头份猪瘟C株活疫苗(中牧实业股份有限公司,批号201501114),对照组按相同方法注射等量生理盐水。
1.1.2 主要试剂和试剂盒 猪瘟间接血凝抗体检测试剂盒,购自中国农业科学院兰州兽医研究所诊断中心;PRRSV、PCV2、PRV和PPV血清学检测试剂盒,武汉科前生物股份有限公司产品;淋巴细胞分离液,美国Sigma公司产品;感受态大肠埃希菌DH5α、Trizol reagent,上海Invitrogen公司产品;pGEM-Teasy载体、GoScriptTMReverse Transcription System反转录试剂盒,美国Promega公司产品;PCR产物纯化试剂盒、TaqDNA聚合酶、DNA Marker和荧光定量PCR试剂盒,宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 采血及抗体滴度测定 在猪瘟C株疫苗免疫前(0 d)以及免疫后3、5、9 d,对4头猪进行前腔静脉采血10 mL,新鲜血样分别置于含有2 mL 109 mmol/L柠檬酸钠抗凝剂的三角瓶中,进行PBMCs的分离准备,另外准备1 mL非抗凝血分离血清用于猪瘟抗体的检测。
1.2.2 密度梯度离心法分离纯化PBMCs 按照淋巴细胞分离液(Ficoll)说明书进行操作。将处理好的抗凝血置于15 mL玻璃离心管中进行PBMC的分离。分离纯化后用血球计数板进行计数,每份样品取2×107PBMCs于2 mL离心管,用于总RNA的抽提。剩余细胞加入足量的Trizol,混匀后置于-80℃保存备用。
1.2.3 RNA的提取和cDNA的合成 2×107PBMCs加1 mL Trizol,按照Trizol Reagent Kit说明书,在无RNase污染的环境进行严格操作,最后用25 μL DEPC H2O溶解,65℃水浴促溶。分光光度法(Nano Drop ND-1000)测定RNA浓度,并进行纯度检测(OD260/OD260的比值即为RNA纯度,比值范围1.8~2.1)。质量测定合格后,取1 μg RNA 通过反转录试剂盒GoScriptTM Reverse Transcription System转录合成第一链cDNA。cDNA保存于-80℃备用。
1.2.4 RT-qPCR法分析SLA的表达差异
1.2.4.1 RT-qPCR引物设计与合成 根据GenBank上公布的SLAⅠ和SLAⅡ类分子基因序列,选取各基因家族相对保守的序列,用Primer3软件(http://bioinfo.ut.ee/primer3-0.4.0/primer3/)设计5对SLA特异性引物和1对GAPDH引物(表1)。其中由于SLAⅠ类基因家族中三类功能性基因SLA-1、SLA-2和SLA-3同源性太高,针对三者仅设计了1对通用引物。所有引物由上海Invitrogen公司进行合成。

表1 RT-qPCR引物及其扩增片段预期大小
1.2.4.2 引物特异性验证及其内参基因的选择 总RNA经反转录合成cDNA 后,首先进行常规PCR,验证目的基因引物特异性和片段大小,然后再通过RT-qPCR法检测验证目的基因引物特异性,能否产生特异性单峰的熔解曲线和完整单一的扩增曲线是检验引物特异性的有效手段。GAPDH作为内参基因的可行性验证,内参基因扩增曲线Ct值要避免过大或过小,并且在不同时间点的样品中能够稳定表达。
1.2.4.3 模板稀释度的优化 取免疫0、3、5、9 d猪PBMCs样品cDNA,用DEPC水梯度稀释,依次为1∶5、1∶10、1∶20和1∶40,在同一反应条件下用上述6对引物(SLAⅠ、SLA-DQA、SLA-DQB、SLA-DRA、SLA-DRB和GAPDH)进行RT-qPCR扩增,通过其扩增曲线选择合适的稀释度。
1.2.4.4 RT-qPCR体系和反应程序 采用SYBR Green荧光染料法,于Agilent MX3005P荧光定量PCR仪中进行。RT-qPCR体系:SYBR○RPremix ExTaqTM Ⅱ 10.0 μL,ROX Reference Dye Ⅱ 0.4 μL,Forward primer 0.8 μL,Reverse primer 0.8 μL,cDNA 2.0 μL,加RNase-free H2O至20 μL。RT-qPCR反应程序为:95℃预变性30 s;95℃ 5 s,60℃ 30 s,扩增40个循环;熔解曲线程序为95℃ 1 min;55℃ 30 s,95℃ 30 s。
1.2.4.5 各样品的重复性试验 将每头猪的每份样品分别扩增3次,然后对结果进行数据分析。
1.2.5 SLAⅡ类分子等位基因优势取用与单核苷酸多态性分析 依据RT-qPCR检测目的基因表达差异分析结果,选择SLA表达明显上调的样品进行进一步等位基因优势取用与单核苷酸多态性分析。
1.2.5.1 目的基因全长序列的的引物设计与合成 参照GenBank中猪的SLAⅡ类基因全长序列,用DNA Star软件在阅读框外侧各设计了1对特异性引物(表2)。
1.2.5.2 引物特异性验证 对样品cDNA进行常规PCR扩增,验证引物特异性。
1.2.5.3 测序分析 采用常规PCR,以免疫后第5天样品的cDNA为模板扩增SLAⅡ类分子(SLA-DQA、SLA-DQB、SLA-DRA和SLA-DRB)全长基因,产物胶回收后与T载体连接,进行DH5α转化后,挑取单菌落并进行PCR鉴定,随机各选取10个阳性克隆进行测序分析。
1.2.5.4 序列相似性检索及其系统发育树的构建 对测序中出现高频表达的序列在NCBI中进行Blast相似性检索,确认其等位基因类型,然后用MEGA5.1软件做系统发育树分析进行同源性比较及聚类分析。
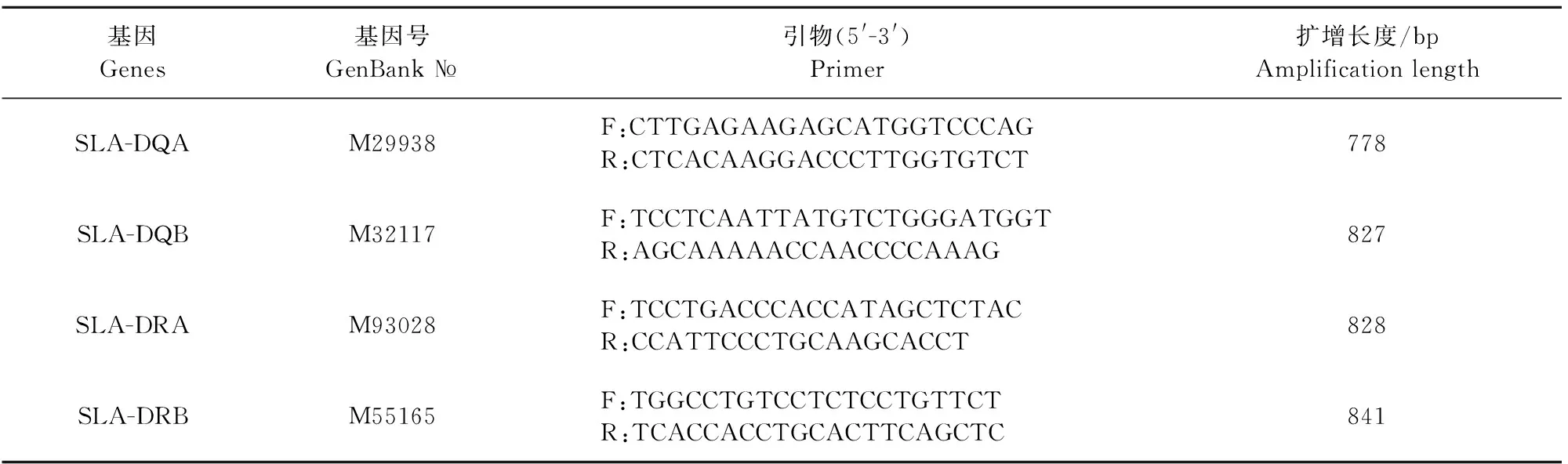
表2 引物及其扩增片段预期大小
2 结果
2.1 抗体滴度检测
在免疫后9 d试验组试验猪均出现具有保护效价的抗体滴度,而对照组抗体效价无变化,表明免疫接种成功(图1)。
2.2 目的基因差异表达RT-qPCR检测结果
2.2.1 引物特异性及其内参基因选择 常规PCR扩增的条带单一且目标片段大小与预期结果一致(图2),说明是特异性的PCR扩增;在RT-qPCR检测中,目的基因均具有特异性荧光信号,扩增曲线完整单一,熔解曲线呈现单峰,说明所设计合成的引物具有良好的特异性;不同时间点的模板cDNA其GAPDH扩增曲线Ct值在21左右,表达稳定,区间范围合理,可以选做为内参基因。
2.2.2 模板稀释度的确定 10倍稀释的模板能够保证6个基因在不同时间点的扩增曲线Ct值分布在15~30区间内,区间合理,避免了Ct值过大或过小的问题。
2.2.3 RT-qPCR检测结果 相对于免疫前(0 d),猪瘟C株疫苗免疫后,试验组3头猪样品目的基因表达出现规律性的差异表达趋势。其中试验猪的SLA-Ⅱ类基因(SLA-DQA、SLA-DQB、SLA-DRA和SLA-DRB)在免疫后第3天和第5天均表现为上调表达,第5天达到高峰,第9天开始回降;SLAⅠ类基因在第3天表现为上调表达,第5天均回降;在对照组猪,无论SLA Ⅰ类基因还是SLA Ⅱ类基因的表达均比较稳定,未出现明显的变化(图3)。
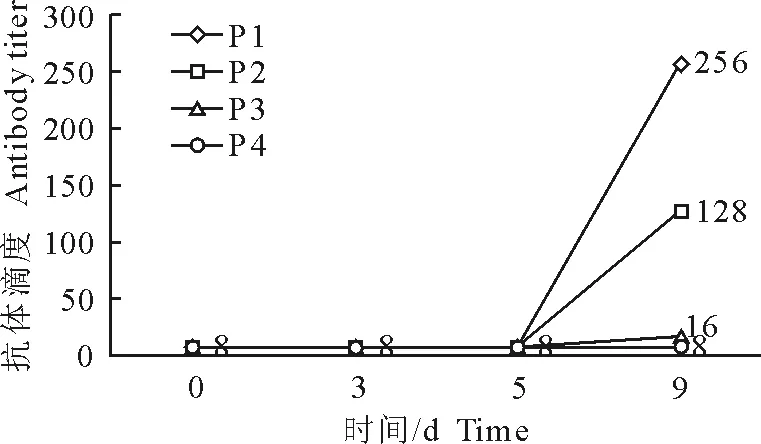
图1 血清抗体滴度
M.DNA标准DL 2 000;1.阴性对照;2.SLA-DQA;3.SLA-DQB;4.SLA-DRA;5.SLA-DRB;6.SLA Ⅰ;7.GAPDH
M.DNA Marker DL 2 000; 1.Negative control; 2.SLA-DQA; 3.SLA-DQB; 4.SLA-DRA; 5.SLA-DRB; 6.SLA Ⅰ; 7.GAPDH
图2目的基因常规PCR扩增产物凝胶电泳图
Fig.2 Gel electrophoresis of the PCR products of target genes
2.3 SLAⅡ类分子等位基因优势取用与序列单核苷酸多态性分析结果
2.3.1 SLAⅡ类分子等位基因全长序列扩增结果 分别用SLA-DQA、SLA-DQB、SLA-DRA和SLA-DRB的特异性引物, 采用PCR扩增全长目的基因,发现扩增条带单一,且目标片段大小与预期结果一致(图4)。
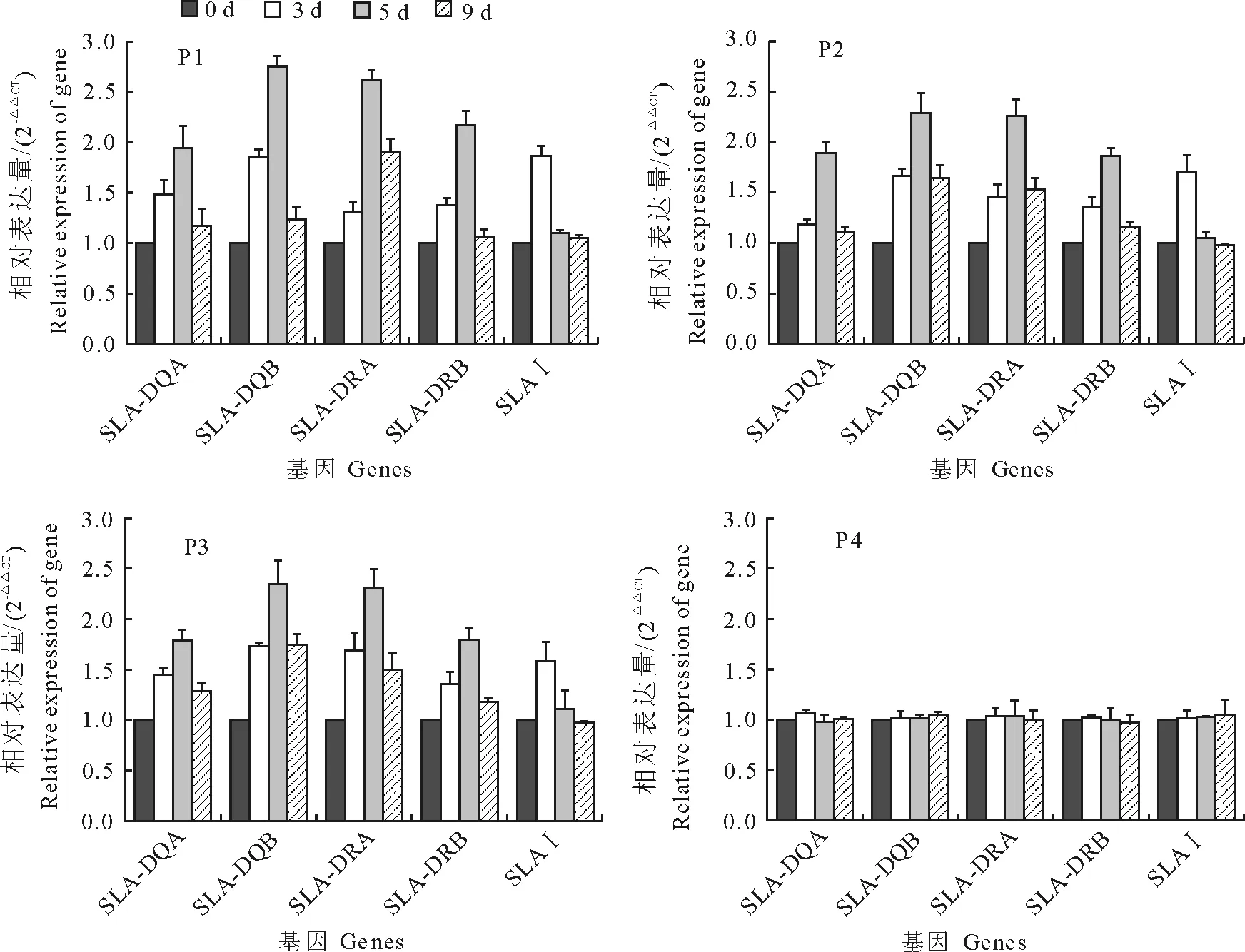
图3 试验组和对照组SLA基因在不同时间点表达的RT-qPCR检测结果
2.3.2 SLAⅡ类分子等位基因优势取用测序分析 测序发现,3头试验猪(P1、P2、P3)SLA-DRA PCR扩增产物中,存在一个相同的高频表达的全长序列,在每头试验猪的10个SLA-DRA基因阳性克隆中出现的频率分别为7/10、6/10和7/10,开放阅读框大小为759 bp,暂且命名为Susscrofa(DRA);另外,在SLA-DRB中也发现了一个相同的高频表达序列,其在每头试验猪10个SLA-DRA基因阳性克隆中出现的频率分别是6/10、8/10和7/10,开放阅读框大小为801 bp,暂且命名为Susscrofa(DRB)。为确认这种高频表达的可靠性,我们对相应模板进行了二次扩增与测序,发现相同序列仍然出现,且频率与第一次测序结果相近,其中Susscrofa(DRA)分别为6/10、6/10和7/10,Susscrofa(DRB)分别为7/10、6/10和7/10。

M.DNA标准DL 2 000;1.SLA-DQA;2.SLA-DQB;3.SLA-DRA;4.SLA-DRB
M.DNA Marker DL 2 000; 1.SLA-DQA; 2.SLA-DQB; 3.SLA-DRA; 4.SLA-DRB
图4 SLA Ⅱ类基因常规PCR扩增产物凝胶电泳图
Fig.4 Gel electrophoresis of the PCR products of SLA Ⅱ genes
2.3.3 SLAⅡ类分子优势取用等位基因单核苷酸多态性比对及进化树分析 通过对高频表达的SLA-DRA、SLA-DRB全长序列分别在NCBI中进行Blast分析,发现数据库中存在与其相似度很高的SLA-DRA、SLA-DRB序列,仅存在几个位点的差异,序列之间表现为单核苷酸的多态性(表3和表4),其中Susscrofa(DRB)在数据库中还未被收录,
可能为一个新的等位基因;然后用MEGA5.1软件分别进行DRA和DRB的系统发育树分析,发现它们与相似序列之间各自存在99%以上的同源性,说明在进化关系上很接近;并且在聚类分析中,2个高频表达基因能够很好地归聚为SLA-DRA和SLA-DRB 2种基因型(图5)。

表3 Sus scrofa(DRA)与其他相似性较高的序列之间的单核苷酸多态性
注:表中数字代表核苷酸在基因编码区序列中的位置。
Note:The numbers in the table represent the position of the nucleotide in the gene coding region sequence.

表4 Sus scrofa(DRB)与其他相似性较高的序列之间的单核苷酸多态性
注:表中数字代表核苷酸在基因编码区序列中的位置。
Note:The numbers in the table represent the position of the nucleotide in the gene coding region sequence.

图5 Sus scrofa (DRA)和Sus scrofa (DRB)的聚类分析
3 讨论
MHC分子在获得性免疫应答中发挥重要作用,与疾病的发生发展存在相关性,说明MHC分子在转录水平上的动态表达受相关疾病的影响。如病毒等可通过自身编码的免疫调节因子下调宿主MHC分子的表达,干扰宿主的抗原递呈作用,诱导机体产生免疫耐受,增加病毒对宿主的易感性[16];另外,流感病毒感染小鼠后,其肺巨噬细胞能上调MHC-Ⅰ类分子表达,正向促进小鼠的免疫应答,具有免疫保护作用[17]。越来越多的研究证实,在感染性疾病中,宿主和病原的相互作用能影响MHC分子的表达。
研究发现,MHC基因群具有高度多态性[15],因其在机体免疫应答中发挥的重要作用,已成为动物抗病性的候选标记基因。报道指出,鸡对相关传染病、寄生虫病和自体免疫病的易感性与自身携带的MHC基因型有关[18];仔猪对大肠埃希菌的易感性和抗性与自身MHC型别有关[19-20];其他研究也相继证明MHC分子特异性与动物抗病性具有相关性。但目前尚未有猪瘟C株疫苗免疫猪后与SLA分子差异表达相关性的报道。
通过RT-qPCR检测发现,猪瘟C株疫苗免疫接种试验猪后,SLA Ⅰ、SLA Ⅱ类分子基因出现表达上调,一段时间后回降,呈现规律性消长变化;而对照组SLA基因表达趋于稳态。说明猪瘟疫苗毒免疫接种猪后,能促进机体SLA的表达,并产生抗CSFV免疫相关的反应;随着机体对抗原免疫清除的完成,机体免疫应答恢复正常,SLA的表达呈现回落。这与机体抗原递呈细胞(antigen-presenting cell,APC)经抗原刺激而活化参与T细胞免疫应答的规律相类似。
SLA表达上调一方面可以作为疫苗激活机体免疫应答的一个标志,另一方面可结合测序确定上调表达SLA分子等位基因的序列,筛选出优势选用的SLA,进一步分析其与猪瘟C株疫苗毒免疫的相关性,为猪瘟安全高效疫苗设计、药物研发等提供重要的分子基础依据。 本研究通过对试验组猪第5天cDNA模板的SLAⅡ类分子全长基因的克隆与测序分析,发现了两段高频表达(60%~80%)的基因序列,经分子进化树和聚类分析发现,这两段基因序列在NCBI中在均存在相似性和同源性很高的SLAⅡ类等位基因,并表现为单个核苷酸的多态性,其中Susscrofa(DRB)可能为一个新的等位基因。后经重复性验证试验,进一步证明,PCR克隆到的这两段高频表达的序列确实为猪的优势选用SLA-DRA和SLA-DRB基因,这说明在猪瘟C株疫苗毒免疫后存在优势选用等位基因的可能性,但这种等位基因的优势选用和差异表达规律是否与免疫有关还是与猪种品系相关,还需开展深入研究与大数据分析工作。
[1] Wang C,Sun Y,Qiu H.Progress in new-type vaccines against classical swine fever [J].Sheng Wu Gong Cheng Xue Bao,2013,29(7):880-90.
[2] Vaiman M,Renard C,LaFage P,et al.Evidence for a histocompatibility system in swine (SLA) [J].Transplantation,1970,10(2):155-164.
[3] Viza D,Sugar J R,Binns R M.Lymphocyte stimulation in pigs:evidence for the existence of a single major histocompatibility locus,PL-A [J].Nature,1970,227(5261):949-950.
[4] Vaiman M,Metzger J J,Renard C,et al.Immune response gene(s) controlling the humoral antilysozyme response (Ir-Lys) linked to the major histocompatibility complex SLA in the pig [J].Immunogenetics,1978,7(1):231-8.
[5] Bidanel J P,Milan D,Iannuccelli N,et al.Detection of quantitative trait loci for growth and fatness in pigs [J].Genet Sel Evol,2001,33(3):289-309.
[6] Logan J S.Prospects for xenotransplantation [J].Curr Opin Immunol,2000,12(5):563-568.
[7] Wang L,Yu T P,Tuggle C K,et al.A directed search for quantitative trait loci on chromosomes 4 and 7 in pigs [J].J Anim Sci,1998,76(10):2560-2567.
[8] Yang Y G.Application of xenogeneic stem cells for induction of transplantation tolerance:present state and future directions [J].Springer Semin Immunopathol,2004,26(1-2):187-200
[9] Renard C,Hart E,Sehra H,et al.The genomic sequence and analysis of the swine major histocompatibility complex [J].Genomics,2006,88(1):96-110.
[10] Vaiman M,Chardon P,Rothschild M F.Porcine major histocompatibility complex [J].Rev Sci Tech,1998,17(1):95-107.
[11] 李 华.中国猪种SLA-DQB基因外显子2的遗传多样性及进化机制研究[D].四川雅安:四川农业大学,2002.
[12] Renard C,Vaiman M,Chiannilkulchai N,et al.Sequence of the pig major histocompatibility region containing the classical class I genes [J].Immunogenetics,2001,53(6):490-500.
[13] 潘孝成.猪MHC的分子遗传学研究进展[J].动物医学进展,2012,33(10):95-99.
[14] Ando A,Kawata H,Murakami T,et al.cDNA cloning and genetic polymorphism of the swine major histocompatibility complex (SLA) class II DMA gene [J].Anim Genet,2001,32(2):73-77.
[15] Lunney J K,Ho C S,Wysocki M,et al.Molecular genetics of the swine major histocompatibility complex,the SLA complex [J].Dev Comp Immunol,2009,33(3):362-374.
[16] O’Brien P M,Campo M S.Evasion of host immunity directed by papillomavirus-encoded proteins [J].Virus Res,2002,88(1-2):103-17.
[17] 邹婷婷,张智洁,杨 松,等.流感病毒感染小鼠肺巨噬细胞Dll1和MHC-Ⅰ表达研究.中国感染控制杂志[J],2014,13(8):449-453.
[18] 李国勤,卢立志,王得前,等.鸡MHC 基因多态性与抗病性状的相关性研究进展[J].农业生物技术学报,2006,14(1):122-127.
[19] Bao W B,Ye L,Pan Z Y,et al.Microarray analysis of differential gene expression in sensitive and resistant pig toEscherichiacoliF18 [J].Animal Genetics,2012,43(5):525-534.
[20] Yang Q L,Zhao S G,Wang D W,et al.Association between genetic polymorphism in the swine leukocyte antigen-DRA gene and piglet diarrhea in three chinese pig breeds [J].Asian-Austral J Animal Sci,2014,27(9):1228-1235.

