基于APSIM的胡麻光合生产与干物质积累模拟模型
李玥,武凌,高珍妮,牛俊义
(1.甘肃农业大学信息科学技术学院,甘肃 兰州 730070;2.兰州交通大学现代信息技术与教育中心,甘肃 兰州 730070;3.甘肃农业大学农学院,甘肃 兰州 730070)
植物在光合作用中吸收二氧化碳的能力称为光合速率,光合速率越高,植物在光合作用中吸收的二氧化碳越多,制造的碳水化合物就越多,产量越高。因而植物的光合作用对其产量形成至关重要。光合作用模型是作物干物质分配与产量形成模型的基础,是作物生长模型的核心。国内外学者对作物光合作用和干物质积累模型已做了大量研究。1965年de Wit(荷兰)[1]、Duncan(美国)等[2]发表的叶片冠层、植物群体光合作用模型,标志着作物模拟技术的问世。此后,作物光合生产模型研究在国内外得到迅速发展:20世纪80年代,荷兰的SUCROS模型[3],Penning de Vries建立的MACROS[4]以及ORYZA系列模型[5-6],采用光反应曲线模拟单叶光合速率,采用高斯积分法计算冠层每日光合同化量,具有较强的机理性。美国的CERES系列模型[7-8]建立了每日光合同化量与光合有效辐射之间的经验方程。GOSSYM模型[9]建立了棉花(Gossypiumhirsutum)群体冠层光合生产量及呼吸量与日辐射和温度的关系方程。这些模型由于结构复杂、参数众多,忽视了将作物生长模拟与栽培优化原理相结合,对应用于生产管理考虑较少。在国内,大多数学者借鉴了国外模型有关光合作用的部分内容和方法,刘铁梅[10]、张立祯等[11]、朱玉洁等[12]、薛林[13]、张亚杰[14]、邹薇[15]大多将冠层分为3或5层模拟冠层光分布,采用Lambert定律负指数方程或光响应曲线模拟单叶光合作用,采用高斯积分法(邹薇[15]采用复化辛普森积分法)计算每层光合量而得出每日的冠层总同化量,考虑了环境因子对光合速率的影响、呼吸作用消耗同化量,构建了小麦(Triticumaestivum)、紫花苜蓿(Medicagosativa)、芝麻(Sesamumindicum)、油菜(Brassicacampestris)以及大麦(Hordeumvulgare)等作物的干物质积累模拟模型。CERES-Rape[16-17]、LINTUL-BRASNAP[18-19]和APSIM-Canola[20-21]等油菜模型,对光合作用和冠层中光辐射模拟采用辐射利用率(radiation use efficiency,RUE)来计算生物量的累积。然而,在众多的国内外光合作用的模型研究中,胡麻(Linumusitatissimum)作物光合作用模型研究尚鲜见报道。本研究在已有作物光合作用和干物质积累模型基础上,采用辐射利用率,考虑环境因子对光合速率的影响以及呼吸作用消耗同化量,构建基于生理生态过程的胡麻光合生产与干物质积累模拟模型,为进一步构建胡麻生长模型奠定基础,为应用模型分析胡麻生长及制定生产决策提供科学依据。
1 材料与方法
1.1 研究区域概况
定西地区(E 104°37′12″,N 35°34′48″)地处黄河中游黄土高原沟壑区,海拔1793 m,年均气温7 ℃,年日照时数2500 h,无霜期146 d,年降水量300~400 mm,年均蒸发量1524.8 mm;榆中地区(E 103°49′15″-104°34′40″,N 35°34′20″-36°26′20″)地处黄河中游黄土高原沟壑区,海拔1793 m,年均气温6.7 ℃,≥10 ℃年积温2350 ℃,年日照时数2563 h,无霜期146 d,年降水量300~400 mm,年均蒸发量1341 mm,年辐射量1310 MJ·m-2。土壤理化性状见表1。
1.2 试验设计
1.2.1肥料单因素试验 试验于2012-2015年在甘肃省定西市西巩驿镇进行。试验区属旱地。试验为肥料单因素随机区组设计:不施肥作对照(CK)、油渣分别设600 (Y1)、900 (Y2)、1200 kg·hm-2(Y3)3个水平;磷酸二铵分别设90 (R1)、180 (R2)、270 kg·hm-2(R3)3个水平;复合肥分别设150 (F1)、300 (F2)、450 kg·hm-2(F3)3个水平,共10个处理,每个处理3次重复,供试胡麻品种选用定亚22号。播种密度750 万株·hm-2。
1.2.2播种方式单因素试验 试验为播种方式单因素随机区组设计:残膜直播(T1);残膜覆至春天,播种前揭残膜,覆盖新膜播种(T2);残膜覆至春天,播种前揭残膜后直接播种(T3)。各小区氮、磷、钾施肥量均分别为112.5 kg N·hm-2、75 kg P2O5·hm-2、52.5 kg K2O·hm-2;氮、磷、钾肥品种分别为尿素、过磷酸钙和硫酸钾。磷、钾肥均作为基肥施用;氮肥的2/3作为基肥,1/3作为追肥于现蕾前追施。供试胡麻品种选用陇亚10号。
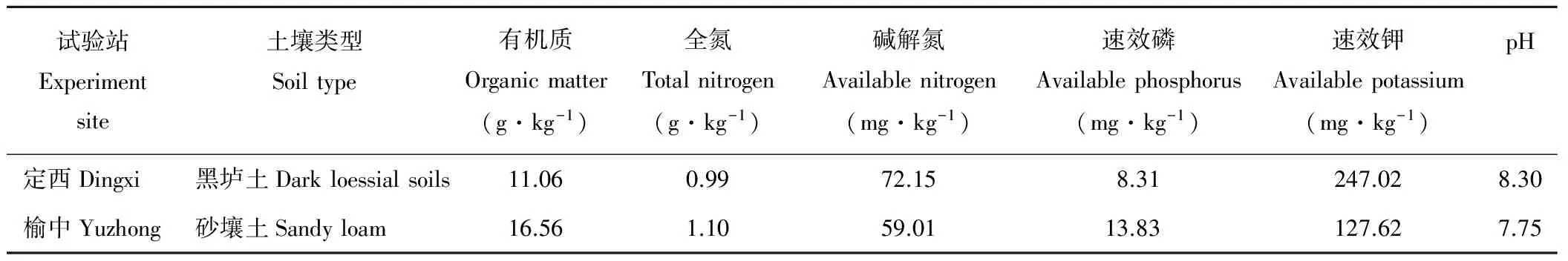
表1 定西和榆中试验站土壤理化性状Table 1 Basic physical-chemical properties of Dingxi and Yuzhong experiment site
1.2.3种植密度单因素试验 试验为种植密度单因素随机区组设计,设7个处理,3次重复:3.0×106(D1)、4.5×106(D2)、6.0×106(D3)、7.5×106(D4)、9.0×106(D5)、10.5×106(D6)、12.0×106(D7) 粒·hm-2。供试胡麻品种选用陇亚10号。
1.2.4氮磷二因素试验 试验于2012-2015年在甘肃省兰州市榆中县育种繁殖场进行。试验区属水地。试验因素为氮和磷,采用二因素随机区组设计。氮设3个水平:0 (N0),75 (N1),150 kg N·hm-2(N2);磷设4个水平:0 (P0),75 (P1),150 (P2),225 kg P2O5·hm-2(P3)。共12个处理,每处理重复3次。各小区均施钾肥52.5 kg K2O·hm-2,作为基肥施用。各小区灌溉定额均为2.7×103m3·hm-2(分茎期灌1.2×103m3·hm-2,现蕾期灌1.5×103m3·hm-2),供试胡麻品种选用陇亚杂1号,种植密度为900 万株·hm-2。
1.3 数据测定
1.3.1土壤理化性状的测定 土壤铵态氮、硝态氮采用比色法进行测定[22];土壤有机质采用重铬酸钾容量法进行测定[23];土壤含水率采用烘干法进行测定[24];土壤容重采用环刀法进行测定[25];土壤水分特征曲线采用张力计法测定[26]。
1.3.2胡麻物候期的测定 胡麻物候期采用人工记录法进行观察,参考胡麻生育期标准[27]进行记录:苗期——子叶露出土壤表面;枞形期——当株高5 cm左右时,植株上部聚生着3对以上真叶;现蕾期——主茎顶部出现密集的花芽;开花期——主茎花序上有花朵开放;籽实期——植株的主要颜色是黄青色,成熟的种子占1/3~1/2,部分叶子掉落;成熟期——上部蒴果开始变硬,植株的主要颜色呈暗黄色至淡棕色,全部叶子枯萎。
1.3.3胡麻叶面积与干物质量的测定 叶面积采用WDY-500A叶面积仪进行测定,于胡麻生长期内采用人工连续观测,用非水溶笔在株身上标记叶龄基本一致的植株,每隔10 d选取10株进行测定;干物质量采用称重法分别测定茎、叶和蒴果的干物质量,于各生育期按小区(重复3次)采样叶龄基本一致的植株10株作为样品,烘箱内105 ℃杀青15 min后在85 ℃烘6~8 h至恒重,称重测定叶片干重。干物质积累量采用改良半叶法测定[28]。
1.3.4胡麻产量及其主要农艺性状的测定 成熟期按小区进行实产测定,采用常规计算称重方法测定产量及单位面积蒴果数、每果粒数和粒重3个主要农艺性状。
1.4 模型的构建
胡麻光合生产与干物质积累模型是胡麻生长发育模型APSIM-Oilseed flax的子模型。APSIM模型通过嵌入气候模块、土壤模块、作物模块和管理模块,采用VB.NET建模语言动态模拟胡麻光合作用模型。模型输入参数包括气象参数、土壤参数、作物参数与品种遗传参数等,输出数据为日生物累积量,即地上部干物质量,受辐射截获与土壤水分亏缺的限制[29]。
1.4.1潜在生物累积量 潜在生物累积量由截获的辐射量(I),辐射利用率(RUE),散射因子(fd),胁迫因子(fs)和二氧化碳因子(fc)计算得到:
ΔQr=I×RUE×fd×fs×fc
(1)
I=I0[1-exp(-k×LAI×fh)/fh]
(2)
k=he(Wr)
(3)
式中:ΔQr为辐射截获干物质积累量;I为截获辐射量,由LAI(叶面积指数)和消光系数(k)计算得到;I0为冠层顶端总辐射(MJ),由气象数据获得;fh为光截获调整的跳行,由冠层宽度计算,此处取1;消光系数(k)随行距的变化而变化;Wr是行距;he是一个关于行距的函数,用于定义绿色叶片与枯萎叶片。此处,绿色叶片的消光系数取0.5,枯萎叶片的消光系数取0.3[29]。RUE辐射利用率(g·MJ-1),是一个关于生长发育期的函数。
(1)散射因子fd即日散射部分,利用Roderick[30]方程计算。
(4)
X0=0.26,Y0=0.96,Y1=0.05,X1=0.80-0.0017|φ|+0.000044|φ|2
(5)
(6)
ω0=arccos[-tan(φ)tan(θ)]
(7)
(8)
式中:Ro为每日额外地面太阳辐射(大气顶端);Rd和Rs分别为地面日散射和太阳辐射量;X0、X1、Y0、Y1为4个经验参数;A0=Y1-A1X1,A1=(Y1-Y0)/(X1-X0);φ为纬度;ω为太阳时角,ω0为日出日落时间,根据当地日出日落时间由太阳赤纬θ与纬度φ计算;N为一年天数;散射因子fd由方程的散射部分Rd/Rs计算得出,此处fd=1。
(2)胁迫因子fs,实际日辐射截获生物积累量受胁迫因子限制,fs取温度因子ft、氮因子fn、磷因子fp和氧气因子fo的最小值,即:
fs=min(ft,fn,fp,fo)
(9)
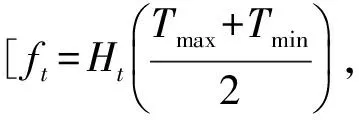
(3)二氧化碳因子fc,计算如下[31]。
(10)
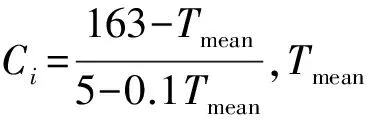
1.4.2实际日生物累积量 实际日生物累积量ΔQ的计算如下。
(11)
式中:fw是影响光合作用的水分胁迫因子;Wu是根系统实际日水分吸收量(即土壤水分供应量Ws);Wd是叶片与植株顶端土壤水分需求量;ΔQr为辐射截获干物质积累量;ΔQw为土壤水分供应干物质积累量。
当土壤水分不受限,即fw=1,Wd≥Ws,生物积累量受辐射控制,ΔQ=ΔQr;当土壤水分受限,生物积累量由水分供应量控制,ΔQ=ΔQw。
水分需求量即当土壤水分受限,作物用于蒸腾的水分总量,由潜在生物积累量ΔQr计算,根据Sinclair[32]的方法,蒸腾需求量计算如下。
(12)
R=RG+RM
(13)
RG=Rg×ΔQr
(14)
(15)
RM(T0)=0.015Wr+0.010Wp+0.030Wl+0.030Ws
(16)
(17)
(18)
式中:R是日呼吸作用消耗量,McCree[33]将植物呼吸作用分为两个部分:生长呼吸与维持呼吸,RG是日生长呼吸消耗量,是光合产物转化为植物组织结构物质时造成的消耗量;RM(kg CO2·hm-2·d-1)为日维持呼吸消耗量,是植物体为了维持其生理生化状态,不断利用能量产生的消耗,与植株各器官的干物质重有关,且对温度敏感。Rg为生长呼吸系数,取0.3[34];T0为呼吸作用的标准参照温度,取25 ℃;Tmean为日均温;RM(T0)为标准参照温度25 ℃下的日维持呼吸消耗量;Q10为维持呼吸的温度系数,取2.0[34];Wr、Ws、Wl、Wp(kg DM·hm-2)分别为胡麻根、茎、绿色叶片和蒴果的干物质重,0.015、0.010、0.030、0.030依次为根、蒴果、叶和茎的维持呼吸系数[34],单位为kg CO2·kg-1DM·d-1[14,33]。TE是蒸腾效率,fc是CO2因子,当CO2浓度从7.95×10-6mol·L-1增加到15.91×10-6mol·L-1时,fc从1到1.37线性增长;fTE是蒸腾效率系数,为不同生长阶段的线性插值;VPD为蒸汽压差,采用Tanner等[35]提出的方法,利用日最高温Tmax和最低温Tmin计算[式(18)],式中:fv为春化因子,缺省值取75%。
日生物积累量ΔQ即地上部干物质量,受辐射截获干物质积累量ΔQr或土壤水分供应干物质积累量ΔQw限制,所以,日生物积累量的计算方程如下。
(19)
1.4.3光合速率计算方法 利用定西试验站不同肥料、不同播种方式和不同种植密度,榆中试验站不同氮磷处理水平2012-2013年的测定数据构建模型。光合速率是单位时间、单位叶面积CO2吸收量或O2释放量,也可用单位时间、单位叶面积上的干物质积累量来表示。
每天日生物累积量做两次计算,一次由蒸发可用水分限制[干物质蒸发量(DDT)=土壤水分(SWS)×蒸腾效率(TE),注:蒸腾效率来自蒸腾作用效率系数TEC和蒸气压差VPD,由每日气温估算];一次被辐射能限制[潜在干物质量(DDP)=辐射利用率(RUE)×辐射截获(Ri),注:RUE辐射利用效率包含气温、氧气亏缺(水涝)和氮亏缺,RUE的值不受气温限制,当气温超出第一、第二适宜温度范围之外,在基温与最大温度时,RUE减小为0,RUE是生长发育阶段的线性插值],这两次估计值的最小值即为当日的实际生物量产量。
1.5 数据分析
采用SPSS 22.0统计分析软件进行数据整理和分析。
1.6 模型的检验
根据2014-2015年4个试验测量数据对模型进行检验,检验方法使用国内外通用的统计指标[36]均方根误差(RMSE)和决定系数(R2),RMSE越小、R2越接近1,模型测量值与预测值间误差越小,拟合效果越好。
2 结果与分析
2.1 参数校正
APSIM已建立的作物模型有鹰嘴豆(Cicerarietinum)、绿豆(Vignaradiata)、大豆(Glycinemax)、柱花草(Stylosanthesspp.)、花生(Arachishypogaea)、蚕豆(Viciafaba)、紫花苜蓿、加拿大油菜、小麦等。本研究通过借鉴APSIM-canola加拿大油菜模型[37-38],根据胡麻生长发育的生理生态过程,确定影响胡麻光合生产的品种遗传参数。
位于北半球的研究区与位于南半球的澳洲大陆相比,地理位置、环境基质、气候格局、土壤特征均有显著差异,所以模型在进行模拟前,需要进行大量试验和科学的方法对模型参数进行校准和反复调整。模型至少需要两年的试验数据[36]。研究中利用2012-2013年的大田试验数据对模型进行参数校准,以使实测值与模拟值间的差值尽可能小。运用本地化的APSIM模型参数模拟胡麻生长,并以2014-2015年的大田试验对该模型进行验证。参数校正过程:首先调查收集研究区作物性状介绍与试验资料,作为估计作物品种资料遗传参数的基本依据;其次,输入APSIM输入数据(气象、土壤、作物等参数),通过调整表2参数使得APSIM的模拟结果与实际测量的生物量、产量等输出参数基本相等。由于实际测量中,APSIM的39个输入数据无法全部获取,而且由于获取方法等的限制使得模型输入存在一定误差,所以调参是一个反复繁杂的过程,并不能满足实测值与模拟值完全相等,只能尽量缩小差值。为了减少调参过程的复杂性,采用基于神经网络的投影寻踪自回归BPPPAR(projection pursuit auto-regression based on error back propagation)模型[39],用RAGA(real coded accelerating genetic algorithm)优化投影指标函数[39],通过计算机编程实现该BPPPAR模型,进行遗传特性品种参数调整(表2)。
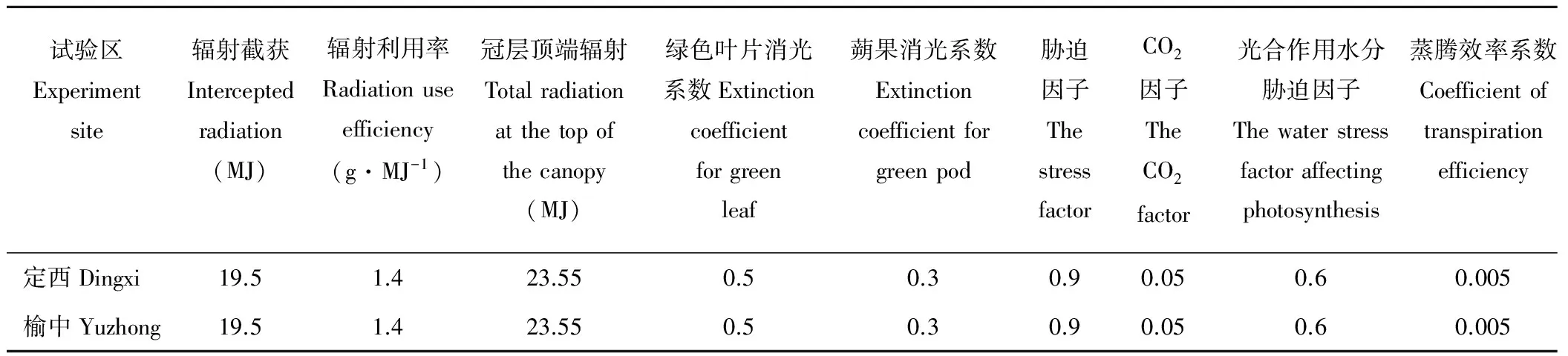
表2 胡麻光合生产与干物质积累模型参数Table 2 Cultivar parameters of oilseed flax photosynthetic production and dry matter accumulation model
2.2 模型检验
利用定西试验站不同肥料、不同播种方式和不同种植密度,榆中试验站不同氮磷处理水平2014-2015年的测定数据对模型进行检验。采用RMSE对模拟值和测定值之间的拟合度进行统计分析,采用决定系数R2反映模拟值与实际值的相关程度。运行模型得出生物累积量模拟结果,见表3。
2.2.1不同肥料胡麻光合生产与干物质积累模型检验 分别对试验Ⅰ中10种肥料的干物质累积量进行模型检验,干物质积累模拟值的RMSE值为0.3486~1.9538 g·株-1,平均为1.0467 g·株-1,表明模拟值与测量值之间误差较小;模拟值与测量值回归分析所得y=x的线性回归方程决定系数R2取值范围在0.6311~0.9832,平均为0.8532,表明模型对不同肥料胡麻光合生产与干物质积累的模拟效果较好。
2.2.2不同播种方式胡麻光合生产与干物质积累模型检验 分别对试验Ⅱ中3种播种方式的干物质累积量进行模型检验,干物质积累模拟值的RMSE值为0.5685~1.1164 g·株-1,平均为0.8692 g·株-1,表明模拟值与测量值之间误差较小;y=x的线性回归方程的决定系数R2取值范围在0.8745~0.9662,平均为0.9282,表明模型对不同播种方式胡麻光合生产与干物质积累的模拟效果较好。
2.2.3不同种植密度胡麻光合生产与干物质积累模型检验 分别对验Ⅲ中7种种植密度的干物质累积量进行模型检验。干物质积累模拟值的RMSE值为0.0807~0.2086 g·株-1,平均为0.1584 g·株-1,表明模拟值与测量值之间误差较小;y=x的线性回归方程的决定系数R2取值范围在0.9677~0.9965,平均为0.9869,表明模型对不同种植密度胡麻光合生产与干物质积累的模拟效果很好。
2.2.4不同氮磷水平胡麻光合生产与干物质积累模型检验 分别对试验Ⅳ中12种氮磷水平的干物质累积量进行模型检验。干物质积累模拟值的RMSE值为0.0952~1.2375 g·株-1,平均为0.4000 g·株-1,y=x的线性回归方程的决定系数R2取值范围在0.8964~0.9959,平均为0.9700,表明模型对不同氮磷水平胡麻光合生产与干物质积累的模拟效果很好。
3 讨论
作物群体干物质积累是产量形成的基础,光合生产是干物质积累的核心[13]。作物生产的动态模拟就是从荷兰de Wit[1]和美国Duncan等[2]的光合作用模型开始。以往作物的光合作用模型多采用分层结构,即冠层光合作用的模拟一般分三步进行。第一步:计算出冠层每一分层的瞬时光合作用速率;第二步,利用高斯积分法对冠层每个分层上的瞬时光合作用速率进行加权求和,得到整个冠层的瞬时光合作用速率;第三步,对每日所观测的3个时间点观察的瞬时光合作用速率进行加权求和,得到整个冠层每日的光合作用速率[10-15]。根据胡麻冠层的生态结构特点,如果采用分层结构模型将胡麻花层、蒴果层和叶层分3层计算胡麻冠层的光能截获和光合作用,其花层面积指数难以准确测定和模拟,并且在叶层无法考虑长柄叶、短柄叶和无柄叶的光合速率差异,势必引起模拟的误差。本研究采用的辐射利用率综合考虑胡麻生长特点,不仅考虑了影响胡麻光合速率的内部因素,包括叶片的发育和结构、光合产物的输出;还考虑了影响胡麻生长的外部因素,包含光照强度、光质、光照时间、CO2、温度、水分、矿质营养以及光合速率的日变化,并根据这些因素确定胡麻光合作用模型参数。基于不同肥料、播种方式、种植密度及氮磷水平的独立试验数据检验胡麻光合生产模型,结果表明模型模拟值与测定值拟合性好,具有较好的模拟效果。
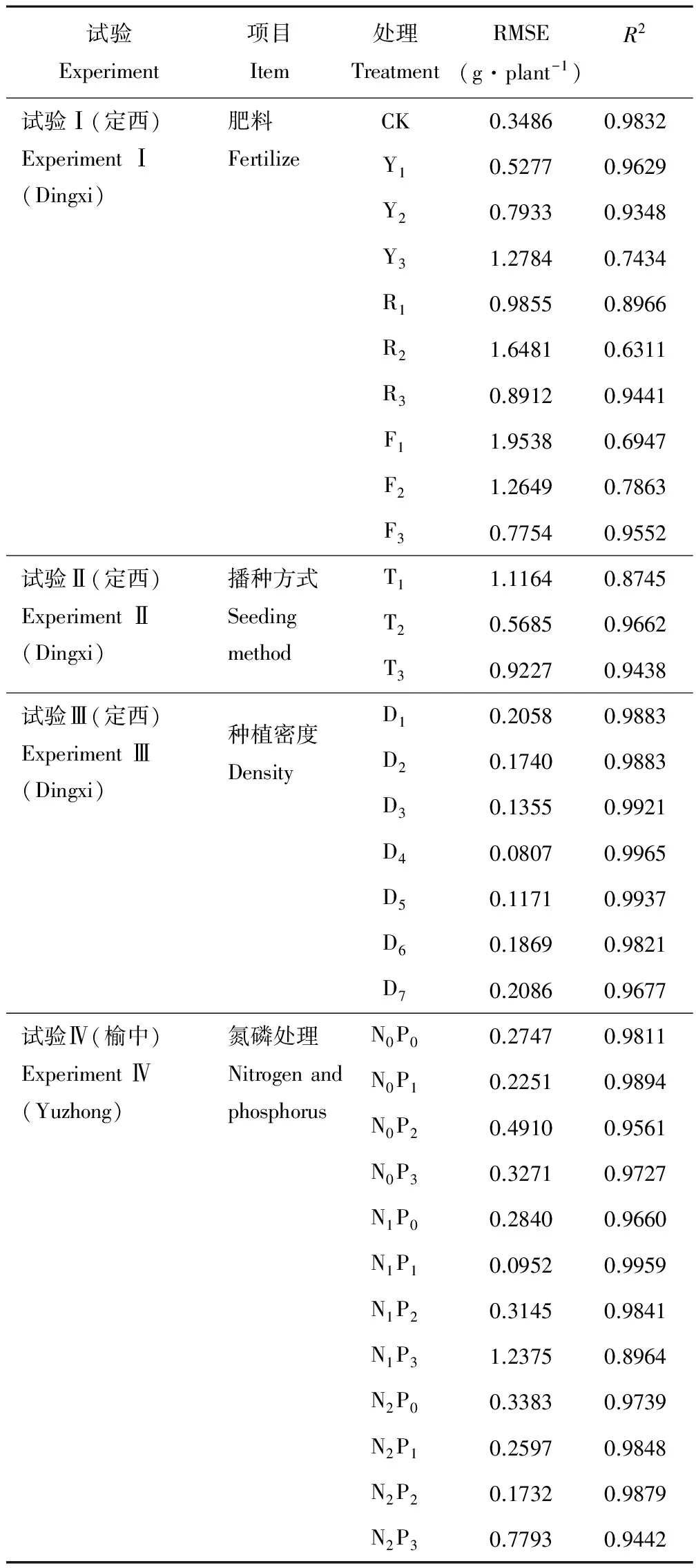
表3 胡麻光合生产与干物质积累模型模拟结果Table 3 Simulation results of oilseed flax photosynthetic production and dry matter accumulation model
注:置信度99.9%。
Note: Confidence level is 99.9%.
为了拟合胡麻的生长特点,本模型每日的实际生物量值由辐射截获和蒸腾量共同计算得到。将胡麻辐射截获所生成生物量称为胡麻的潜在生物量,在建模过程中考虑了辐射利用率、叶片叶面积指数、消光系数、播种行距对胡麻光合速率的影响,同时也加入了散射因子、胁迫因子(包括温度胁迫、氮胁迫、磷胁迫和氧气胁迫)和二氧化碳因子对胡麻光合生产的共同影响进行建模;而胡麻的实际日生物量则是在潜在值的基础上把水分蒸腾量的作用计算在内,同时还要除去作物用于维持呼吸与生长呼吸的消耗量,本研究中胡麻的根、蒴果、茎和叶的维持呼吸系数依次取0.015、0.010、0.030、0.030 kg CO2·kg-1DM·d-1,因而,本模型中的每个系数均具有一定生物学意义,解释性强,能更准确地描述胡麻对光合作用的反应机理,从而使本研究所建模型较以往模型更具普适性。
与以往的作物模型[10-17]调试参数方法相比,本研究采用基于神经网络的投影寻踪自回归BPPPAR-RAGA方法[39],通过编程实现调整品种遗传特性参数,克服以往试错法误差大、主观性强的弊端,使参数确定更精确。
作物生长发育模型的构建和推广应用需大量试验数据作支撑,而本研究中由于各种原因限制,使试验样本容量受限,尤其试验只限于几个地区,从而使模型在其他胡麻主产区的推广应用受到限制,今后需不断通过大量的试验及相关数据进一步检验模型。同时,由于每种作物品种的遗传参数有差异,致使各品种的最终产量均有不同程度的差异,加上播种地区环境因素的不同,使模型的适用性受到不同程度的影响,今后将进一步细化工作,尽量针对每一种品种调试模型,使模型参数更精确。另外,本研究与水分驱动模型AquaCrop模拟胡麻生物量[36]相比,AquaCrop需要输入参数较少(共33个),界面更简单,模拟过程更容易,而APSIM需要的输入参数较多,模拟过程更复杂,但是模拟精度也较高,所以对于两种模型仅比较RMSE的平均值和决定系数R2的范围还不够,今后将进一步研究两种模型数据源大致相同情况下的对比。无论是APSIM模型还是AquaCrop模型,得出的模拟值和实测值还存在一定的差距,所以,今后还应该探索更为精确的模拟方法,以构建更完善的胡麻生长模型。
4 结论
本研究参考APSIM对油菜[21,37-38]、小麦[40-43]等其他作物的模拟研究,综合胡麻生长自身特点及充分考虑影响光合速率的内部因素和外部因素,建立了基于生理生态过程的胡麻光合生产与干物质积累模拟模型,为干物质分配与产量形成模型奠定基础。本研究对胡麻光合作用生物量积累采用辐射利用率(RUE)求得,充分考虑影响光合速率的内部因素和外部因素,采用绿色叶片光合作用、绿色蒴果光合作用、辐射截获潜在生物量与水分蒸腾量共同作用的方法构建胡麻光合作用和干物质积累模型,通过不同肥料、播种方式、种植密度及氮磷水平的初步检验,模型具有较好的模拟效果和较强的适用性。所以本模型采用辐射利用率(RUE)计算胡麻光合生产与干物质积累,具有更好的科学性和实用性,为干物质分配与产量形成模型提供更准确的参数。
References:
[1] de Wit C T. Photosynthesis of leaf canopies//Agricultural research report No. 663. Wageningen, The Netherlands: Pudoc, 1965: 663-671.
[2] Duncan W G, Loomis R S, Williams W A,etal. A model for simulating photosynthesis in plant communities. Hilgardia, 1967, 38: 181-205.
[3] van Keulen H, Penning de Vries F W T, Drees E M. A summary model for crop growth//Penning de Vries F W T, van Laar H H. Simulation of crop growth and crop production. Wageningen, The Netherlands: Pudoc, 1982: 87-97.
[4] Penning de Vries F W T, Jansen D M, Ten Berge H F M. Simulation of ecophysiological process of growth in several annual crops. Wageningen, The Netherlands: Simulation Monographs, Pudoc, 1989: 271.
[5] Kropff M J, van Laar H H, Mathews,etal. ORYZAI: An eco-physiological model for irrigated rice production. Wageningen, The Netherlands: Pudoc, 1994: 35-40.
[6] Bouman B A M, Kropff M J, Tuong T P,etal. ORYZA2000: Modeling lowland rice. Wageningen, The Netherlands: Pudoc, 2000: 50-90.
[7] Jones C A, Kiniry J R. CERES-Maize: A simulation model of maize growth and development. College Station, United States: Texas A & M University Press, 1986: 89-110.
[8] Ritchie J T, Otter S. Description and performance of CERES-Wheat: a user-oriented wheat yield model. ARS Wheat Yield Project, 1985, 38: 159-175.
[9] Marcelis L F M, Heuvelink E, Goudriaan J. Modelling biomass production and yield of horticultural crops: a review. Scientia Horticulturea, 1998, 74: 83-111.
[10] Liu T M. Simulation on photosynthetic production and dry matter partitioning in wheat. Nanjing: Nanjing Agricultural University, 2000.
刘铁梅. 小麦光合生产与物质分配的模拟模型. 南京: 南京农业大学, 2000.
[11] Zhang L Z, Cao W X, Zhang S P,etal. A process model of photosynthetic production and dry matter accumulation in cotton. Cotton Science, 2003, 15(3): 138-145.
张立祯, 曹卫星, 张思平, 等. 棉花光合生产与干物质积累过程的模拟. 棉花学报, 2003, 15(3): 138-145.
[12] Zhu Y J, Feng L P, Yi P,etal. A dynamic model simulating photosynthetic production and dry matter accumulation for alfalfa (MedicagosativaL.). Acta Agronomical Sinica, 2007, 33(10): 1682-1687.
朱玉洁, 冯利平, 易鹏, 等. 紫花苜蓿光合生产与干物质积累模拟模型研究. 作物学报, 2007, 33(10): 1682-1687.
[13] Xue L. Study of development simulation models in sesame. Nanjing: Nanjing Agricultural University, 2012.
薛林. 芝麻生长发育模拟模型研究. 南京: 南京农业大学, 2012.
[14] Zhang Y J. Study on direct-seeding rapeseed growth simulation model. Wuhan: Huazhong Agricultural University, 2013.
张亚杰. 直播油菜生长模拟模型的研究. 武汉: 华中农业大学, 2013.
[15] Zou W. A process-based simulation model on barley growth and development. Nanjing: Nanjing Agricultural University, 2009.
邹薇. 基于过程的大麦生长发育模拟模型. 南京: 南京农业大学, 2009.
[16] Gabrielle B, Denoroy P, Gosse G,etal. Development and evaluation of a CERES-type model for winter oilseed rape. Field Crops Research, 1998, 57(1): 95-111.
[17] Tang L, Zhu Y, Ju C H,etal. Dynamic simulation on shoot dry matter partitioning and yield formation of rapeseed. Chinese Journal of Applied Ecology, 2007, 18(3): 526-530.
汤亮, 朱艳, 鞠昌华, 等. 油菜地上部干物质分配与产量形成模拟模型. 应用生态学报, 2007, 18(3): 526-530.
[18] Habekotte B. A model of the phonological development of winter oilseed rape (BrassicanapusL.). Field Crops Research, 1997, 54: 127-136.
[19] Habekotte B. Description, parameterization and user guide of LINTUL-BRASNAP 1.1. A crop growth model of winter oilseed rape (BrassicanapusL.). Wageningen, The Netherlands: Quant Appr (Annual Participatory Programme Review) System Annual, 1997.
[20] Keating B A, Carberry P S, Hammer G L,etal. An overview of APSIM, a model designed for farming systems simulation. European Journal of Agronomy, 2003, 18(3): 267-288.
[21] Robertson M J, Holland J F, Kirkegaard J,etal. Simulating growth and development of canola in Australia. Canberra: Proceedings of the 10th International Rapeseed Congress, 1999.
[22] GB/T 32737-2016, Determination of nitrogen in soil-ultraviolet spectrophotometry method. Beijing: China Standard Press, 2016.
GB/T 32737-2016, 土壤硝态氮的测定-紫外分光光度法. 北京: 中国标准出版社, 2016.
[23] Qian B, Liu L, Xiao X. Comparison and analysis of soil organic matter determination method. Journal of Hehai University (Natural Science Edition), 2011, (1): 36-38.
钱宝, 刘凌, 肖潇. 土壤有机质测定方法对比分析. 河海大学学报(自然科学版), 2011, (1): 36-38.
[24] Hua M, Wang J. Soil physics. Beijing: Beijing Agricultural University Press, 1993: 38.
华孟, 王坚. 土壤物理学. 北京: 北京农业大学出版社, 1993: 38.
[25] Laboratory of Soil Physics, Nanjing Soil Research Institute, Chinese Academy of Sciences. Determination of physical properties of soils. Beijing: Science Press, 1978: 10.
中国科学院南京土壤研究所土壤物理研究室. 土壤物理性质测定法. 北京: 科学出版社, 1978: 10.
[26] Gong Z P. Soil science and agriculture science. Beijing: China Water & Power Press, 2009.
龚振平. 土壤学与农作学. 北京: 中国水利水电出版社, 2009.
[27] Rural Water Resources Department of the Ministry of Water Resources. Classification and observation standard of main crops growth period. (2012-07-06) [2017-11-18]. http://www.docin.com/p-436365186.html.
水利部农村水利司. 主要作物生育时期划分及观测标准. (2012-07-06) [2017-11-18]. http://www.docin.com/p-436365186.html.
[28] Zong M, Wu G L, Zheng A F. Improvement of experiment on the plant photosynthetic intensity of the improved half-method. Modern Agricultural Science and Technology, 2011, 4: 30-33.
宗梅, 吴甘霖, 郑爱芳. 改良半叶法测定植物光合强度实验的改进. 现代农业科技, 2011, 4: 30-33.
[29] Commonwealth Scientific and Industrial Research Organisation. Agricultural production system simulator. (2014-03-25) [2015-11-01]. http://www.apsim.info.
[30] Roderick M L. Estimating the diffuse component from daily and monthly measurements of global radiation. Agricultural and Forest Meteorology, 1999, 95(3): 169-185.
[31] Reyenga P J, Howden S M, Meinke H,etal. Modelling global change impacts on wheat cropping in south-east Queensland, Australia. Environmental Modelling & Software, 1999, 14(4): 297-306.
[32] Sinclair T R. Water and nitrogen limitations in soybean grain production. I. Model development. Field Crops Research, 1986, 15(2): 125-141.
[33] McCree K. Equations for the rate of dark respiration of white clover and grain sorghum, as functions of dry weight, photosynthetic rate, and temperature. Crop Science, 1974, 14(4): 509-514.
[34] Goudriaan J, Van Laar H H. Modelling potential crop growth processes: Textbook with exercises. Dordrecht: Kluwer Academic Publishers, 1994: 175-195.
[35] Tanner C B, Endo T R. Efficient water use in crop production: research or re-search//Taylor H M, Jordan W R, Sinclair T R. Limitations to efficient water use in crop production. Madison Wisconsin: American Society of Agronomy, 1983: 1-27.
[36] Li Y, Niu J Y, Guo L Z,etal. Application and validation of AquaCrop model in simulating biomass and yield of oil flax in Northwest China. Chinese Journal of Eco-Agriculture, 2014, 22(1): 93-103.
李玥, 牛俊义, 郭丽琢, 等. AquaCrop模型在西北胡麻生物量及产量模拟中的应用和验证. 中国生态农业学报, 2014, 22(1): 93-103.
[37] Farré M J, Robertson G H, Walton S,etal. Simulating response of canola to sowing date in western Australia. Hobart, Tasmania: 10th Australian Agronomy Conference, 2000.
[38] Robertson M J, Holland J, Cawley S,etal. Phenology of canola cultivars in the northern region and implications for frost risk. Hobart, Tasmania: 10th Australian Agronomy Conference, 2001.
[39] Fu Q. Data processing methods and their agricultural applications. Beijing: Science Press, 2006.
付强. 数据处理方法及其农业应用. 北京: 科学出版社, 2006.
[40] Asseng S, Fillery I R P, Anderson G C,etal. Use of the APSIM wheat model to predict yield, drainage, and NO3-leaching for deep sand. Australian Journal of Experimental Agriculture, 1998, 49(3): 363-378.
[41] Asseng S, Foster I, Turner N C. The impact of temperature variability on wheat yields. Global Change Biology, 2011, 17(2): 997-1012.
[42] Asseng S, Keating B A, Fillery I R P,etal. Performance of the APSIM-wheat model in Western Australia. Field Crops Research, 1998, 57(2): 163-179.
[43] Hochman Z, Dang Y P, Schwenke G D,etal. Simulating the effects of saline and sodic subsoils on wheat crops growing on vertisols. Australian Journal of Agricultural Research, 2007, 58(8): 802-810.

