辉河湿地不同草甸植被群落特征及其与土壤因子的关系
罗琰,苏德荣*,纪宝明*,吕世海,韩立亮,李兴福
(1.北京林业大学草地资源与生态研究中心,北京 100083;2.中国环境科学研究院,北京 100012)
湿地植被和土壤作为承载湿地生态功能的主要基质和载体,相互之间进行着频繁的物质和能量交换[1-2]。湿地土壤为植物的生存繁殖提供必需的物质环境基础,影响植物的种类、数量、生长发育、形态和分布,不同类型湿地植物对土壤营养元素的选择性吸收和归还又会影响土壤养分的分布与变化[3-4]。湿地植被不仅能有效地吸收来自于湿地及其周围生态系统的营养元素,而且群落的生物多样性与土壤中营养物质的滞留呈显著相关关系[5-6]。在以芦苇(Phragmitesaustralis)为优势种的湿地生态系统中,芦苇对无机氮的吸收量达到66%以上[7]。在鄱阳湖南矶湿地,苔草群落对土壤元素的吸收和滞留能力最强,刚毛荸荠(Eleocharisvalleculosa)群落对土壤营养元素影响最弱[8]。在胶州湾盐沼湿地,芦苇群落全磷含量最低,互花米草(Spartinaalterniflora)群落全磷含量最高,而碱蓬(Suaedaglauca)群落速效磷含量最高[9]。湿地土壤养分的分布和变化除受植被群落的影响外,河流水文过程会使土壤结构发生复杂变化,影响湿地土壤中营养元素迁移转化过程,土壤异质性更为明显,导致湿地植被呈斑块分布、植物群落明显不同于周边高地栖息地,影响群落的结构和功能组成以及物种竞争和植被动态,甚至引起植物群落演替[10]。此外,湿地土壤亦对植被群落具有重要的反馈作用。在三江源河口湿地,土壤有机质和速效氮含量共同决定湿地植物的分布[11]。影响洪河国家自然保护区浓江河滨河湿地植被分布的主要土壤因子是土壤有机质、全氮和含水量[12]。对东洞庭湖苔草群落与环境因子的主成分分析表明,影响苔草群落生物量的关键因子依次为土壤有机碳含量、氮含量、含水量和土壤容重[13]。王晓龙等[14]对巢湖低丘山区典型湿地植被与土壤因子的研究表明,土壤养分状况与生物多样性指数和均匀度指数呈现良好的正相关关系。
辉河湿地是呼伦贝尔草原东部最大的一条带状湿地, 与黑龙江省扎龙、俄罗斯达乌尔斯克、蒙古国达乌尔湿地共同构成东北亚地区的草原湿地生态系统,是东北亚乃至全球的重要生态屏障及众多候鸟迁徙过境的驿站,对保护生物多样性的稳定具有不可替代的功能和价值。此外,辉河湿地生态系统地处干旱、半干旱地区,具有典型的半干旱草原气候特点,生态系统相对脆弱,抗外界的干扰和破坏能力较弱[15]。特别是近年来,由于自然和人为等原因,湿地面积逐年萎缩,湿地植被演替加剧,珍稀濒危鸟类栖息环境遭到破坏,生态环境呈恶化趋势。因此,保护和恢复北方干旱草原区辉河湿地生态系统十分重要。目前,有关辉河湿地的研究主要集中在植被多样性分布格局和生物多样性保护,湿地生态系统健康评价和景观格局变化等方面[16-20],有关辉河湿地植被特征、土壤特性以及二者间的相关性研究鲜有报道。本研究针对辉河湿地不同草甸下优势植物群落及土壤营养元素分布变化特征,探讨了他们之间的相互关系,以期为辉河湿地生态系统的管理、保护及可持续开发与利用提供一定的数据支撑。
1 材料与方法
1.1 研究区概况
辉河国家级自然保护区(48°10′-48°57′ N,118°48′-119°45′ E)地处内蒙古自治区呼伦贝尔高原,行政区上分属内蒙古自治区呼伦贝尔市鄂温克族自治旗、陈巴尔虎旗和新巴尔虎左旗。该区气候属于中温带大陆性季风气候,冬季漫长寒冷,夏季温润短促,年平均气温为-2.4~2.2 ℃,无霜期为100~120 d,年降水量为300~350 mm,约70%的降水集中在6-8月。该区处于大兴安岭山地森林向呼伦贝尔草原的过渡带和草甸草原向典型草原的过渡带,集森林、草原、湿地于一体,具有山地丘陵、高平原、沙地、河谷等多种类型组合的地貌,使保护区呈现为类型多样、独特、结构复杂的自然生态系统,地势由东南向西北倾斜,平均海拔为800~1000 m。地带性土壤类型为黑钙土和栗钙土,由于受区域内地貌、水文和地质的影响,发育有隐域性草甸沼泽土、盐化草甸土和风沙土等。
1.2 样品采集与测定
采样地位于辉河国家自然保护区核心区内,对5种典型植被群落类型湿地进行研究,于2016年7月在辉河木桥湿地(成熟草甸),查干山(沼泽草甸向草甸的过渡草甸),西博桥湿地(沼泽草甸,盐碱草甸),骆驼脖子观测站(湿地草甸)分别选取3块10 m×10 m样地,每块样地中再随机设置6个1 m×1 m的样方,记录每个样方的海拔、经纬度、坡度和坡向等。采取样方调查法,获取植物数据,记录典型植被群落优势种的种名、高度、盖度和数量等(表1),然后调查群落中出现的每种植物的种名、高度、盖度和密度,用于植物群落多样性计算。地上生物量采用收获法,样方内植物齐地面刈割,称鲜重后置于80 ℃烘箱中烘干24 h,然后称得干重得到地上生物量数据。在收获植物地上部分的样方内,用根钻法取得植物根系并带回实验室冲洗干净后,于65 ℃烘干至恒重,称量后计算单位面积内的地下生物量。同时在每个样方内,采用环刀法, 分别随机选取3个重复样点,用于土壤容重和土壤含水量的测定,在垂直方向上取0~20 cm深度的土样混合后放入塑料袋,带回实验室自然风干后去除杂物,过筛(0.15 mm),用于其他指标的测定。测定的土壤理化性质指标包括:容重(soil bulk density, SBD)、含水量(soil moisture content, MC)、全氮(total nitrogen, TN)、有机质(soil organic matter, SOM)、全磷(total phosphorus, TP)、铵态氮(available nitrogen, AN)和有效磷(available phosphorus, AP)。参照文献[21]中的方法,其中,土壤容重采用环刀法测定; 土壤含水率采用烘干法测定;TN 采用半微量凯氏定氮法;SOM 采用重铬酸钾滴定法; TP 采用硫酸—高氯酸消煮、钼锑抗比色法;AN 采用2 mol·L-1KCl 溶液浸提进行测定,用纳氏试剂比色法测定上清液中NH4+-N 含量;AP 用Olsen法测定。
1.3 植被群落多样性指数选择
选取Shannon-Wiener多样性指数、Simpson多样性指数和Pielou均匀度指数,分析群落物种多样性[22]。
1.4 数据处理
采用Excel 2010软件,进行数据整理。采用SPSS 17.0软件和Origin 19.0软件,进行统计处理和绘图。为反映土壤因子与植被群落间的关系, 利用Canoco for 4.5统计软件在对植被数据进行去趋势对应分析(DCA)计算排序轴梯度长度的基础上,采用冗余分析法(redundancy analysis, RDA), 对土壤指标与植物数据矩阵进行排序分析。
2 结果与分析
2.1 不同草甸植被群落生物学特征
植被群落生物学特征是种群的重要结构特征之一,能够反映环境对群落中物种的生存和生长的影响以及群落演替动态。由表2可知,5种草甸类型植被群落Shannon-Wiener 指数在0.70~2.08之间,其中,成熟草甸Shannon-Wiener指数显著高于其他草甸植被群落,盐碱草甸植被群落多样性最低。Simpson指数能够反映植物群落的丰富度和均匀度,5种草甸植被群落的Simpson指数变化为:盐碱草甸<沼泽草甸<过渡草甸<湿地草甸<成熟草甸。5种草甸植被群落的Pielou均匀度指数变化为:成熟草甸<盐碱草甸<湿地草甸<沼泽草甸<过渡草甸,过渡草甸植被群落优势植物为香蒲,作为挺水植物,高度显著高于其他草甸植被,此外成熟草甸和过渡草甸植被群落盖度显著高于其他草甸植被群落。按Alatalo[23]对变异系数的分级标准:CV<0.1属于弱变异性;CV=0.1~1.0属于中等变异性;CV>1属于强变异性。通过计算:5种草甸植被群落除沼泽草甸的Shannon-Wiener指数以及成熟草甸的Pielou均匀度指数,变异系数均<0.1,属于弱变异性,而沼泽草甸Shannon-Wiener指数变异系数为0.21,成熟草甸Pielou均匀度指数变异系数为0.19,均位于0.1~1.0,属于中等变异,表明沼泽草甸植被群落多样性以及成熟草甸植被群落分布与其他草甸相比,受到环境影响较大。但是,5种草甸的Simpson指数变异系数均<0.1,属于弱变异。
注:同列不同小写字母间差异显著(P<0.05),下同。
Note:Different small letters in the same column indicate significant difference (P<0.05). CV:Coefficient of variation. The same below.
沼泽草甸地上和地下生物量均显著高于其他草甸,盐碱草甸则是地上和地下生物量均显著低于其他草甸(图1)。
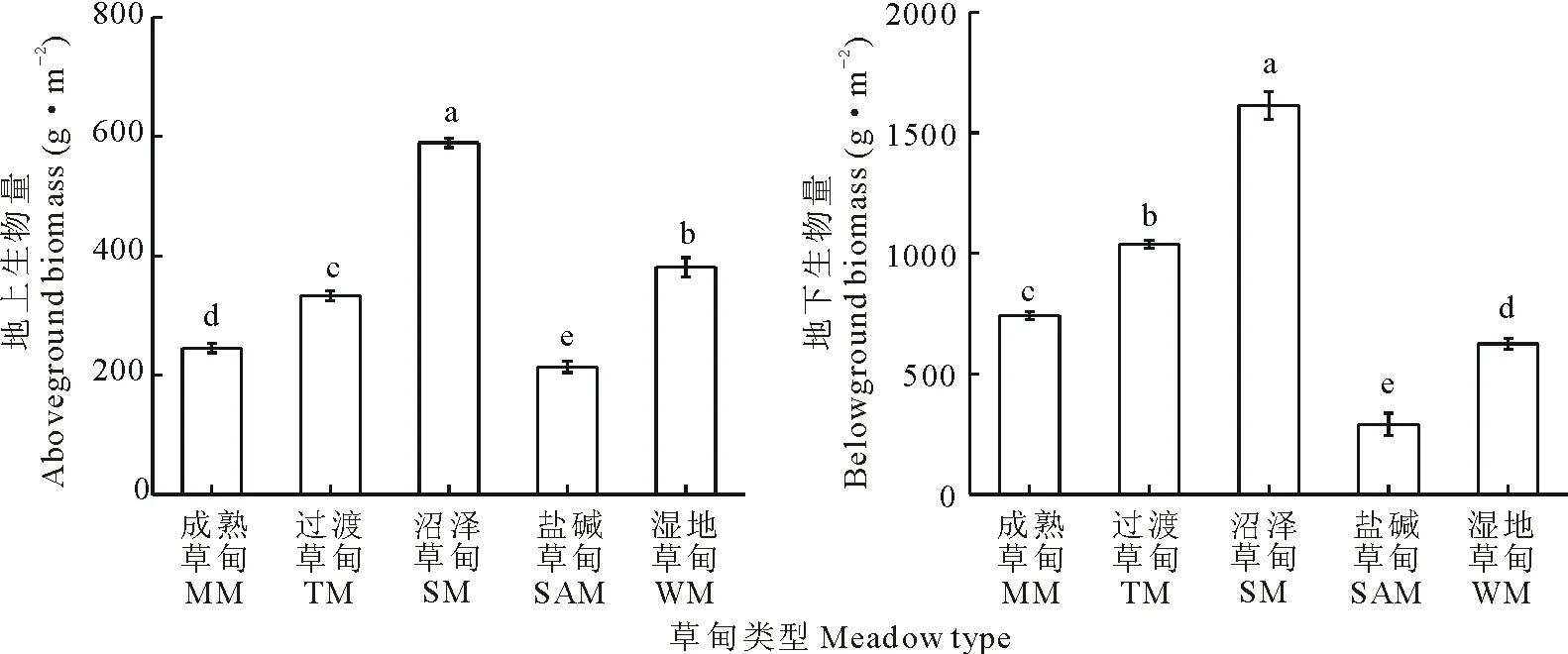
图1 辉河湿地不同草甸植被地上及地下生物量Fig.1 Above and underground plant biomass of different meadows in Huihe wetland 不同小写字母间差异显著(P<0.05)。Different small letters indicate significant difference (P<0.05).
2.2 不同草甸土壤养分含量特征
过渡草甸土壤全氮、有机质、全磷含量均显著高于其他草甸土壤(表3),且全氮、全磷和铵态氮的变异系数>0.1,属于中度变异,表明与其他4种草甸土壤相比,过渡草甸因土壤水淹状况减弱,通气性增强,其土壤全氮、全磷和铵态氮含量变化较为明显;此外,盐碱草甸土壤有效磷含量在5种草甸土壤中最高,过渡草甸土壤有效磷含量为23.98 mg·kg-1,虽然低于盐碱草甸,但是却显著高于成熟草甸、沼泽草甸和湿地草甸。沼泽草甸土壤铵态氮含量也显著高于成熟草甸、盐碱草甸和湿地草甸,但变异系数为0.05,小于其他草甸,属于弱变异。

表3 辉河湿地不同草甸土壤养分特征Table 3 Characteristics of soil nutrients in different meadows in Huihe wetland
2.3 不同草甸植被群落与土壤因子的关系
2.3.1植被群落特征与土壤因子的相关性分析 植被组成和生长是生物与环境因子(含水量、土壤物理性质和养分)共同作用的结果。相关分析显示,植被群落多样性分布与土壤特征有关,群落Shannon-Wiener指数与土壤含水量呈显著正相关,与土壤有效磷呈极显著负相关(表4)。土壤养分作为植被生长要素对植被有一定影响,从表4可以看出,土壤有机质、全氮和铵态氮与植被高度均呈极显著正相关,说明土壤有机质和土壤氮素能够影响优势种的高度。土壤养分影响着植物的生产力,同时植被盖度、凋落物以及根系分泌物均影响着土壤养分的动态。本研究结果表明,植被盖度与土壤有机质和全氮呈显著正相关,特别是对土壤有机质的影响大于全氮,但是全氮对植被地下生物量有影响。作为土壤中能被植物直接吸收利用的速效养分,土壤有效磷和铵态氮对植被生物量均有一定程度的影响,其中土壤有效磷与植被地上、地下生物量均呈显著负相关,而土壤铵态氮与植被地上、地下生物量均呈极显著正相关(表4)。全磷元素作为土壤主要营养元素,在本研究中对植被多样性、生长和生物量影响较小。
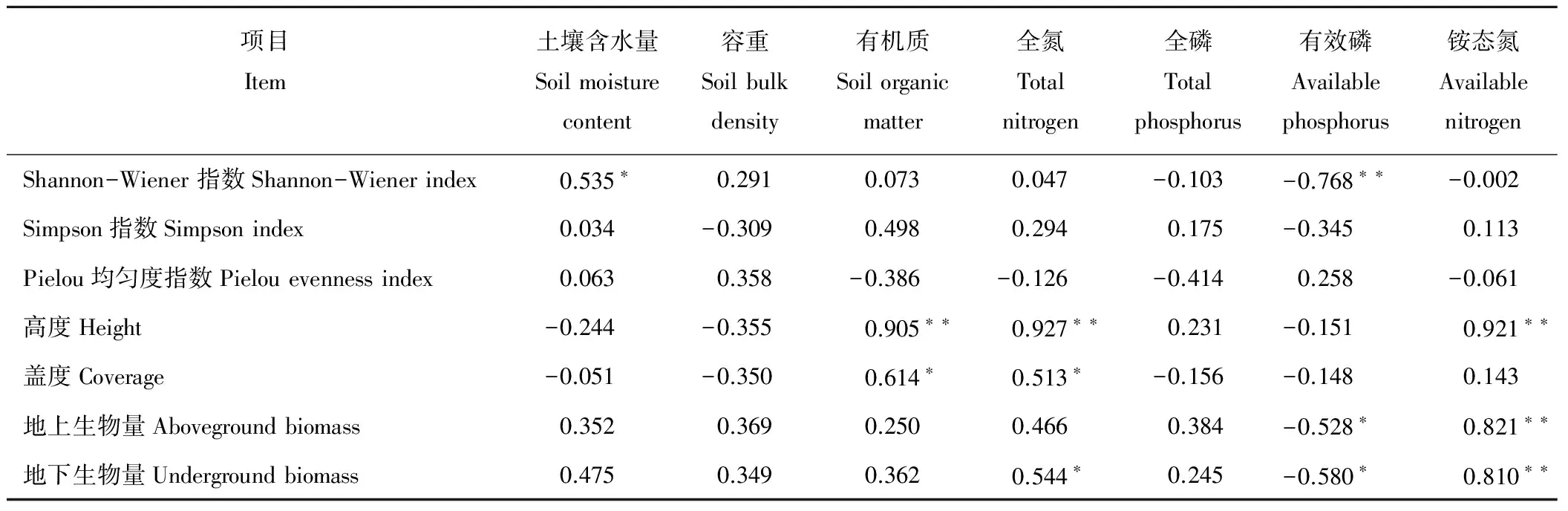
表4 植被群落特征与土壤理化性质的相关系数Table 4 Correlation coefficients between vegetation characteristics and soil physicochemical properties
注:* 显著性水平P<0.05;** 显著性水平P<0.01。
Note: * indicates significance at the 0.05 level; ** indicates significance at the 0.01 level.
2.3.2植被群落特征与土壤因子的冗余分析排列 根据RDA的结果(表5),前两个排序轴保留了植被群落特征数据总方差的84.8%,且植被特征与土壤因子关系累计解释量达99.8%,由此可知第1、2轴能较好地反映植被群落特征与土壤因子的关系,且主要由第1轴决定。

表5 5种草甸植被群落特征与土壤因子的RDA结果Table 5 RDA analyses for vegetation community characteristics of five meadows and soil factor
RDA排序描述了研究区5种不同草甸植被群落特征与土壤因子的关系(图2)。结果表明,植被群落特征除了盖度、地上生物量和Shannon-Wiener指数外,其他均沿着第1轴排列;土壤养分因子中除了有效磷,其他均沿着第1轴排列且都在轴的左侧,与第1轴正相关,而土壤物理性质沿第2轴排列,表明土壤养分对植被群落的多样性、生物量和生长有不同程度的影响。此外在排序中,沿第1轴依次为沼泽草甸、过渡草甸、成熟草甸和盐碱草甸,其中,过渡草甸排序分布在养分含量较高的第1轴的左上角,沼泽草甸排序分布在植被生物量较大的第1轴的左下角,盐碱草甸距离第1轴较近且在轴的右侧;成熟草甸和湿地草甸均沿第1轴分布且靠近原点,表明在辉河湿地,各类型草甸之间存在一定程度的演替且对土壤养分的需求不同,成熟草甸和湿地草甸可能为演替的初始阶段或者是末阶段,而过渡草甸为中间阶段,而且土壤养分受群落演替的影响显著。
3 讨论
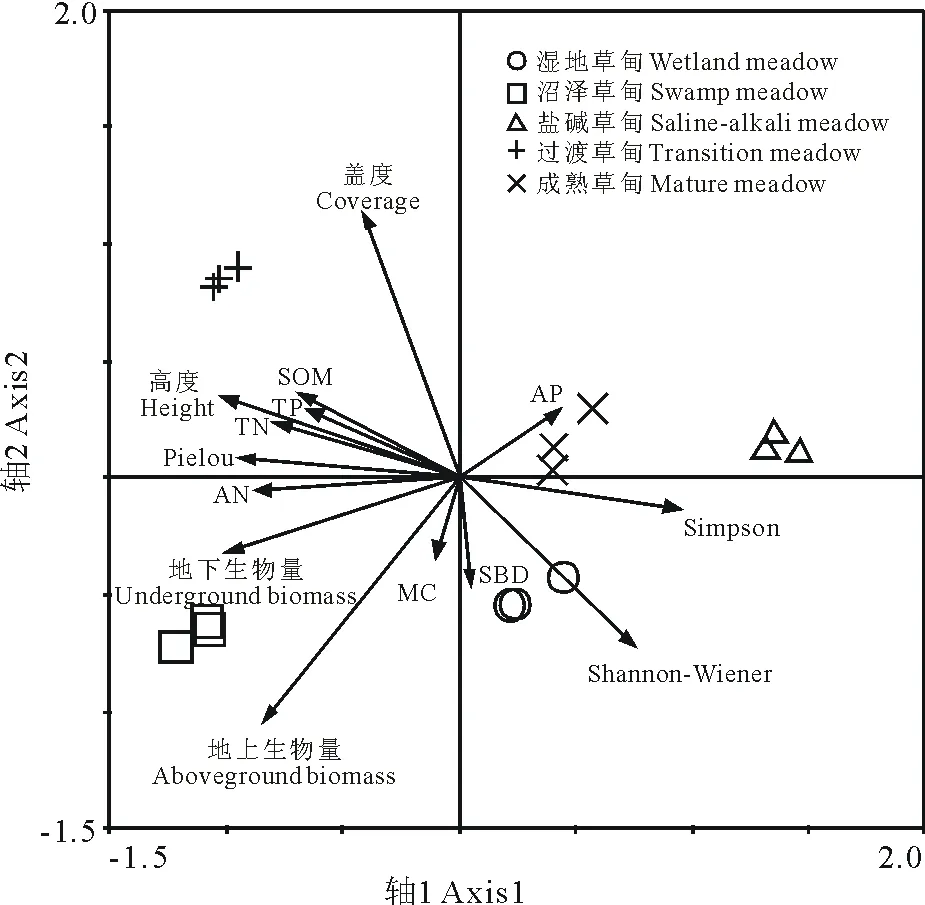
图2 5种草甸植被群落特征与土壤因子的RDA排序 Fig.2 RDA biplot for vegetation community characteristics of five meadows and soil factors MC: 土壤含水量Soil moisture content; SBD: 土壤容重Soil bulk density;SOM: 土壤有机质Soil organic matter; TN: 全氮Total nitrogen;TP: 全磷Total phosphorus;AN: 铵态氮Available nitrogen; AP: 有效磷Available phosphorus.
3.1 不同草甸植被群落土壤特征
自然条件下,湿地土壤碳、氮等营养元素含量不仅受成土母质气候及水文条件等影响,而且也受地表植物群落的影响[24]。湿地草甸、沼泽草甸和成熟草甸由于受水流冲刷的影响,地表营养物质和凋落物易随水流被带走,导致营养物质碳、氮、磷的流失,不利于营养物质积累,所以土壤有机质、全氮、全磷含量均较低。此外,成熟草甸植被群落以草本植物群落为主,这些群落的优势种多为密集生长型的多年生物种,植被的覆盖度较大,因而其土壤通气性较弱,不利于有机质矿化,土壤养分含量较低。与此相反,过渡草甸位于沼泽化草甸到草甸的过渡带,淹水环境不断丧失,土壤通气性增加,使湿地表层土壤处于干燥的氧化还原环境,植物生长较为密集,植株密度高、盖度大,凋落物含量增加,有利于土壤养分的积累,因而其土壤有机质、全氮、全磷含量显著高于其他草甸。研究表明,容重反映湿地植被及土壤的持水、蓄水性能[25],土壤容重太高不利于土壤持水和蓄水,也不利于有机质的积累,本研究与此一致,湿地草甸、沼泽草甸和过渡草甸的土壤容重显著高于其他群落,但是土壤有机质含量却很低。
植物因种类不同对养分的吸收状况也不同,其中,NO3--N和NH4+-N都是植物生长的重要氮源,并且不同植物对某种氮源的偏好有着重要的生态意义和实际意义[26-28]。有研究表明,NH4+-N是香蒲、芦苇等湿地植物主要吸收的无机氮形态[29-31],本研究的结论与此一致,沼泽草甸和过渡草甸的优势植物群落分别是芦苇和香蒲,土壤铵态氮含量显著高于其他群落。土壤速效磷的转化与根系密集程度有关,根表层表面积大,与湿地土壤接触的表面积大,土壤速效磷转化作用较强,导致除碱蓬以外的其他4种植被群落土壤有效磷含量较低,其次,碱蓬植物体本身磷元素含量高,将全磷转化为速效磷的能力强[32]。此外,碱蓬群落位于盐碱地,由于含盐量较高,盐分会导致植物缺水,土壤易板结,持水性及透水性较差,影响土壤微生物的活动和有机质的转化,导致土壤肥力水平下降[33-34],因此,盐碱草甸土壤养分水平均较低。
3.2 不同草甸植被群落特征与土壤因子的关系
植物群落中种群的群落结构分布受到多种因素的影响,尤其是物种自身的生物生态学特性。在不同草甸类型中,成熟草甸植被群落以草本植物群落为主,多为密集生长型物种且种类较多,使群落下层物种和一些一年生物种不能获得足够的营养和生存空间,分布不均匀。在湿地草甸和沼泽草甸,苔草、芦苇等多年生湿地植物都以根状茎和根的分蘖等无性繁殖为主要繁殖方式,多为分散生长型,在小尺度上物种相对单一,所以生物多样性指数较低。此外,湿地草甸、沼泽草甸和成熟草甸靠近水域边缘,受周期性洪水干扰严重,淹水时间相对较长,土壤含水量较高,生境异质性高,植物生长和分布受到一定程度的抑制,其中,湿地草甸和沼泽草甸的盖度和多样性指标均较低。本研究中,碱蓬作为盐碱草甸唯一的优势种群且植株较为矮小,因而多样性指数、盖度等群落特征不显著。
湿地植物和土壤彼此之间有着强烈的影响[8]。从区域尺度来看,植物群落的演替进程增加了土壤养分的空间异质性,而土壤养分的空间异质性对物种种间关系、种的分布格局及其干扰下的群落物种多样性的维持至关重要。虽然已有大量研究表明群落的分布和多样性与土壤因子有显著的相关关系[11,35-37],但在本研究中,多样性指数只有Shannon-Wiener指数与土壤含水量呈正相关,与土壤速效磷呈负相关,而与土壤其他营养元素相关性不显著,可能是随着湿地草甸的演替,其淹水环境不断丧失,土壤通气性增加,使湿地表层土壤处于干燥的氧化还原环境,有利于有机质矿化,改变了植物生长环境条件,影响植物多样性,其次表明土壤因子对湿地带植物物种多样性有重要影响,但不一定是决定性因素,影响群落物种多样性的因素比较复杂,除了土壤因子,光照、温度和地形等也会对其产生影响[38],因此也进一步说明了,除取样引起的误差是本研究中植被多样性指数与土壤氮素相关性较弱的原因,此外还可能与辉河湿地土壤粒径、植物本身对氮元素的需求量和对养分的持留能力以及湿地水循环过程对土壤养分产生的影响有关,需进行进一步研究。
本研究虽在辉河自然保护区核心区内进行,目前该区域只有极少数的科研、观测和调查活动,该区域禁止任何牧业活动,但仍存在偷牧和私自旅游等人类活动,对植物和土壤都产生了一定影响,进而影响到植物多样性与土壤因子的关系。因此,人为干扰也是植物多样性的重要影响因素。
湿地植被分布不仅对土壤中氮、磷、有机质等营养物质的含量有显著影响,湿地土壤环境因子对湿地植被的生长也具有重要的反馈作用。本研究中,植被高度、盖度、地上和地下生物量均与土壤铵态氮呈极显著正相关,其中,植被高度、盖度和地下生物量与土壤全氮呈显著正相关,植被地上和地下生物量与土壤速效磷呈极显著负相关。这与张智才等[39]研究结果:群落地下生物量、单位面积物种数与土壤有机质、全氮、全磷含量均呈显著正相关关系不完全一致。由于植物枯落物是主要的有机质来源,所以不同植被群落的植被生态学特征(高度、密度、多度、生物多样性等)均可能是造成有机质变异程度相对较大的原因。氮素含量直接影响着植物的生产力、植被类型,同时植被覆盖度、植物残体输入量以及植被类型也影响着氮素的动态。随着植物群落演替的进行,植物生物量和地表凋落物增加,土壤中微生物也随之增加,土壤中全氮含量也有所增加;且随着植被物种的增多,土壤淹水环境得到一定的改善,根系环境中微生物含量也随之增加,更多的有机氮矿化以满足植物的生长需求,因此在本研究中,土壤氮素含量与植被生长特征相关性显著。对于土壤全磷和有效磷,在本研究中与植被生长特征相关性不显著,特别是土壤有效磷与多样性和生长指标呈负相关,其原因可能是土壤中磷的含量主要和成土母质有关,其含量受土壤类型和气候条件的影响,受演替中植被群落结构变化影响较弱;其次,与植物本身对磷元素的需求量和对养分的持留能力以及湿地水循环过程对土壤养分产生的影响有关,在一定程度上表明了磷是辉河湿地的限制性元素。
4 结论
1)辉河湿地不同草甸植被群落Shannon-Wiener和Simpson指数变化均为成熟草甸最高,盐碱草甸最低;而Pielou均匀度指数变化为:成熟草甸<盐碱草甸<湿地草甸<沼泽草甸<过渡草甸。在5种不同草甸中,沼泽草甸地上和地下生物量最高,盐碱草甸最低。
2)植被群落的变化能够影响土壤养分含量,5种草甸中,过渡草甸土壤全氮、有机质、全磷以及铵态氮含量均显著高于其他草甸土壤。
3)群落Shannon-Wiener指数与土壤含水量呈显著正相关,与土壤速效磷呈极显著负相关。土壤有机质、全氮和铵态氮与植被高度均呈极显著正相关;植被盖度与土壤有机质和全氮呈显著正相关,特别是对土壤有机质的影响大于全氮,但是全氮对植被地下生物量有显著影响;土壤速效磷和铵态氮对植被生物量均有一定程度的影响,其中土壤速效磷与植被地上、地下生物量均呈显著负相关,而土壤铵态氮与植被地上、地下生物量均呈极显著正相关;全磷在本研究中对植被多样性、生长和生物量影响较小。
4)植被群落特征与土壤因子的RDA排序表明,在辉河湿地,各类型草甸之间存在一定程度的演替且对土壤养分的需求不同,成熟草甸和湿地草甸可能为演替的初始阶段或者是末阶段,而过渡草甸为中间阶段,而且土壤养分受群落演替的影响显著。
References:
[1] Qu G H, Guo J X. The relationship between different plant communities and soil characteristics in Songnen grassland. Acta Prataculturae Sinica, 2003, 12(1): 18-22.
曲国辉, 郭继勋. 松嫩平原不同演替阶段植物群落和土壤特性的关系. 草业学报, 2003, 12(1): 18-22.
[2] Qu G H, Guo J X. Roles of plant in nutrient cycling in wetland. Chinese Journal of Ecology, 2007, 26(10): 1628-1633.
曲国辉, 郭继勋. 植物在湿地养分循环中的作用. 生态学杂志, 2007, 26(10): 1628-1633.
[3] Ling M, Liu R H, Wang Y,etal. Spatial heterogeneity of soil nutrients and the relationship between soil nutrients and plant community inTamarixchineseforest farm wetland of Yellow River delta wetland. Wetland Science, 2010, 8(1): 92-97.
凌敏, 刘汝海, 王艳, 等. 黄河三角洲柽柳林场湿地土壤养分的空间异质性及其与植物群落分布的耦合关系. 湿地科学, 2010, 8(1): 92-97.
[4] Yang Q, Liu J P, Lü X G,etal. Structure and function of soil-vegetation-animal system of annular wetland in the Sanjiang Plain. Chinese Journal of Ecology, 2004, 23(4): 72-77.
杨青, 刘吉平, 吕宪国, 等. 三江平原典型环型湿地土壤-植被-动物系统的结构及功能研究. 生态学杂志, 2004, 23(4): 72-77.
[5] Liu J T, Qiu C Q, Xiao B T. The role of plants in channel-dyke and field irrigation systems for domestic wastewater treatment in an integrated eco-engineering system. Ecological Engineering, 2000, 16: 235-241.
[6] Picard C R, Fraser L H, Steer D. The interacting effects of temperature and plant community type on nutrient removal in wetland microcosms. Bioresource Technology, 2005, 96: 1039-1047.
[7] Kang S, Kang H, Ko D. Nitrogen removal from a riverine wetland: A field survey and simulation study ofPhragmitesjaponica. Ecological Engineering, 2002, 18: 467-475.
[8] Zhang Q J, Yu X B, Qian J X,etal. Distribution characteristics of plant communities and soil organic matter and main nutrient in the Poyang Lake Nanji Wetland. Acta Ecological Sinica, 2012, 32(12): 3656-3669.
张全军, 于秀波, 钱建鑫, 等. 鄱阳湖南矶湿地优势植物群落及土壤有机质和营养元素分布特征. 生态学报, 2012, 32(12): 3656-3669.
[9] Du Y H, Xu Z, Xie W X,etal. Distribution characteristics of phosphorus under different vegetation communities in Salt Marshes of Jiaozhou Bay. Wetland Science, 2016, 14(3): 415-420.
杜云鸿, 徐振, 谢文霞, 等. 胶州湾盐沼不同植物群落下土壤磷的分布特征. 湿地科学, 2016, 14(3): 415-420.
[10] Li X R, Zhang Z S, Zhang J G,etal. Association between vegetation patterns and soil properties in the southeastern Tengger Desert, China. Arid Land Research and Management, 2004, 18(4): 369-383.
[11] Lou Y, Wang G, Lu X,etal. Zonation of plant cover and environmental factors in wetlands of the Sanjiang Plain, northeast China. Nordic Journal of Botany, 2013, 31(6): 748-756.
[12] Wang Z X, Luan Z Q, Liu G H. Respondence of vegetation to soil environmental factors in riparian Wetlands of Nongjiang River, Honghe National Nature Reserve. Wetland Science, 2013, 11(1): 54-59.
王忠欣, 栾兆擎, 刘贵花. 洪河国家级自然保护区浓江河滨河湿地植物对土壤环境因子的响应. 湿地科学, 2013, 11(1): 54-59.
[13] Hu Y J, Xie Y H, Li F,etal. Characteristics ofCarexbrevicuspisand its impact factors in Dingzidi, East Dongting Lake. Chinese Journal of Applied Ecology, 2014, 25(3): 745-751.
胡宇佳, 谢永宏, 李峰, 等. 东洞庭湖丁字堤苔草群落特征及其影响因子. 应用生态学报, 2014, 25(3): 745-751.
[14] Wang X L, Chang L F, Li H P,etal. Study on community characteristics and soil properties of typical vegetation in Chaohu hill region. Soils, 2011, 43(6): 981-986.
王晓龙, 常龙飞, 李恒鹏, 等. 巢湖低丘山区典型植被群落与土壤环境因子特征研究. 土壤, 2011, 43(6): 981-986.
[15] Lu S R, Ala T H S. Analysis on the ecological restoration of Huihe Wetland in Ewenki Autonomous Banner. Inner Mongolia Water Conservancy, 2013, (6): 78-79.
鲁淑荣, 阿拉腾哈斯. 恢复鄂温克旗辉河湿地生态浅析. 内蒙古水利, 2013, (6): 78-79.
[16] Ge D X, Li C, Wang Y C,etal. Area change of Huihe wetland and the relation between that and local climate from 2000 to 2007.Wetland Science, 2009, 7(4): 314-320.
葛德祥, 李翀, 王义成, 等. 2000-2007年辉河湿地面积变化及其与局地气候的关系研究. 湿地科学, 2009, 7(4): 314-320.
[17] Hodgson J G, Grime J P, Wilson P J,etal. The impacts of agricultural change (1963-2003) on the grassland flora of Central England: processes and prospects. Basic & Applied Ecology, 2005, 6(2): 107-118.
[18] Bu H. Biodiversity protection countermeasures of Huihe River National Nature Reserve in Inner Mongolia. Journal of Beijing Forestry University, 2011, (Supple 2): 79-83.
布和. 论内蒙古辉河国家级自然保护区生物多样性保护对策. 北京林业大学学报, 2011, (增刊2): 79-83.
[19] Chang X L, Lü S H, Ye S X,etal. Assessment of the ecosystem health of the nation Huihe wetland reserve. Acta Scientiae Circumstantiae, 2010, 30(9): 1905-1911.
常学礼, 吕世海, 叶生星, 等. 辉河湿地国家自然保护区生态系统健康评价. 环境科学学报, 2010, 30(9): 1905-1911.
[20] Jin Y C, Wang W, Xin L J,etal. Changes of land cover and landscape pattern in Huihe nation nature reserve. Pratacultural Science, 2014, 31(10): 1859-1866.
靳勇超, 王伟, 辛利娟, 等. 辉河国家级自然保护区土地覆盖与景观格局变化分析. 草业科学, 2014, 31(10): 1859-1866.
[21] Nanjing Agricultural College. Analysis of soil aggregation. Beijing: Agricultural Press, 1985.
南京农学院. 土壤农化分析. 北京: 农业出版社, 1985.
[22] Magurran A E. Ecological diversity and its measurement. Princeton: Princeton University Press, 1988.
[23] Alatalo R V. Problems in the measurement of evenness in ecology. Oikos, 1981, 37(2): 199-204.
[24] Ge G, Xu Y H, Zhao L,etal. Spatial distribution characteristics of soil organic matter and nitrogen in the Poyang lake wetland. Resources and Environment in the Yangtze Basin, 2010, 19(6): 619-622.
葛刚, 徐燕花, 赵磊, 等.鄱阳湖湿地土壤有机质和土壤氮空间分布特征.长江流域资源与环境, 2010, 19(6): 619-622.
[25] Jiao J Y, Ma X H, Bai W J,etal. Correspondence analysis of vegetation communities and soil environmental factors on abandoned cropland on hilly-gullied Loess Plateau. Acta Pedologica Sinica, 2005, 42(5): 42-50.
焦菊英, 马祥华, 白文娟, 等. 黄土丘陵沟壑区退耕地植物群落与土壤环境因子的对应分析. 土壤学报, 2005, 42(5): 42-50.
[26] Li Y Q, Jiang Y H, Li Z H,etal. Nitrogen removal from eutrophic water by terrestrial economic plants floating-bed system. Environmental Science and Technology, 2010, 33(8): 103-107.
李艳蔷, 姜应和, 李兆华, 等.陆生经济植物浮床去除富营养化水中氮素研究.环境科学与技术, 2010, 33(8): 103-107.
[27] Yin L C, Zhang Y Z, Zhou W J,etal. NO3-, H2PO4-and K+uptake by three weed species.Erysimumcheiranthoides,ChorisporatenellaandVeronicaagrestisin winter wheat cropping land. Chinese Journal of Soil Science, 2007, 38(1): 68-71.
尹力初, 张扬珠, 周卫军, 等. 婆婆纳、离子草与小花糖芥三种麦田杂草吸收NO3-, H2PO4-, K+的动力学研究. 土壤通报, 2007, 38(1): 68-71.
[28] Dang C X, Shen Q R, Wang G. Tomato growth and organic acid changes in response to partial replacement of NO3--N by NH4+-N. Pedosphere, 2004, 14(2): 159-164.
[29] Brix H, Dyhr-Jensen K, Lorenzen B. Root-zone acidity and nitrogen source affectsTyphalatifoliaL. growth and uptake kinetics of ammonium and nitrate. Journal of Experimental Botany, 2002, 53: 2441-2450.
[30] Fang Y Y, Babourina O, Rengel Z,etal. Ammonium and nitrate uptake by the floating plantLandoltiapunctate. Annales of Botany, 2007, 99(2): 365-370.
[31] Jampeetong A, Brix H. Nitrogen nutrition ofSalvinianatans: Effects of inorganic nitrogen form on growth, morphology, nitrate reductase activity and uptake kinetics of ammonium and nitrate. Aquatic Botany, 2009, 90(1): 67-73.
[32] Liu Y, Ding T L, Wang B S. Study on the leaf succulence ofSuaedasalsaunder differently natural saline environments. Journal of Shandong Normal University (Natural Science Edition), 2006, 21(2): 102-104.
刘彧, 丁同楼, 王宝山. 不同自然盐渍生境下盐地碱蓬叶片肉质化研究. 山东师范大学学报(自然科学版), 2006, 21(2):102-104.
[33] He B, Cai Y L, Ran W R,etal. Effects of artificial vegetation on the spatial heterogeneity of soil moisture and salt in coastal saline land of Chongming Dongtan, Shanghai. Chinese Journal of Applied Ecology, 2013, 24(8): 2151-2158.
何斌, 蔡永立, 冉文瑞, 等. 人工植被对崇明东滩滨海盐土水盐空间异质性的影响. 应用生态学报, 2013, 24(8): 2151-2158.
[34] Zhang Q M, Xue C H, Wang C X. Effects of imidacloprid on soil microbial communities in different saline soils. Environmental Science and Pollution Research, 2015, 22: 19667-19675.
[35] Defossez E, Courbaud B, Marcais B,etal. Do interactions between plant and soil biota change with elevation: A study onFagussylvatica. Biology Letters, 2011, 7(5): 699-701.
[36] Liu F P, Xu G Q, Liu Q C,etal. Variation of structure of bacterial communities in soils with typical plant communities in Nanjishan wetlands. Wetland Science, 2015, 13(4): 444-450.
刘芳鹏, 许光勤, 刘倩纯, 等. 南矶山湿地典型植物群落土壤细菌群落结构变化. 湿地科学, 2015, 13(4): 444-450.
[37] Zhang Z Y, Cheng L, Zheng Z W,etal. Effects of environment on riparian plant community in the inflow branches of the Hanfeng lake. Journal of Hydroecology, 2015, (1): 9-18.
张志永, 程丽, 郑志伟, 等. 汉丰湖入湖支流河岸带植物群落特征及其环境影响分析. 水生态学杂志, 2015, (1): 9-18.
[38] Wang D P, Ji S Y, Chen F P. A review on the species diversity of plant community. Chinese Journal of Ecology, 2001, 4(4): 55-60.
汪殿蓓, 暨淑仪, 陈飞鹏. 植物群落物种多样性研究综述. 生态学杂志, 2001, 4(4): 55-60.
[39] Zhang Z C, Yan Y C, Shao Z Y.Study on the correlation between steppe vegetation and soil as well as the difference in response to disturbance. Journal of Arid Land Resources and Environment, 2009, 23(5): 121-127.
张智才, 闫玉春, 邵振艳. 草原植被-土壤的关系及对干扰响应差异研究. 干旱区资源与环境, 2009, 23(5): 121-127.

