卡左双多巴控释片治疗帕金森病伴发抑郁症临床观察
杨怀芹 陆 刚 刘阿楠 李华丽
平顶山市第一人民医院神经内二科,河南 平顶山 467000
帕金森病(Parkinson’s disease,PD)是一种以运动症状为核心的运动障碍性疾病,可导致严重的神经系统病变,多发于中老年人[1]。非运动症状(non-motor symptoms,NMS)对患者生活质量及预后产生重大影响,尤其是神经精神症状[2]。抑郁为帕金森病最常见的症状,严重影响患者的生活质量,如何有效改善其抑郁症状被视为帕金森治疗目标之一[3-4]。
帕金森伴发抑郁(depression of Parkinson’s disease,dPD)的发生涉及多种神经递质,临床治疗药物主要包括多巴胺受体激动剂、5-HT再摄取抑制剂(SSRIs)、三环类抗抑郁药[5],但尚无统一的用药标准。左旋多巴(levodopa,L-DOPA)为酪氨酸形成儿茶酚胺的中间产物即多巴胺的前体,可进入中枢神经增加纹状体中多巴胺递质浓度,对改善PD患者症状疗效确切,优越性显著,是治疗帕金森病的金标准[6]。本研究笔者采用卡左双多巴控释片治疗dPD取得一定疗效,为临床用药提供新的思路和借鉴。
1 资料和方法
1.1一般资料本次研究经院医学伦理委员会讨论批准,患者及家属签署知情同意书。采用前瞻性、随机、平行对照试验设计法。入选标准:(1)年龄40~80岁,不限性别;(2)符合中华医学会神经病学分会帕金森病及运动障碍学组制定修订《帕金森病抑郁、焦虑及精神病性障碍的诊断标准及治疗指南》中帕金森病伴抑郁的诊断标准[7];(3)病程>6个月,且出现抑郁>2周;(4)汉密尔顿抑郁量表(HAMD)评分≥18分;(5)经CT或(和)MRI检查证实除老年性脑改变外无其他异常;(6)均未接受过抗抑郁治疗;(7)依从性良好,遵医嘱用药并定期随访;(8)临床资料齐全,并自愿参与本次研究。排除标准:(1)不符合入选标准;(2)脑血管病、脑炎、中毒等所致的继发性帕金森综合征;(3)既往存在抑郁症者;(4)合并严重肝肾功能不全、恶性肿瘤等器质性疾病者;(5)合并除抑郁外其他精神疾病者;(6)合并构音障碍不能准确表达情感者;(7)老年痴呆患者;(8)MMSE评估确定存在认知障碍者;(9)过敏体质,对本次研究用药存在严重过敏反应者;(10)合并影响疗效评价准确性因素者。最终入选90例帕金森病伴抑郁症患者,利用随机数字表分为2组。2组性别构成比、年龄、病程、抑郁程度等差异均无统计学意义(P>0.05),具有可比性。见表1。
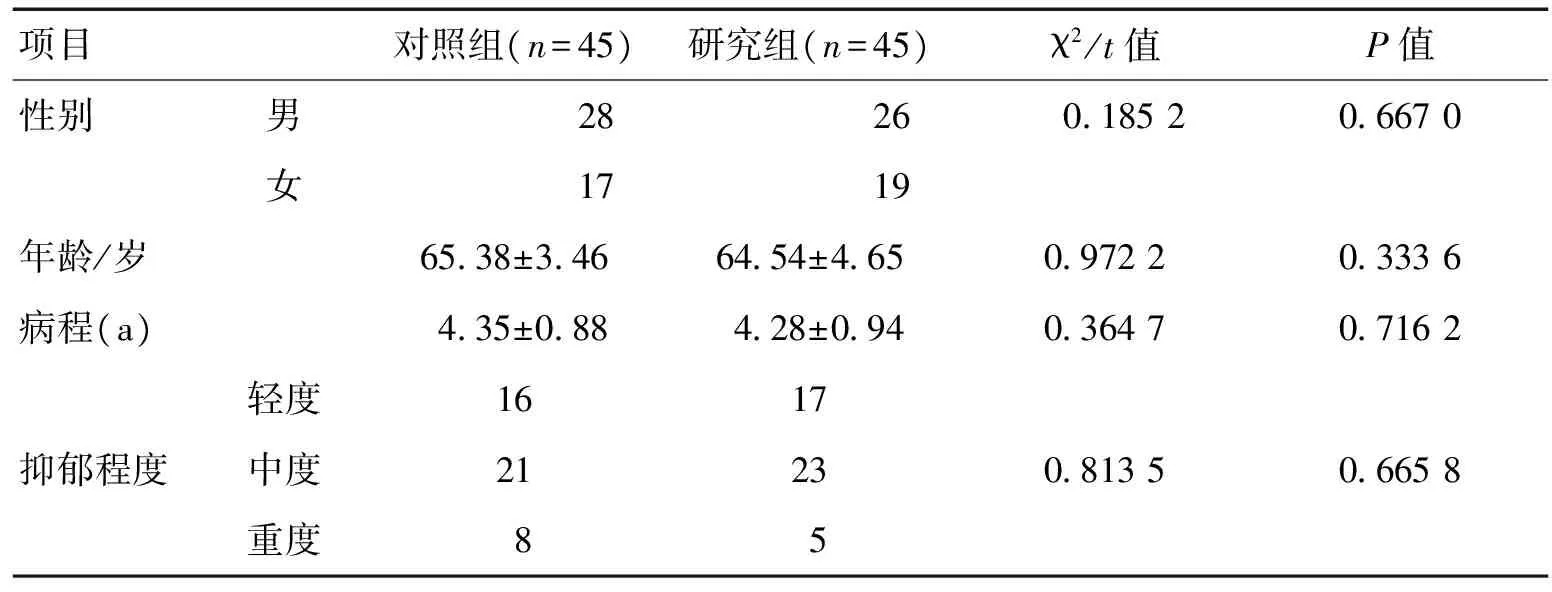
表1 2组一般资料对比
1.2治疗方法2组均予以健康教育、康复与运动疗法、认知行为疗法,对照组予以安慰剂治疗,治疗组予以卡左双多巴控释片[商品名:息宁;生产厂家:MerckSharp & Dohme(Italia)S.P.A;批准文号:进口药品注册证号H20100047;规格:卡比多巴50 mg:左旋多巴200 mg],起始剂量0.5片/d,口服,逐渐增加剂量,直至病情有效控制后予以维持最小有效剂量服药。2组均不合用抗抑郁药、抗精神病药物,若出现不良反应则予以对症处理。
1.3观察指标和评价标准采用汉密尔顿抑郁量表(HAMD)评估2组治疗4周末、8周末抑郁状态,并计算抑郁状态疗效指数[(治疗前HAMD评分-治疗后HAMD评分)/治疗前HAMD评分×100%]评估抑郁疗效[8],抑郁状态疗效指数≥75%判定为治愈,50%~74%判定为显效,25%~49%判定为有效,<25%判定为无效,总有效=治愈+显效;同时,观察2组不良反应发生情况。此外,对2组均进行为期3~12个月随访,于治疗前、治疗后、随访末采用帕金森症生活品质问卷(PDQ-39)从运动、日常生活活动、情感状态、病耻感、社会支持、认知、交流、身体不适8个维度39个条目评估患者的生活质量,将PDQ-39总评分转化为0~100分综合指数,得分越高提示生活质量越低。
2 结果
2.1 2组HAMD评分比较治疗后2组HAMD评分较治疗前呈下降趋势(P<0.05),且治疗组4周末、8周末HAMD评分均明显低于对照组(P<0.05)。见表2。
2.2 2组PDQ-39评分比较定期门诊随访,随访截止日期2016-05-01,平均随访6.58个月。2组PDQ-39评分均呈下降趋势,对照组经秩和检验P>0.05,治疗组经秩和检验P<0.05,治疗后和随访末治疗组PDQ-39评分均明显低于对照组(P<0.05)。见表2。
表2 2组不同时点HAMD与PDQ-39评分比较分)
2.3 2组疗效比较2组均完成8周治疗,用药4周后治疗组总有效率明显高于对照组(P<0.01),且用药8周后总有效率亦明显高于对照组(P<0.01)。见表3。
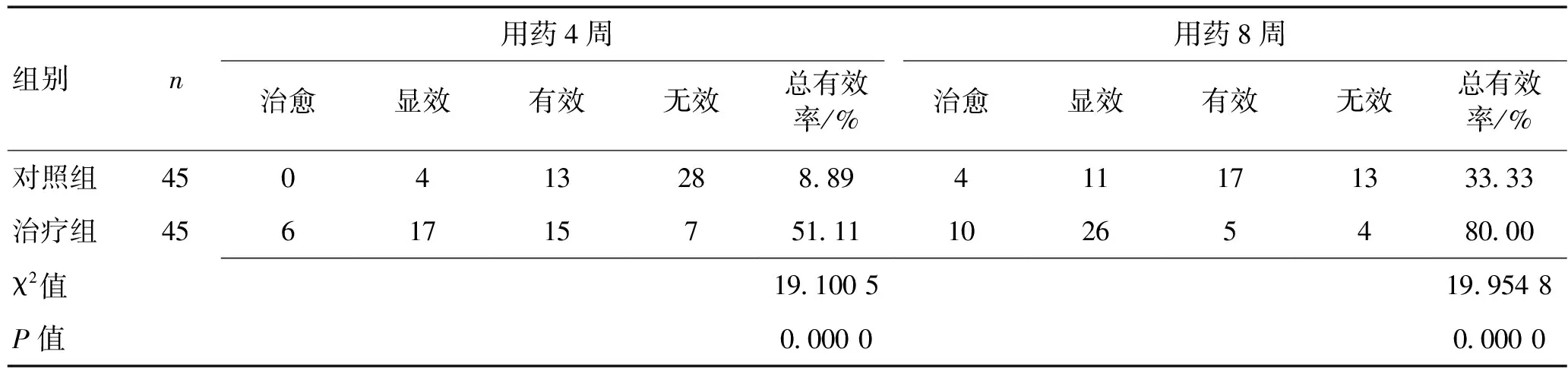
表3 2组治疗4周、8周后抑郁疗效比较 (n)
2.4不良反应治疗组用药期间出现恶心2例,失眠3例,头痛2例,口干2例,乏力1例,不良反应发生率22.22%;对照组分别为1例、2例、2例、1例、0,不良反应发生率13.33%,2组比较,经χ2检验,差异无统计学意义(χ2=1.216 2,P=0.270 1)。
3 讨论
帕金森病是中老年常见的一种慢性退行性中枢神经系统疾病,主要表现为运动障碍症状,还可出现抑郁、焦虑等精神症状,严重影响患者的生存质量[9-11]。帕金森发病与脑内多巴胺合成和代谢相关,中枢多巴胺活动异常和帕金森合并抑郁症状密切相关,LAU等[12]报道dPD患者血小板5-HT含量减少,同期和昱辰等[13]亦报道脑内5-HT神经递质含量显著降低。5-HT具有阻止纹状体多巴胺释放的作用,5-HT减少是纹状体对多巴胺减少的功能性调节[14],5-HT减少状态亦是抑郁发生的一项危险因素[15],故帕金森患者抑郁症发生率高,可先于帕金森症状出现,但目前临床尚无统一的治疗标准和原则,多以对症治疗为主。
左旋多巴为多巴胺神经递质合成的前提,可直接穿过血-脑屏障进入中枢神经系统,并经脱羧酶作用转化为多巴胺而发挥相应的药理作用[16],因L-DOPA可转换为多巴胺和5-HT,故左旋多巴不仅可确切改善PD患者运动症状,还可通过减少“关”期减少并减轻抑郁症状[17],但大部分左旋多巴在进入中枢系统前已被代谢和消耗,仅约1%左旋多巴进入中枢神经转化成多巴胺发挥作用,故临床中极少单独应用。中国帕金森病治疗指南(第3版)指出“尽可能以小剂量达到满意临床效果”的用药原则[18-19],卡比多巴/左旋多巴复方制剂被公认为是治疗PD症状的金标准[20]。故本次研究选择卡比多巴/左旋多巴复方制剂——息宁控释片,发现治疗组治疗后HAMD评分降低程度较对照组更为显著(P<0.05),治疗4周和8周对抑郁状态的疗效均明显优于对照组(P<0.05),且未见严重的不良反应。另外,对患者进行随访,评估其生活质量情况发现对照组PDQ-39评分虽有所下降,但差异无统计学意义(P>0.05),治疗组PDQ-39评分下降趋势较为明显(P<0.05),且不同时点治疗组PDQ-39评分均低于对照组(P<0.05),提示卡比多巴/左旋多巴复方制剂在短期内可明显改善患者抑郁状态、疗效确切,不良反应少且轻微,还可明显提高患者的生存质量。STANSLEY等[21]报道,左旋多巴具有一定的神经毒性作用,可导致多巴胺能神经元死亡。LEENTJENS等[22]构建PD抑郁模型发现,左旋多巴的使用为dPD发生的特异性危险因素之一,多项报道证实,长期应用左旋多巴治疗帕金森病患者运动障碍症状同时损伤脑内5-HT能神经元,可能会诱发或加重抑郁症状[23-24],但本次研究尚未监测患者脑内5-HT水平,且未对患者远期效果及不良反应进行随访研究,有待进一步完善。
[1] PRAKASH A,CHOPRA K,MEDHI B.Granulocyte-colony stimulating factor improves Parkinson’s disease associated with co-morbid depression:An experimental exploratory study[J].Indian J Pharmacol,2013,45(6):612-615.
[2] 罗琴.重复经颅磁刺激对帕金森抑郁患者的生活质量及运动症状疗效的影响[J].国际神经病学神经外科学杂志,2015,42(6):488-491.
[3] 陈伶,符晓苏,吴婷.帕金森病伴发抑郁研究进展[J].临床精神医学杂志,2013,23(6):424-425.
[4] 王雪.盐酸帕罗西汀对帕金森病伴抑郁及焦虑患者的临床疗效[J].中国实用神经疾病杂志,2016,19(18):35-36.
[5] 姚燕,刘卫国.帕金森病伴发抑郁[J/CD].中华脑科疾病与康复杂志(电子版),2015,5(4):255-259.
[6] 刘慧,陈晨,王晓平.左旋多巴在帕金森病以外的临床应用[J/CD].中华临床医师杂志(电子版),2013,7(22):10 206-10 208.
[7] 中华医学会神经病学分会神经心理学与行为神经病学组.中华医学会神经病学分会帕金森病及运动障碍学组.帕金森病抑郁、焦虑及精神病性障碍的诊断标准及治疗指南[J].中华神经科杂志,2013,46(1):56-60.
[8] 李兆昌.帕罗西汀治疗帕金森病抑郁状态疗效分析[J].现代医生,2014,14(1):35-37.
[9] 唐晓辉,贺朝晖.帕金森病患者的抑郁症状与生活质量[J].中国神经精神疾病杂志,2011,37(10):635-636.
[10] GROVER S,SOMAIYA M,KUMAR S,et al.Psychiatric asp-ects of Parkinson’s disease[J].J Neurosci Rural Pract,2015,6(1):65-67.
[11] MORLEY J F,PAWLOWSKI S M,KESARI A,et al.Motor and non-motor features of Parkinson’s disease that presisitent drug-induced Parkinsonism[J].Parkinsonism Relat Disord,2014,20(7):738-742.
[12] LAU L M,VERBAAN D,MARINUS J,et al.Survival in Parkinson’s disease.Relation with motor and non-motor features[J].Parkinsonism Relat Disord,2014,20(6):613-616.
[13] 和昱辰,张波,瞿玮,等.血清单胺类神经递质及其代谢产物在重度抑郁症共病焦虑障碍诊断中的应用[J].第三军医大学学报,2014,36(8):806-810.
[14] 杨秀毅.电针刺激联合左旋多巴治疗帕金森病的疗效观察[J].中国实用神经疾病杂志,2016,19(13):103-105.
[15] SHEN C C,TSAI S J,PERNG C L,et al.Risk of Parkinson disease after depression:a nationwide population-based study[J].J Neurol,2013,81(17):1 538-1 544.
[16] 朱骏,张丽.帕金森病神经精神症状的研究进展[J].中风与神经疾病杂志,2015,22(6):390-394.
[17] ESKOW JAUNARAJS K L,ANGOA-PEREZ M,KUHN D M,et al.Potential mechanisms underlying anxiety and depression in Parkinson’s disease:consequences of L-DOPA treatment[J].Neurosci Biobehav Rev,2011,35(3):556-564.
[18] 江名芳,于生元.帕金森抑郁的研究进展[J].中风与神经疾病杂志,2015,32(4):376-377.
[19] 黄琼,陈燕忠,吕竹芬.复发左旋多巴制剂的研究进展[J].广东药学院学报,2013,29(5):561-564.
[20] 中华医学会神经病学分会帕金森病及运动障碍学组.中国帕金森治疗指南(第三版)[J].中华神经科杂志,2014,47(6):159-162.
[21] STANSLEY B J,YAMAMOTO B K.Chronic L-dopa decreases serotonin neurons in a subregion of the dorsal raphe nucleus[J].J Pharmacol Exp Ther,2014,351(2):440-447.
[22] LEENTJENS A F,MOONEN ANJA J H,DUJARDIN K,et al.Modeling depression in Parkinson disease:disease-specific and nonspecific risk factors[J].J Neurol,2013,81(12):1 036-1 043.
[23] 王永春,王钊,王伟.美多芭对帕金森患者血小板中五羟色胺含量的影响与抑郁症状[J].脑与神经疾病杂志,2016,24(2):85-87.
[24] 季俊霞,梁桂文,许振华,等.抗抑郁治疗对帕金森病伴抑郁患者工作记忆的影响[J].中华行为医学与脑科学杂志,2017,26(6):513-518.

