酪蛋白激酶CK2抑制剂TBB增加硼替佐米诱导的结肠癌细胞系HT29细胞凋亡
李德强,吕闻耀
(象山县第二人民医院,浙江 宁波315731)
结肠癌是最常见的恶性肿瘤之一,特别在发达国家发病率居高不下[1]。我国结肠癌的发病率也呈上升趋势,严重影响了人们的健康。最近有文献报道蛋白酶体抑制剂硼替佐米抑制结肠癌细胞系HT29细胞增殖[2]。但结肠癌具有高度适应性,在肿瘤内相关的信号机制能激活促存活信号并抑制凋亡信号,最终导致耐药[3]。因此联合应用不同靶点的药物可能会是治疗肿瘤的有效手段。
CK2属于丝氨酸/苏氨酸激酶的一种,广泛参与到多种细胞过程。此外,CK2在多种实体瘤中高表达[4]。大量的研究表明高表达CK2通过多种分子机制和信号级联反应促使癌症存活,抑制CK2能促使癌症对靶向药物的敏感性[5]。因此,本文想探讨CK2抑制剂TBB是否能增强结肠癌细胞系HT29对硼替佐米的敏感性,从而为临床治疗结肠癌提供有效的理论支持。
1 材料与方法
1.1材料与试剂
体外培养的HT29细胞(人结肠癌细胞)购买自中国科学院细胞库,培养细胞所用1640培养液和胎牛血清购买自美国Hyclone 公司。硼替佐米(bortezomib)、四溴苯三唑(TBB)、MTT(四甲基偶氮唑蓝)均购自美国Sigma公司,western blotting所需抗体Caspase-3以及兔二抗均购买自Santa Cruz公司(美国)。转膜所需的PVDF 膜(0.45 μm)购买自美国 Millipore 公司。
1.2肿瘤细胞培养
用含有10%胎牛血清的1640培养液体外培养人结肠癌HT29细胞,为避免细胞污染,培养液中含有100 U/ml的青霉素和链霉素。将细胞培养皿放置在细胞培养箱内,温度调整为37℃,CO2浓度调整为5%。每天观察细胞生长状态,1-2天更换培养液一次,细胞长满培养皿后进行细胞传代,按照1∶3比例进行传代,细胞传代至2-3代处于对数生长期后进行后续分组实验。
1.3细胞增殖率检测
利用MTT法检测药物对细胞增殖率的影响。步骤如下:将处于对数生长期的HT29细胞按照3000个/孔铺于96孔板内,摇匀,过夜,待细胞完全贴壁后,给予HT29细胞不同浓度药物(Bortezomib 0 nm,10 nM,20 nM,50 nM)或联合CK2抑制剂TBB,每组设置6个重复孔,药物作用完成后,每个孔内均加入15 μl MTT(5 mg/mL)工作液,加入后继续放入细胞培养箱内孵育3个小时,结束后利用加样器完全弃除培养液,弃除溶液后每孔加入180 μl的DMSO(二甲基亚砜),完全加入后放置于平板振荡器上混匀振荡,利用酶标仪检测吸光度值。
1.4流式细胞仪检测细胞凋亡率
取对数生长期的细胞,按照药物浓度分组作用后,消化收集细胞后,利用预先冷却的PBS溶液洗涤细胞3次,洗涤完成后弃除PBS溶液,加入检测试剂盒内的结合缓冲液500 μl,利用加样器重悬细胞,将细胞制成单细胞悬液后,每组加入Annexin V-FITC溶液5 μl,混匀后再加入PI溶液5 μl,混匀后室温孵育 20 min(避光),最后用流式细胞仪检测荧光强度。
1.5WesternBlotting检测各组细胞蛋白质表达
为明确各组细胞中凋亡相关蛋白表达差异,利用免疫印迹(Western Blotting)检测HT29细胞中cleaved caspase-3的表达水平。细胞分组药物作用后,消化收集细胞,预冷PBS洗涤细胞两次,完全弃除PBS后加入细胞裂解液RIPA150 μl,同时在裂解液内加入蛋白酶抑制剂和蛋白磷酸酶抑制剂,冰上孵育5分钟后,放入冰箱内旋转混匀20 min,3 000 rpm/min 离心10 min,尽量取上清,利用BCA方法检测蛋白浓度后将蛋白浓度稀释相同,煮沸8 min蛋白变性后放入-20℃冰箱内保存用于后续跑胶。配置10% 浓度分离胶,蛋白完全分离后将胶上的蛋白转移至PVDF膜上,100V,转膜60 min,转膜结束后放入5%脱脂奶粉中封闭2 h,然后加入稀释好的Cleaved caspase-3后4℃孵育过夜,第二天加入兔二抗室温孵育1 h,利用PBST溶液洗膜3次,ECL显色液对PVDF膜进行显色拍照。
1.6统计学方法
实验数据利用统计分析软件SPSS13.0版本进行分析。计量数据采用M±SD 表示,两组数据采用t检验,3组及以上数据采用方差分析,利用统计所得数据绘制图表。
2 结果
2.1蛋白酶体抑制剂硼替佐米对人结肠癌HT29细胞增殖的影响
MTT检测硼替佐米对HT29细胞增殖抑制的效果。MTT结果表明不同剂量的硼替佐米都能抑制HT29细胞的增殖,并且呈现剂量依赖性。在 50 nM时,硼替佐米的抑制效果最明显。见表 1。
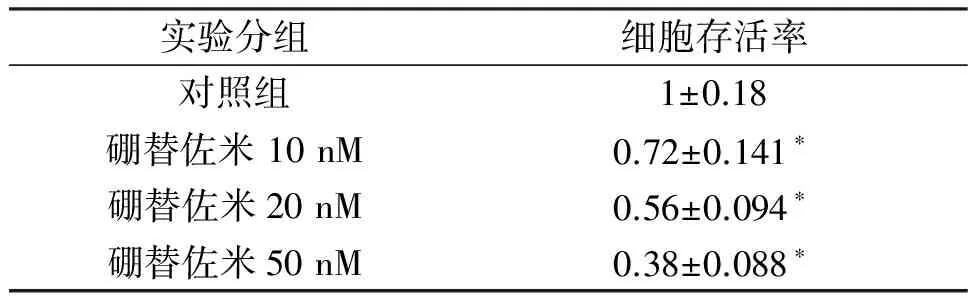
表1 蛋白酶体抑制剂Bortezomib对结肠癌HT29细胞生存率的影响
*与Control相比较有统计学差异,P<0.05
2.2硼替佐米诱导了HT29细胞的凋亡
流式细胞仪检测硼替佐米对HT29细胞凋亡的影响,实验结果表明10 nM、20 nM、50 nM都能诱导细胞的凋亡,在50 nM时,细胞凋亡最明显,见表2。

表2 流式细胞术检测Bortezomib对结肠癌HT29细胞凋亡的影响
*与Control相比较有统计学差异,P<0.05
2.3硼替佐米增加了HT29细胞内CleavedCaspase-3的表达
Cleaved Caspase-3 作为凋亡的关键执行分子,在凋亡信号传导过程中发挥重要的作用。实验结果表明Control组几乎不表达Cleaved Caspase-3,不同硼替佐米剂量组能诱导Cleaved Caspase-3 的表达,结果见图1。

图1 Bortezomib对结肠癌HT29细胞凋亡相关蛋白表达的影响
2.4联合CK2抑制剂TBB对硼替佐米引起的HT29细胞增殖抑制的影响
实验分为四组:Control组,硼替佐米组,TBB组及联合用药组。根据前面实验结果,在后面的实验中,我们选择硼替佐米的剂量为20 nM。实验结果表明与硼替佐米组相比,联合用药组抑制了HT29细胞的增殖。见表3。
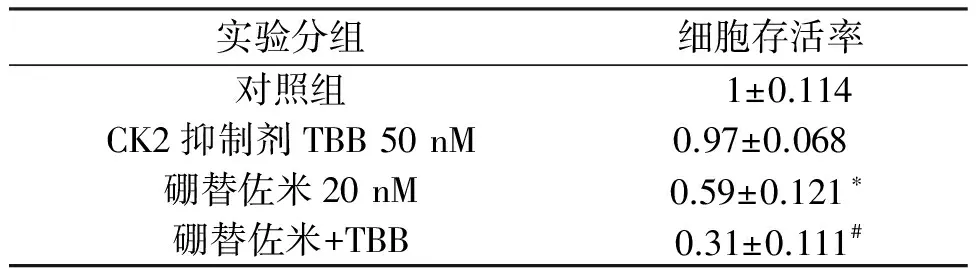
表3 联合应用CK2抑制剂TBB对Bortezomib引起的结肠癌HT29细胞生存率影响
*与Control相比较有统计学差异,P<0.05;#与Bortezomib组相比较有统计学差异,P<0.05
2.5联合TBB对硼替佐米引起的HT29细胞凋亡率升高的影响
流式细胞仪检测联合用药对HT29细胞凋亡的变化情况,结果表明联合用药组能明显增强硼替佐米诱导的HT29细胞的凋亡。见表4。

表4 联合应用CK2抑制剂TBB对Bortezomib引起的结肠癌HT29细胞凋亡的影响
*与Control相比较有统计学差异,P<0.05;#与Bortezomib组相比较有统计学差异,P<0.05
2.6联合TBB对硼替佐米诱导的HT29细胞凋亡相关蛋白表达水平的影响
Western blotting检测不同组细胞内凋亡相关蛋白Cleaved Caspase-3表达。实验结果显示出,与单独使用硼替佐米作用相比较,联合CK2抑制剂TBB可以进一步增加Cleaved Caspase-3的表达水平。见图2。

图2 TBB对硼替佐米诱导的HT29细胞凋亡相关蛋白表达水平的影响
3 讨论
硼替佐米是第一代蛋白酶体抑制剂,能抑制26S蛋白酶体亚基的活性。已有研究表明硼替佐米能明显抑制多发性骨髓瘤的活性[6]。目前,以硼替佐米为基础的联合疗法,结合传统的化疗药物和新型制剂,代表着治疗多发性骨髓瘤和非霍奇金淋巴瘤的治疗标准[7]。本实验研究表明硼替佐米抑制HT29细胞的增殖,诱导其凋亡并且呈现剂量依赖性。然而,最近有文献报道尽管硼替佐米能促使抗凋亡分子Mcl1裂解和失活,但它也能维持抑癌基因p53、促凋亡蛋白Bax的活性,促进Noxa和Puma蛋白表达[8]。硼替佐米也能诱导内质网应激,这是肿瘤细胞存活的机制之一。促存活的未折叠蛋白反应是硼替佐米所诱导的结果[9]。因此,靶向硼替佐米所诱导的促存活分子是我们研究的目标。
蛋白激酶CK2,也称为酪蛋白激酶II,是细胞内普遍存在的丝氨酸/苏氨酸激酶。越来越多的实验表明了CK2是促进肿瘤细胞存活的主要原因之一[4]。CK2通过对Cdc37和Hsp90形成的分子伴侣活性的调控激活了细胞内众多蛋白酶的活性[10]。CK2调控着IκBα蛋白周转、p53的功能、AKT的活性和内质网应激[11]。Sabrina Manni等人证实了CK2维持多发性骨髓瘤的生存,而CK2的抑制剂下调NF-κB和STAT3促存活信号通路,从而增加多发性骨髓瘤对化疗药物的敏感性[12]。因此本文探讨了蛋白酶CK2抑制剂TBB是否能增强硼替佐米对HT29细胞的敏感性。我们的实验结果表明TBB增强了硼替佐米的抑制增殖和促进凋亡效应,两者之间具有协同作用。
综上所述,硼替佐米抑制了HT29细胞的增殖并促进其凋亡。靶向CK2能增强硼替佐米的杀伤作用。这表明了CK2活性在硼替佐米诱导的HT29细胞凋亡过程中发挥着促存活的作用。
[1]Roy S,Majumdar AP.Cancer Stem Cells in Colorectal Cancer:Genetic and Epigenetic Changes [J].J Stem Cell Res Ther,2012,Suppl7(6):pii:10342.
[2]Hong YS,Hong SW Kim SM,et al.Bortezomib induces G2-M arrest in human colon cancer cells through ROS-inducible phosphorylation of ATM-CHK1 [J].Int J Oncol,2012,41(1):76.
[3]Lowe SW,Cepero E,Evan G.Intrinsic tumour suppression [J].Nature,2004,432 (7015),307.
[4]Piazza F,Manni S,Ruzzene M,et al.Protein kinase CK2 in hematologic malignancies:reliance on a pivotal cell survival regulator by oncogenic signaling pathways[J].Leukemia,2012,26(6):1174.
[5]Hanif IM,Shazib MA,Ahmad KA,et al.Casein Kinase II:an attractive target for anti-cancer drug design[J].Int J Biochem Cell Biol,2010,42(10):1602.
[6]Mitsiades CS,Hideshima T,Chauhan D,et al.Emerging treatments for multiple myeloma:beyond immunomodulatory drugs and bortezomib[J].Semin Hematol,2009,46(2):166.
[7]Koprivnikar JL,Cheson BD.Bortezomib:a proteasome inhibitor with an evolving role in select subtypes of B-cell non-Hodgkin’s lymphoma [J].Future Oncol,2012,8(4):359.
[8]Kouroukis TC,Baldassarre FG,Haynes AE,et al.Bortezomib in multiple myeloma:systematic review and clinical considerations [J].Curr Oncol,2014,21(4):573.
[9]Skrott Z,Cvek B.Linking the activity of bortezomib in multiple myeloma and autoimmune diseases [J].Crit Rev Oncol Hematol,2014,92(2):61.
[10]Miyata Y.Protein kinase CK2 in health and disease:CK2:the kinase controlling the Hsp90 chaperone machinery[J].Cell Mol Life Sci,2009(11-12),66:1840.
[11]Hu L,Huang H,Li J,et al.Drosophila casein kinase 2 (CK2) promotes warts protein to suppress yorkie protein activity for growth control[J].J Biol Chem,2014,289(48):33598.
[12]Manni S,Brancalion A,Mandato E,et al.Protein Kinase CK2 Inhibition Down Modulates the NF-kB and STAT3 Survival Pathways,Enhances the Cellular Proteotoxic Stress and Synergistically Boosts the Cytotoxic Effect of Bortezomib on Multiple Myeloma and Mantle Cell Lymphoma Cells [J].PLoS One,2013,8(9):e75280.

