大鼠ALPPS模型的建立
赵金伟,宫路路,郑 戈,由广强,姜学远
(吉林大学第二医院 肝胆胰外科,吉林 长春130041)
目的建立一种可复制的大鼠ALPPS模型。方法使用SD大鼠建立可复制的ALPPS实验模型,ALPPS技术操作包括:肝脏右外侧叶,左外侧叶及左中叶门静脉支结扎(70%PVL),尾状叶切除(10%肝脏部分切除)和左右中叶间肝实质的80%离断,将右中叶作为未来残余肝(FLR),占全肝体积20%;门静脉结扎组,只行相应肝叶的门静脉支结扎和尾状叶的切除,不进行肝实质离断;对照组,仅行肝蒂的解剖分离和尾状叶的切除。于术后24小时,48小时及96小时时相点分析大鼠体重变化和FLR的再生能力;另外一组于ALPPSⅠ期操作后的96小时完成ALPPSⅡ期手术,检验扩大的肝脏切除术的可行性及安全性。结果5只大鼠于术后第二天死亡,主要死因是出血和腹水。术后24小时和48小时时间点:ALPPS组、PVL组和对照组间的体重变化差异不具有显著性,P值均大于0.05。术后96小时时间点:ALPPS组和PVL组的体重变化与对照组相比,差异具有显著性,P值均小于0.05,但ALPPS组和PVL组的体重变化相比,差异不具有显著性,P值大于0.05。术后24小时:ALPPS组、PVL组和对照组间的FLR再生率差异不具有显著性,P值均大于0.05。术后48小时时间点:ALPPS组和PVL组的FLR再生率明显升高,与对照组相比,差异具有显著性,P值均小于0.05,但ALPPS组和PVL组的FLR再生率相比,差异不具有显著性,P值大于0.05。术后96小时时间点:三组FLR再生率相比,差异具有显著性,P值均小于0.05,且ALPPS组FLR再生率明显高于PVL组。另外一组6只大鼠行ALPPSⅠ期手术后4天接受Ⅱ期手术,全部存活直到术后7天人为处死。结论我们成功地建立了大鼠可复制的ALPPS实验模型,达到了预期效果。
大鼠模型;ALPPS;FLR再生率
(ChinJLabDiagn,2018,22:0512)
门静脉结扎联合肝脏劈离的二步肝切除术(ALPPS)是近年来肝脏外科的革新性技术,但其短期内快速平稳地促进未来残余肝(FLR)再生的机制尚未明确,较高的围手术期并发症和死亡率阻碍该技术的普及推广,近远期的抗肿瘤生物学效应也亟待解决。本文旨在对比不同的动物实验模型方法,建立能够模拟临床实践过程的大鼠ALPPS模型并观察不同时相点FLR再生的情况。
1 材料和方法
1.1实验动物和主要器材健康清洁级SD大鼠76只,周龄7-10周,体重200-280克,购于吉林大学实验动物中心。实验用显微手术器械、手术放大镜及动物用手术双极电凝刀购于上海吉米公司。
1.2动物分组大鼠随机分为三组:ALPPS组、PVL组及对照组,每组大鼠20只;另外随机选10只大鼠用于术前计算右中叶与体重的质量比,6只大鼠用于ALPPSⅠ期操作后的Ⅱ期扩大肝切除术。
1.3麻醉方法采用动物用戊巴比妥钠,配制成1.5 mg/100 ml溶液,按照1.5 mg/kg进行腹腔注射麻醉。
1.4分组操作及确定解剖时相点对照组:开腹后分离右外侧叶、左中叶及左外侧叶的门静脉支,切除尾状叶;PVL组:分离右外侧叶、左中叶及左外侧叶的门静脉支并予以结扎,切除尾状叶; ALPPS组:在完成PVL组的操作后,行左右肝中叶肝实质80%的离断。分别于术后24 h、48 h和96 h麻醉后处死大鼠,分析FLR再生情况。
1.5外科手术操作待麻醉生效后,采用络合碘消毒手术区域,取上腹部正中切口剖腹探查,切断肝脏镰状韧带,充分显露肝脏,离断左外侧叶与尾状叶间及尾状叶与胃间的韧带,钳夹尾状叶的肝蒂及静脉,4-0丝线结扎并切除尾状叶。显露右外侧叶肝蒂并予以分离,将肝动脉及胆管与门静脉分离后,悬吊肝动脉及胆管加以保护,将门静脉支靠近主干予以结扎,可见右外侧叶颜色变灰暗,以同样方法处理左外侧叶肝蒂,但左外侧叶和左中叶的门静脉支有共干走行,于共干处结扎可同时阻断两肝叶的门静脉,此时可见左外侧叶和左中叶的颜色变化,并在左、右肝中叶间出现明显的缺血平面,通常位于镰状韧带上或稍偏右侧。至此,完成了选择性的门静脉支结扎和肝脏尾状叶的切除。先用电刀沿着缺血平面作标记,沿着缺血平面离断左右肝中叶肝实质约80%,直达腔静脉旁部,如有活动性出血,采用7-0 Prelene线缝合结扎,或稍偏缺血平面左侧离断可减少出血,在完成ALPPSⅠ期手术后的第四天,进行Ⅱ期手术,即切除所有结扎门静脉的肝叶。
术后24 h、48 h及96 h麻醉后处死大鼠,采用针刺心脏抽血,-20℃保存备用,切取右、左中叶并称重,每侧每叶分成两份,一份使用10%甲醛溶液固定,一份置于-70℃冰箱,保存备用。
1.6大鼠体重变化及FLR再生率的测量
1.6.1大鼠体重的测量 每只大鼠于术前及处死时分别在不同时相点测量其体重,初始体重(IW)和终末体重(FW),体重变化率采用如下公式计算:(FW-IW)/IW×100%。
1.6.2FLR再生率的计算 W1为正常大鼠的右中叶质量的平均值,W2为各时相点右中叶的质量,RR为再生率,采用公式为:RR=(W2-W1)/W1×100%。
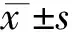
2 结果
2.1手术操作方法及解剖时相点的确定实验中,我们对比采用如下几种手术操作:(1)左右外侧叶、左中叶及尾状叶的门静脉支结扎,保留右中叶门静脉支并作为FLR。(2)右外侧叶、左中叶及尾状叶的门静脉支结扎,切除左外叶,保留右中叶门静脉支并作为FLR。(3)左、右外侧叶、左中叶的门静脉支结扎,切除尾状叶,保留右中叶门静脉支并作为FLR。对比三种方法,实验难易程度相当,但第三种方法更好模拟临床实践中的FLR部分肝切除和保留大约20%的肝实质作为FLR,最终确定采用第三种手术操作方法: 左、右外侧叶、左中叶的门静脉支结扎,切除尾状叶,保留右中叶门静脉支并作为FLR,同时离断左右肝中叶间的80%肝实质,直达腔静脉旁部。
于术后1天,2天,3天,4天及5天解剖大鼠,观察腹腔内变化及肝脏再生变化,确定观察时相点为1天,2天及4天。实验中发现,术后2天,术后并发症发生率较高,且大鼠死亡易多发在此阶段,本实验中,4只ALPPS组大鼠死亡,1只PVL组大鼠死亡。
2.2术前大鼠右中叶占大鼠体重平均百分比的确定同期大鼠10只,测量其体重及右肝叶质量(W1),计算平均百分比为0.899%。
2.3大鼠术后体重变化分析术后1、2天,三组间两两比较,体重差异无显著性,P值均大于0.05;术后第4天,ALPPS组与PVL组间相比,体重差异无显著性,P值大于0.05,但ALPPS组与对照组,PVL组与对照组相对比,体重差异具有显著性,P值均小于0.05。见表1。
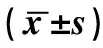
表1 大鼠术后体重变化
2.4大鼠术后不同时相点FLR再生率分析术后24小时,三组间两两比较,差异无显著性,P值均大于0.05;术后48小时,ALPPS组与PVL组间差异无显著性,P值大于0.05,但两组分别与对照组相比,差异具有显著性,P值均小于0.05;术后96小时,三组间两两比较,差异均具有显著性,P值均小于0.05。见表2。
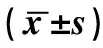
表2 大鼠术后不同时相点FLR再生率
3 讨论
肝脏切除术是目前可能治愈原发性或继发性肝脏肿瘤的唯一手段,但大量有功能的肝脏组织的丧失会导致术后危及生命的肝衰竭[1]。ALPPS手术作为一种创新性技术,与以往的技术相比,可在短期内平稳的促进FLR再生,附加的原位肝脏劈离,较单一的门静脉栓塞(PVO)或门静脉结扎(PVL)增殖加速5-10倍,使得二步手术等待时间大大缩短[2]。但由于该技术具有较高的并发症和死亡率[3],其对肿瘤生物学行为的影响尚不清楚,为解决临床上出现的诸多争议,建立能够模拟临床实践的动物模型是十分必要。2014年,Schlegel等[4]首次报道,其后陆续的几篇相关文献报道也多以啮齿类动物为模型,但方法不尽相同[4-7]。我们在文献报道的基础上,前期实验对各种方法进行实验并加以对比,根据模型制作的难易程度和临床实践的模拟性,我们采用SD大鼠作为实验对象,采用70%的PVL(左外侧叶、右外侧叶和左中叶的门静脉支结扎)和10%肝脏部分切除术(尾状叶切除)和左右肝中叶的肝实质80%的离断,并以右中叶(20%)作为FLR,以此建立大鼠ALPPS模型。实验中,6只大鼠死于术中及术后出血,4只死于术后感染,为此我们改进了实验方法:(1)在分离解剖左外侧叶肝蒂时,部分肝蒂包裹于肝脏实质内,加之血管纤细,分离中造成血管破裂和肝实质出血,我们采用在手术放大镜下细致操作,同时分离动脉和胆管后加以悬吊后再分离门静脉支,可减少术中出血,另一常见出血原因是在肝实质离断时肝静脉破裂出血,沿缺血平面的稍偏左侧离断可减少对肝静脉的损伤。(2)为防止术后感染的发生,在关腹前,向腹腔内滴注庆大霉素2 mg/kg。通过前期的实验经验总结及方法的改进,在批量模型制备中的成功率达92%(55/60)。在建立解剖观察时相点时,根据文献报道[8],大鼠肝脏增殖始于术后第二天,并在术后第四天达到增殖高峰,我们在实验中发现,术后24小时,ALPPS组、PVL组及对照组间的FLR再生率无显著性差异,P值均大于0.05;在术后48小时时间点,ALPPS组、PVL组及对照组间的FLR再生率分别为(125.84±22.33)%、(97.20±19.92)%、(9.51±10.43)%,ALPPS组、PVL组FLR增生率明显高于对照组,但ALPPS组、PVL组FLR增生率无明显差异,而在术后96小时,ALPPS组、PVL组及对照组间的FLR再生率分别为(260.11±30.40)%、(198.65±41.30)%、(24.96±18.33)%,三组间两两比较,差异均具有显著性,P值均小于0.05,且ALPPS组再生率明显高于PVL组及对照组,上述实验说明,ALPPS操作可明显促进肝脏再生,这与文献报道相似[6]。另外,我们对6只行ALPPSⅠ期手术的大鼠在术后4天行二期的扩大肝切除,直至术后1周人为处死,验证了Ⅱ期手术的可行性及安全性。本实验的目的是为建立更好模拟临床实践的动物模型方法的建立和观察不同时相点FLR增殖比率,并没有进行肝脏增生机制的探讨,同时在实验中发现,ALPPS组较高的死亡率发生,为20%(4/20),这与临床报道的类似,如何解决较高的死亡率及并发症仍是亟待解决的难题。
通过上述实验,我们成功地建立大鼠ALPPS实验模型,为后续的进一步研究和探索奠定了良好的动物模型基础。
[1]Rahbari NN,Garden OJ,Padbury R,et al.Posthepatectomy liverfailure:a definition and grading by the International Study Group ofLiver Surgery (ISGLS)[J].Surgery,2011,149:713.
[2]Chua TC,Liauw W,Chu F,et al.Summary outcomes of two-stage resection for advanced colorectal liver metastases[J].J Surg Oncol,2013,107:211.
[3]Schnitzbauer AA,Lang SA,Goessmann H,et al.Right portal vein ligation combined with in situ splitting induces rapid left lateral liver lobe hypertrophy enabling 2-staged extended right hepatic resection insmall-for-size settings[J].Ann Surg,2012,255:405.
[4]Schlegel A,Lesurtel M,Melloul E,et al.ALPPS:from human to mice highlighting accelerated and novel mechanisms of liver regeneration[J].Ann Surg,2014,260:839.
[5]Yao L,Li C,Ge X,et al.Establishment of a rat model of portal vein ligation combined with in situ splitting[J].PLoS One,2014,9:e105511.
[6]Wei W,Zhang T,Zafarnia S,et al.Establishment of a rat model:associating liver partition with portal vein ligation for staged hepatectomy[J].Surgery,2016,159:1299.
[7]García-Perez R,Revilla-Nuin B,Martinez CM,et al.Associated liver partition and portal vein ligation (ALPPS) versus selective portal vein ligation (PVL) for staged hepatectomy in a rat model.Similar regenerative response?[J].PLoS One,2015,10:e0144096.
[8]Fausto N,Campbell JS,Riehle KJ.Liver regeneration[J].J Hepatol,2012,57:692.

