人食道癌细胞Ecap-109耐药细胞的建立及意义
赵 鑫,常 颖,刘玉侠,赵 晖,卢卫平,王启文*
(1.吉林省肿瘤医院,吉林 长春130012;2.吉林省肿瘤防治研究所)
食道癌是我国常见的恶性肿瘤之一,其中90%的食道癌是食道鳞癌。目前的主要治疗手段为手术治疗及化疗。但是,在化疗治疗过程中,很多人会对化疗药物产生耐药,影响治疗效果。为了探求肿瘤细胞的耐药机制及为肿瘤耐药治疗提供实验模型,我们用顺铂反复诱导的方法建立了人食道癌细胞Ecap-109耐药细胞模型,为进一步研究奠定基础。
1 材料和方法
1.1试剂及器材IMDM培养基,Gibco产品;MTT(噻唑蓝),Sigma产品;胎牛血清,天津TB公司;DMSO(二甲基亚砜),Sigma产品;顺铂,购于江苏豪森药业股份有限公司;琼脂糖,DNA标准品,宝泰克公司产品;低温低速离心机,SORVALL RTT USA;全自动酶标仪,Labsystems Dragon;万能视频成像系统(LY-WN-HPCCD),成都励扬精密机电有限公司;电泳仪,上海天能。
1.2食道癌细胞系Ecap-109吉林省肿瘤防治研究所保存。
1.3方法
1.3.1培养人食道癌细胞Ecap-109 将Ecap-109细胞从液氮罐中取出复苏后,离心洗涤,加入含10%FCS的IMDM培养液的培养瓶中,置于CO2培养箱中,37℃、5%CO2、饱和湿度条件下静止培养。
1.3.2诱导Ecap-109细胞耐药 将Ecap-109细胞培养至指数生长期且已铺满瓶底80%以上时,加入终浓度为50 μmol/L顺铂,培养1小时后弃去含顺铂培养基,更换为新鲜配制的含10%FCS的IMDM培养液,置于CO2培养箱中继续培养,每天观察细胞生长状态,拍照。待细胞长满培养瓶时,用0.25%胰酶消化传代。待再长满瓶底时用同样浓度同样方法冲击,再培养并观察细胞生长状态,拍照,再传代。如此反复,体外连续培养、冲击、传代,并反复冻存,复苏,观察细胞株生长稳定性,同时进行抗药性检测。
1.3.3检测细胞抗药性 用MTT法,将培养的人食道癌细胞株Ecap-109和经过顺铂冲击处理4次和6次的Ecap-109细胞培养至对数生长期,用0.25%胰酶消化,生理盐水洗涤,计数后,重悬于10%FCS的IMDM培养液,调整细胞密度为5×104/mL,加入96孔培养板,100 μL/well,置于CO2培养箱中,37℃、5%CO2、饱和湿度条件下静止培养过夜,细胞贴壁后加入顺铂,终浓度分别是100、50、25、12.5、6.25 μmol/L,同时设阴性对照(等体积的生理盐水)和空白对照(无细胞)。各组设6复孔。37℃、5%CO2、饱和湿度条件下静止培养72小时,培养结束前4小时加入MTT(5 mg/mL),20 μL/well,继续培养,培养结束后,小心吸弃培养上清,每孔加入DMSO 150 μl,震荡溶解后,用全自动酶标仪检测各孔吸光度值(A) ,波长为492 nm。
计算方法:抑制率=[1-(实验组均值/阴性对照组均值)]×100%。
50%细胞生长抑制所需的药物浓度(IC50):应用SPSS17.0软件计算IC50值。
耐药指数(RI)=耐药细胞IC50/亲本细胞IC50。
1.3.4检测耐药Ecap-109细胞多药耐药基因(MDR)表达 提取人食道癌细胞Ecap-109细胞及顺铂耐药细胞DNA,用PCR扩增法做MDR1全长序列(约4.7kb)检测。引物设计:上游引物 ATGGATCTTGAAGGGGACCGCAATGGAGG,下游引物 CATCTCATACAGTCAGAGTTCACTGGCGC。扩增方法和条件: 在离心管内加入下列物质:10x bf ,2.5 μl;MgCl2,2.5 μl;DNTP(2 mM),1.0 μl;Primers ,1.0 μl (each);DDW,16.0 μl;Target,1.0 μl;95℃,5 min;Tag ,0.5 μl;94℃,60 s;55℃,80 s;72℃,150 s;共30个循环,72℃延伸10分钟。用0.8%的琼脂糖进行凝胶电泳。
1.4统计学方法应用SPSS17.0统计学软件进行分析,计量数据采用Mean±SD表示,使用t检验进行分析。P<0.05为差异有统计学意义。
2 结果
2.1细胞生长状态及生长特征
细胞在接受50 μmol/L cDDP冲击后,出现大量死亡细胞,活细胞数锐减,直至剩下很少的单个细胞。之后经过长期培养,慢慢出现单细胞克隆(见图1,图2)。待单细胞克隆长到一定程度后进行消化、传代,继续培养,恢复单层排列(图3,图4)。待细胞长满后,再次用同样剂量冲击此细胞,如此反复,共冲击6次。对冲击4次和6次的Ecap-109分别进行耐药检测和多药耐药(MDR)基因检测。

我们分别检测了经50 μmol/L顺铂冲击4次和6次后不同浓度顺铂对亲本细胞和耐药诱导细胞的生长抑制情况。见表1和表2。
2.3耐药Ecap-109细胞多药耐药基因(MDR)表达检测结果MDR1全长大约4.7 kb,从电泳结果可以看出,在此位置上可见一泳带,证明提取人食道癌细胞Ecap-109顺铂耐药细胞有MDR1基因的表达,而亲本Ecap-109细胞没有表达。见图5。
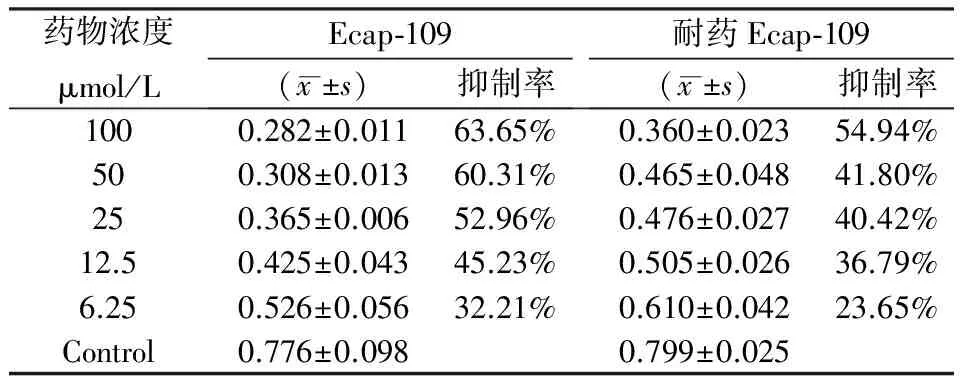
表1 正常Ecap109细胞和经5 0 μmol/L顺铂冲击4次后Ecap109细胞的耐药检测
IC50:Ecap-109 23.097 μmol/L Ecap-109/cDDP 72.177 μmol/L RI: 3.12
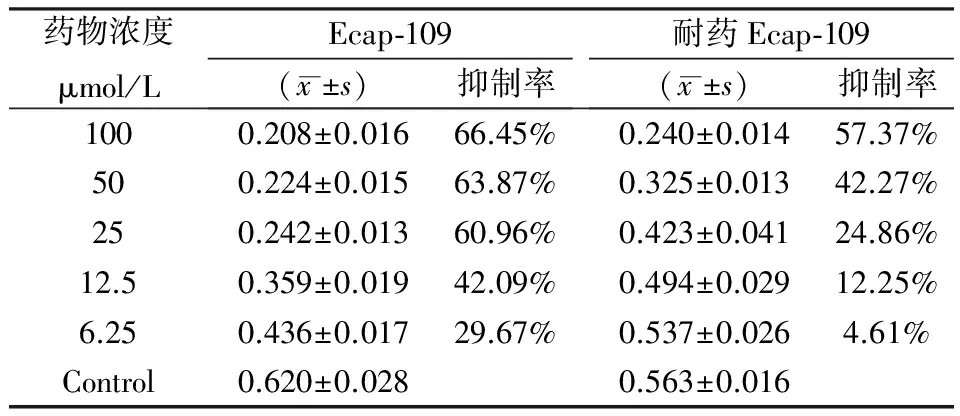
表2 正常Ecap109细胞和经5 0 μmol/L顺铂冲击6次后Ecap109细胞的耐药检测
IC50:Ecap-109 20.561 μmol/L Ecap-109/cDDP 70.869μmol/L RI: 3.45

1.mark 2.亲本Ecap-109细胞 3.诱导4次耐药的Ecap-109细胞 4.诱导6次耐药的Ecap-109细胞
图5耐药Ecap-109细胞MDR表达结果
3 讨论
肿瘤细胞耐药是影响治疗效果的重要原因之一。肿瘤耐药的产生有多种原因,其中有原药耐药和多药耐药。多药耐药大部分发生于单用高剂量给药或联合用药后存活下来的部分细胞[1,2],也就是肿瘤干细胞(CSCs)。CSCs虽然仅占肿瘤细胞的一小部分,但它却有强大的自我更新能力,形成与亲代细胞完全相同的肿瘤细胞,是肿瘤复发的根源[3,4]。
目前,铂类药物是最常用的周期非特异性抗肿瘤药物,它是多种肿瘤治疗药物的首选。其中,顺铂(DDP)是使用广泛的化疗药物之一[5]。但是由于铂类抗肿瘤药物结构上的相似,使其很容易产生原药耐药或交叉耐药,造成化疗治疗的失败[6]。根据这一现象,本实验用顺铂诱导人食道癌细胞Ecap-109产生耐药性,建立人食道癌细胞Ecap-109顺铂耐药模型,为耐药细胞的治疗等研究提供实验基础。
我们经过反复实验,最后选择了用50 μmol/L顺铂对人食道癌细胞Ecap-109进行反复冲击的方法,细胞经冲击后逐渐死亡,后来只剩下少量单个细胞(见图1)。之后经长时间培养后,所剩细胞逐渐形成集落(见图2)。将形成的集落用胰酶消化后重新培养,逐渐恢复到原始状态(见图3,图4)。之后,我们用同样的方法反复冲击,并用冲击第4次和第6次的细胞以及亲本细胞分别做了耐药抑制率和耐药基因检测,结果证明,经4次和6次冲击后,人食道癌细胞Ecap-109对顺铂具有较强的耐受力,IC50分别达到72.18 μmol/L和70.87 μmol/L,而亲本细胞Ecap-109则分别为23.03 μmol/L和20.56 μmol/L(见表1,表2),两者比较有显著差异(P<0.01),诱导4次和6次的Ecap-109细胞均有MDR表达(见图5)。因此,本实验建立了Ecap-109/DDP耐药细胞株。该细胞株通过反复冻存、复苏后,仍对顺铂有较高的耐药性及MDR的表达。至此,我们建立了具有很好稳定性的耐药细胞,为寻找抗耐药肿瘤细胞的药物及其它耐药实验研究奠定了基础。
[1]Jabr-Milanc LS,van Vlerken LE,Yadav S,et al.Multi-functional nanocarriers to overcome tumor drug resistence[J].Cancer Treat Rev,2008,34(7):592.
[2]Meijerman I,Beijnen JH,Schellens JH,et al.Combined action and regulation of phage II enzymes and multidrug resistence proteins in multidrug resistence in cancer[J].Cancer Treat Rev,2008,34(6):505.
[3]Dalerba P,Cho RW,Clarke MF.Cancer stem cells:models and concepts[J].Annu Rev Med,2007,58(1):267.
[4]Dean M,Fojo T,Bates S.Tumour stem cells and drug resistance[J].Nat Rev Cancer,2005,5(4):175.
[5]Triano L R,Deshpande H,Gettinger S N.Management of patients with advanced non-small cell lung cancer:current and emerging options[J].Drugs,2010,70(2):167.
[6]Andrews J,Yeh P,Pao W,et al.Molecular predictors of response to chemotherapy in non-small cell lung cancer[J].Cancer J,2011,17(2):104.

