CT定向硬通道技术在基底节区高血压脑出血患者中的应用效果
杨凯,金永健,王东
(航空总医院,北京100012)
高血压脑出血(HICH)是神经科学领域常见而严重的脑血管疾病,多发于中老年人,具有高发病率、高致残率、高病死率等特点[1]。其中基底节区出血占HICH的60%,其位置深、手术创伤大,且影响患者的预后,因此迫切需要一种创伤小且疗效肯定的治疗方式。近年研究显示,CT定向硬通道技术可能是脑内血肿的最佳治疗方案[2]。本研究通过探讨CT定向硬通道技术、开颅血肿清除术、内科治疗三种不同治疗方式下基底节区HICH患者的术后并发症及预后等情况,进一步明确CT定向硬通道技术在HICH治疗中的应用效果。
1 资料与方法
1.1 临床资料 选取2014年8月~2016年10月在航空总医院神经外科住院治疗的基底节区HICH患者133例,均符合第四届全国脑血管病会议制定的HICH诊断标准。纳入标准:年龄25~85岁;颅脑CT检查,基底节区出血量为25~60 mL;无脑疝,呼吸、循环基本稳定;排除外伤、肿瘤、血管畸形等其他原因引起的出血。将患者分为内科治疗组(保守组)42例、开颅血肿清除术组(手术组)45例、CT定向硬通道技术组(微创组)46例。保守组男22例、女20例,年龄(59.46±5.78)岁,体质量(68.23±2.68)kg,破入脑室15例,出血量(47.35±15.72)mL,左∶右 23∶19,GCS评分(9.01±1.63)分,收缩压(173.57±3.78)mmHg、舒张压(98.85±3.24)mmHg。手术组男24例、女21例,年龄(60.98±5.32)岁,体质量(69.48±2.92)kg,破入脑室16例,平均出血量(49.86±17.78)mL,左∶右23∶22,GCS评分(9.46±1.68)分,收缩压(173.23±3.21)mmHg、舒张压(98.67±3.71)mmHg;微创组男27例、女19例,年龄(60.12±6.56)岁,体质量(69.12±2.88)kg,破入脑室16例,出血量(49.23±15.81)mL,左∶右 24∶22,GCS评分(9.23±1.71)分,收缩压(172.52±2.91)mmHg,舒张压(99.38±3.49)mmHg;各组基线资料有可比性。
1.2 治疗方法 保守组:常规内科治疗,进行常规的脱水降颅压、营养神经、控制血压等治疗,其中20%的甘露醇起始用量125 mL,每8 h一次,用药量、用药时间都根据其病情状况进行调节。手术组:行常规血肿清除术,依据头颅CT定位血肿位置,选用马蹄形切口,常规进行骨瓣开颅,放射状剪开硬膜,选择合适沟回入路或侧裂入路进入血肿腔,清除血肿,电凝出血动脉,硬脑膜减张缝合。根据术中情况决定是否扩大骨窗去骨瓣减压,术后行对症支持治疗。微创组:手术均在监护室床旁进行,依术前患者颅脑CT所提供的血肿三维数据,确定患者头部穿刺点、颅内血肿中心靶点及入颅路径,穿刺点定于非功能区血肿距离皮层最近处。术区消毒,常规吸氧、心电监护,给予局麻+强化麻醉(手术开始前10 min静脉给予右美托咪定0.8 μg/kg,输注时间10~20 min,手术开始时2%利多卡因局部麻醉,芬太尼50 μg静脉注射)后,导入多侧孔金属通道至血肿中心,外接5~10 mL注射器进行非阻力性抽吸清除血肿,抽吸量根据抽吸情况(一般占术前血肿量的30%~60%)确定,术毕固定引流管,并于尾端连接带有三通阀的一次性颅脑外引流器。术中若疑有颅内继发性出血(见新鲜血液),即向管内注入0.5‰去甲肾上腺素或立止血冰盐水冲洗止血。术后及时复查颅脑CT,并根据残余血肿量于次日经三通阀注入尿激酶2~5万U液化血凝块,夹闭2 h后放开引流,每日冲洗1~2次。数日后颅脑CT显示血肿基本消失时可拔管,期间给予内科常规治疗。
1.3 观察指标 观察3组治疗后3个月颅外并发症情况、死亡情况,并进行日常生活活动能力(ADL)分级。ADL分级:ADL 1级为完全恢复日常生活能力;ADL 2级为部分恢复或可独立生活;ADL 3级为需人照顾,拄拐可行;ADL 4级为卧床,但意识清醒;ADL 5级为植物生存状态。并发症:统计呼吸道感染、尿路感染、低钠血症、肾功能不全、脑心综合征的发生率。
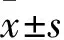
2 结果
2.1 3组颅外并发症发生情况及病死率比较 3组颅外并发症:保守组呼吸道感染8例,尿路感染8例,消化道出血5例,低钠血症11例,肾功能不全14例,脑心综合征9例;手术组呼吸道感染12例,尿路感染9例,消化道出血7例,低钠血症8例,肾功能不全11例,脑心综合征11例;微创组呼吸道感染2例,尿路感染1例,消化道出血3例,低钠血症4例,肾功能不全3例,脑心综合征2例。3组颅外并发症发生率比较:微创组患者呼吸道感染、尿路感染、低钠血症、肾功能不全、脑心综合征发生率低于保守组(P均<0.05),微创组患者呼吸道感染、尿路感染、肾功能不全、脑心综合症发生率低于手术组(P均<0.05)。保守组42例患者中死亡7例(16.7%),手术组45例患者中死亡6例(13.3%),微创组46例患者中死亡1例(2.2%),微创组的病死率低于保守组,差异有统计学意义(χ2=3.96,P<0.05)。
2.2 3组治疗后3个月ADL比较 保守组ADL 1级3例,ADL 2级7例,ADL 3级5例,ADL 4级11例,ADL 5级9例;手术组ADL 1级11例,ADL 2级9例,ADL 3级8例,ADL 4级5例,ADL 5级6例;微创组ADL 1级20例,ADL 2级11例,ADL 3级8例,ADL 4级4例,ADL 5级2例。微创组ADL 1~3级患者多于保守组和手术组(微创组比保守组:χ2=20.3,P<0.05,微创组比手术组:χ2=5.96,P<0.05)。
3 讨论
在HICH中,基底节区出血是其最常见部位,出血后血肿形成的占位效应可引起颅内压骤然增高,血液在凝固、液化、裂解过程中释放的多种神经毒素引起继发性脑损害,进而导致较高的致残率和病死率[3],HICH治疗的核心是尽快去除颅内血肿,缓解颅内高压,同时尽可能减少对患者的损伤,以提高抢救成功率和改善预后。对于脑出血的治疗方式包括内科保守治疗、传统开颅手术以及CT定向硬通道技术,其中,内科保守治疗仅能对症缓解血肿占位引起的颅内高压症状,却不能从根本上解决颅内血肿病灶及其产生的继发性损伤,而传统开颅手术虽能达到清除颅内血肿的目的,但因其对脑组织创伤大,致使较高的并发症发生率和病死率。CT定向硬通道技术通过CT定位,钻颅抽吸血肿,既清除了血肿,缓解了颅内高压,又通过定向穿刺的方法减小了脑组织创伤,是临床上治疗HICH的新技术。我们在对3种治疗方法的对比研究中发现,在基底节区HICH的治疗中,CT定向硬通道技术在颅外并发症发生率和预后方面优于内科保守治疗和传统开颅手术,与既往研究[4~7]相一致,说明CT定向硬通道技术在HICH的治疗中相对于保守治疗和传统开颅手术具有优势。
HICH多发生于老年人,患者对手术等的耐受能力差,因此微创技术可能更适合这类患者。既往研究也发现,CT定向硬通道穿刺技术比传统开颅手术更适合老年人[8],本研究结果与其一致。CT定向硬通道技术能快速降低颅内压,为进一步治疗赢得时间和条件,同时也避免了开颅手术清除血肿造成的继发性损伤。我们总结CT定向硬通道技术具有如下优点:手术操作简单:局麻条件下,床旁进行,避免过多搬动患者;微创:钻孔引流,采用特制金属通道,对脑组织损伤小,再出血发生率低;血肿清除迅速完全:导管引流端有多个侧孔,可多方位多角度彻底引流血肿。一般术中清除30%血肿即可,残余血肿可后期给予尿激酶冲洗和持续引流。动物试验证实,早期清除颅内血肿能显著改善脑内血流,缓解局部缺血、改善预后[9]。Montes等[10]认为,CT定向硬通道技术不仅短时间内减轻了血肿的占位效应,还显著减轻凝血酶的瀑布反应和血红蛋白分解产物的毒性作用,从而降低颅内高压,减轻继发性脑损害,有利于急性期和慢性期脑神经功能的恢复。CT定向硬通道技术虽然具有以上优点,其也存在不足,穿刺针对脑组织可造成慢性切割作用,容易诱发再出血,当患者出现严重意识障碍、出血进行性增加以及脑疝等危及生命时,仍需开颅手术清除血肿并行去骨瓣减压术。
综上所述,CT定向硬通道技术操作简便、定位准确、创伤小,术后颅外并发症少,病死率低,显著改善了患者的生活质量,适合于基层医院或急诊ICU床旁使用。但本研究仍存在局限性,对于适应证的选择以及其治疗基底节HICH的远期疗效,仍有待进一步研究。
参考文献:
[1] Zia E, Bo H, Pessahrasmussen H, et al. Blood pressure in relation to the incidence of cerebral infarction and intracerebral hemorrhage hypertensive hemorrhage: debated nomenclature is still relevant[J]. Stroke, 2007,38(10):2681-2685.
[2] Zhou H, Yu Z, Ling L, et al. Minimally invasive stereotactic puncture and thrombolysis therapy improves long-term outcome after acute intracerebral hemorrhage[J]. J Neurol, 2011,258(4):661-669.
[3] 王忠诚.神经外科学[M].3版.湖北:湖北科学技术出版社,2008:864-871.
[4] 吕传华.CT定位下微创硬通道血肿清除术治疗高血压脑出血疗效评价与分析[J].医学信息,2015,28(33):359.
[5] 伏光辉,王建伟,王文学,等.硬通道穿刺引流术治疗老年基底节区脑出血的近期效果[J].中国当代医药,2016,23(24):37-39.
[6] 陈冬云,李宝东,王存祖.硬通道微创穿刺引流治疗中老年高血压脑出血的探讨[J].现代医药卫生,2016,32(12):1830-1832.
[7] Ramanan M, Shankar A. Minimally invasive surgery for primary supratentorial intracerebral haemorrhage[J]. J Clin Neurosci, 2013,20(12):1650-1658.
[8] 孔刚,封硕,陈进.硬通道穿刺和侧裂入路手术治疗基底核区高血压脑出血的临床研究[J].中国微侵袭神经外科杂志,2014,19(12):556-557.
[9] Becker KJ, Baxter AB, Bybee HM, et al. Extravasation of radiographic contrast is an independent predictor of death in primary intracerebral hemorrhage[J]. Stroke, 1999,30(10):2025-2032.
[10] Montes JM, Wong JH, Fayad PB, et al. Stereotactic computed tomographic-guided aspiration and thrombolysis of intracerebral hematoma: protocol and preliminary experience[J]. Stroke, 2000,31(4):834-840.

