离子色谱法测定葡维氨糖胶囊中盐酸氨基葡萄糖和维生素C的含量
丰 航,陈德妙,李 荣,单 敏
(1.陕西省人民医院药学部,西安 710068;2.西安市食品药品检验所,西安 710054)
盐酸氨基葡萄糖(分子式 C6H13NO5·HCl)是甲壳素降解后生成的一种还原糖,又称D-葡萄糖胺盐酸盐(D-glucosamine hydrochloride,GAH),是存在于机体内尤其是关节软骨中的氨基单糖,可刺激软骨细胞产生正常多聚体结构的蛋白多糖,对骨性关节炎具有很好的疗效[1-2],现广泛应用于葡维氨糖胶囊中;维生素C是人体必需的营养元素,具有抗氧化、强身健脑、促进骨胶原生物合成等功效,葡维氨糖胶囊中将二者结合用作增强关节免疫能力、促进软骨创伤的愈合。目前,常用的盐酸氨基葡萄糖含量检测方法主要有HPLC法[3-9]、紫外-可见分光光度法[10-11]和液质联用法[12];而维生素C常用的检测方法为比色法、荧光法及高效液相色谱-紫外检测器法[13-20]。尚未见同时检测该2种成分的文献报道。本文将利用盐酸氨基葡萄糖与维生素C的电导性质,采用离子色谱对其进行分离,借助电导检测器同时进行二者的含量测定。该法操作简单、灵敏度高、专属性强、准确度和重复性良好,可为该产品的质量控制提供参考。
1 仪器与试药
1.1仪器 ICS-3000离子色谱仪(美国戴安公司),配有电导检测器。
1.2试药 盐酸氨基葡萄糖对照品(中国食品药品检定研究院,批号140649-201304,质量分数100%),抗坏血酸对照品(Dr.Ehrenstorfer GmbH公司,批号111706,质量分数98.9% );水为超纯水;葡维氨糖胶囊(威海康宝生物科技有限公司,批号541016406)。
2 方法与结果
2.1溶液的制备
2.1.1混合对照品溶液 分别精密称取100 mg盐酸氨基葡萄糖对照品和100 mg抗坏血酸(即维生素C)对照品,分别置于100 mL量瓶中,加水溶解并定容至刻度,作为对照品储备液。精密吸取该溶液各25 mL混合,用水稀释成质量浓度分别为50,100,200,300,400和500 μg·mL-1的溶液,作为混合对照品溶液。
2.1.2供试品溶液 取适量胶囊内容物,用研钵研细,混匀,称取25 mg,置于100 mL量瓶中,加入80 mL水超声溶解,用水定容至刻度,经0.45 μm滤膜过滤,作为供试品溶液。
2.1.3阴性样品溶液 取适量不含盐酸氨基葡萄糖和维生素C的阴性样品,用研钵研细,混匀,称取25 mg,置于100 mL量瓶中,加入80 mL水超声溶解,用水定容至刻度,经0.45 μm滤膜过滤,作为阴性样品溶液。
2.1.4溶剂空白溶液 取100 mL水,经0.45 μm滤膜过滤,作为溶剂空白溶液。
2.2色谱条件 色谱柱:Ion Pac AS-19(250 mm×4 mm);保护柱:Ion Pac AG-19(50 mm×4 mm);淋洗液:10 mmol·L-1氢氧化钾溶液(在线淋洗液发生器生成);抑制电流:25 mA;流速:1 mL·min-1;柱温:30 ℃;检测器:电导检测器;进样量:25 μL。色谱图见图1。

图1离子色谱图
A.对照品溶液;b.供试品溶液;c.阴性样品溶液;d.溶剂空白溶液;1.维生素C;2.盐酸氨基葡萄糖。
Fig.1 Ion chromatograms
A.reference substances solution;b.sample solution;c.negative solution;d.solvent blank solution;1.vitamin C;2.glucosamine hydrochloride.
2.3测定法 分别取2.1项下制备的对照品溶液和供试品溶液适量,按照2.2项下色谱条件进样分析,根据保留时间定性,标准曲线法定量。
2.4线性关系考察 取2.1.1项下不同质量浓度的对照品溶液,分别进样25 μL,以对照品溶液质量浓度为横坐标(x)、色谱峰面积为纵坐标(y),绘制标准曲线,得盐酸氨基葡萄糖回归方程为y=0.039 4x-0.286 2,r=0.999 9;维生素C的回归方程为y=0.037 4x-0.242 7,r=0.999 9。结果表明,盐酸氨基葡萄糖与维生素C质量浓度在50~500 μg·mL-1范围内线性关系良好。
2.5精密度考察 取质量浓度为300 μg·mL-1的混合对照品溶液连续进样5次,每次25 μL,记录峰面积及保留时间。盐酸氨基葡萄糖与维生素C 峰面积的RSD值分别为0.33%和0.35%,保留时间RSD值分别为0.12%和0.17%,结果表明,二者精密度均良好。
2.6重复性考察 取同一批号供试品,按照2.1.2项下方法制备供试品溶液,平行制备6份,按照2.2项下方法进样测定,6份样品盐酸氨基葡萄糖与维生素C含量的RSD 值分别为1.12%和1.25%,结果表明,重复性均良好。
2.7稳定性考察 取已经制备好的供试品溶液,分别于0,1,2,4,8,12,18和24 h进样,记录盐酸氨基葡萄糖与维生素C的峰面积,计算得RSD值分别为1.85%和2.57%,结果表明,供试品溶液在24 h内稳定性良好。
2.8回收率考察 精密称取已测含量的葡维氨糖胶囊9份,各25 mg(分为3个水平,每个水平3平行),分别置于100 mL量瓶中。3个水平分别精密加入盐酸氨基葡萄糖对照品储备液(质量浓度为1.008 mg·mL-1)各13.5,17.0和20 mL以及维生素C对照品储备液(质量浓度为1.004 mg·mL-1)各1.0,1.3和1.6 mL,加入80 mL水超声溶解,用水定容至刻度,经0.45 μm滤膜过滤,作为回收率实验待测溶液。经计算,盐酸氨基葡萄糖平均回收率为98.91%,RSD值为0.62%;维生素C平均回收率为98.46%,RSD值为0.88%。见表1~2。
表1盐酸氨基葡萄糖回收率实验结果
Tab.1 The results of glucosamine hydrochloride recovery test
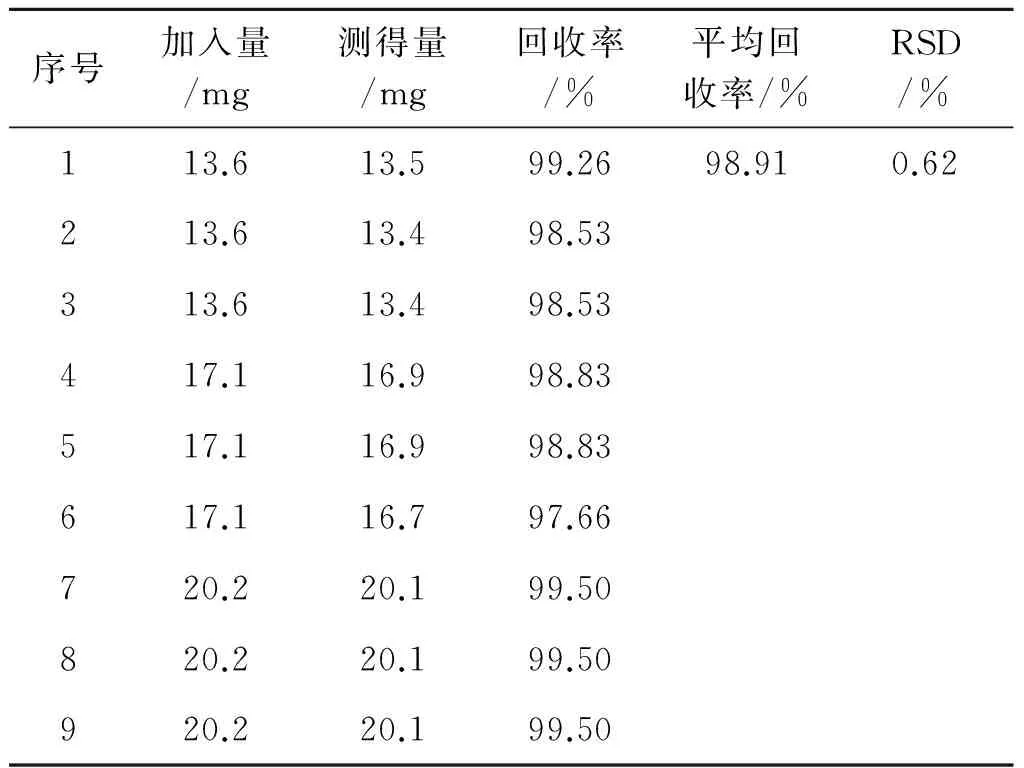
序号加入量/mg测得量/mg回收率/%平均回收率/%RSD/%113.613.599.2698.910.62213.613.498.53313.613.498.53417.116.998.83517.116.998.83617.116.797.66720.220.199.50820.220.199.50920.220.199.50
表2维生素C回收率实验结果
Tab.2 The results of vitamin C recovery test
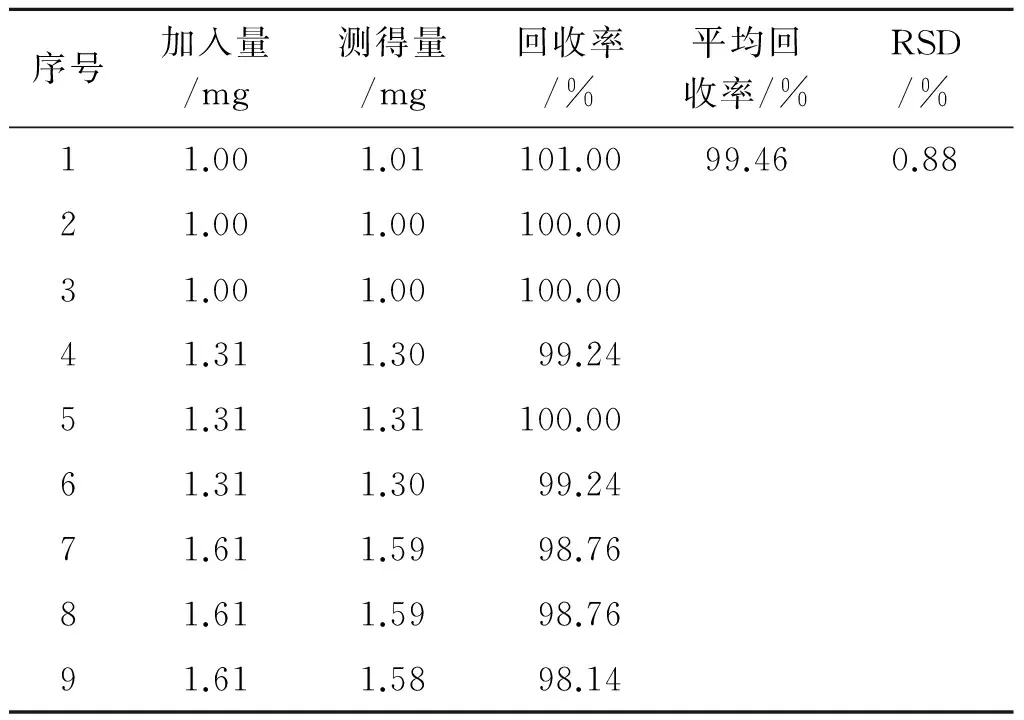
序号加入量/mg测得量/mg回收率/%平均回收率/%RSD/%11.001.01101.0099.460.8821.001.00100.0031.001.00100.0041.311.3099.2451.311.31100.0061.311.3099.2471.611.5998.7681.611.5998.7691.611.5898.14
2.9检测限和定量限 取2.1.1项下制备的混合对照品储备液,用水稀释制成不同质量浓度的溶液,按照2.2项下色谱条件进行测定,按照S/N≥3计算盐酸氨基葡萄糖的最低检测质量浓度均为0.1 μg·mL-1;维生素C的最低检测质量浓度均为0.2 μg·mL-1;按照S/N≥10计算盐酸氨基葡萄糖的最低检测质量浓度为0.3 μg·mL-1;维生素C的最低检测质量浓度为0.6 μg·mL-1。
2.10供试品测定 按照2.1.2项下方法制备供试品溶液,分别测定葡维氨糖胶囊中盐酸氨基葡萄糖与维生素C的含量。结果显示,葡维氨糖胶囊中盐酸氨基葡萄糖的含量为238.0 mg·粒-1;维生素C的含量为18.23 mg·粒-1。
3 讨论
3.1检测方法的选择 盐酸氨基葡萄糖的常用含量检测方法主要有HPLC法、紫外-可见分光光度法和液质联用法。由于该化合物在紫外区缺乏特征吸收,故在利用HPLC法时,只能采用紫外检测器(紫外末端吸收法或柱前衍生法)或蒸发管检测器进行测定。采用紫外末端吸收法灵敏度较低;蒸发光检测器法杂质干扰大;而柱前衍生法操作繁琐。利用紫外-可见分光光度法对复杂样品进行测定时,选择性很难达到要求。液质联用技术在仪器方面成本投入过大,不利于推广。维生素C目前常用的检测方法为比色法、荧光法及高效液相色谱-紫外检测器法,比色法和荧光法对于复杂化合物的测定选择性较差;采用高效液相色谱-紫外检测器法则很难与测定盐酸氨基葡萄糖相兼容。但盐酸氨基葡萄糖与维生素C均为水溶性化合物,具有导电性。利用这2种化合物的这一性质,本文选用离子色谱法-电导检测器对其进行分离、测定。
3.2离子色谱柱的选择 盐酸氨基葡萄糖与维生素C在其水溶液中均呈阴离子,带有负电荷。故采用Ion Pac AS-19阴离子交换柱(250 mm×4 mm)即可实现对该阴离子的分离。由于样品处理方法较为简单,仅为加水超声溶解,故在分离柱前增加同型号的预柱Ion Pac AG-19(50 mm×4 mm)进行柱保护。
3.3国标液相方法与本法比较 现行的盐酸氨基葡萄糖测定方法为GB/T 20365-2006,该法中针对盐酸氨基葡萄糖采用HPLC法,选用C18柱为分离柱,192 nm为检测波长。由于该化合物的极性较大,在C18柱上很难保留,在2.5 min内即出峰。过早的出峰,除了与溶剂峰保留时间接近外,和样品中杂质峰难以分开,干扰过大。此外,195 nm为紫外检测器的末端吸收,在该波长下检测对流动相试剂要求很高,检测时流动相对结果影响很大。本法利用该化合物的电导性,选用阴离子色谱柱作为分离柱,用电导检测器进行检测。该法灵敏度高,盐酸氨基葡萄糖最低检测质量浓度为0.1 mg·mL-1,维生素C质量浓度为0.2 μg·mL-1,准确度和重复性均良好,可为国家制定葡维氨糖胶囊中盐酸氨基葡萄糖的检测标准提供技术支持和参考依据。
[1] Johanne M P,Lukas M W,Jean-Pierre P.Future therapeutics for osteoarthritis[J].Bone,2012,51:297-311.
[2] 陈怡.硫酸氨基葡萄糖临床应用的研究进展[J].中国药业,2012,21(9):96-封2.
[3] 李璟,李志伟,王立峰.HPLC法测定盐酸氨基葡萄糖口腔崩解片中盐酸氨基葡萄糖的含量[J].河北医科大学学报,2010,31(1):69-71.
[4] 廖栩,王淑君,佟岩,等.柱前衍生化法测定盐酸氨基葡萄糖软膏的含量[J].沈阳药科大学学报,2011,28(5):380-383.
[5] 吴虹,顾宏霞,王效山.HPLC-ELSD测定盐酸氨基葡萄糖含量[J].安徽中医学院学报,2008,27(2):41-43.
[6] GB/T 20365-2006,硫酸软骨素和盐酸氨基葡萄糖含量的测定液相色谱法[S].
[7] 罗立,但汉雄.氨基柱HPLC法测定盐酸氨基葡萄糖及其制剂的含量[J].中国药师,2016,19(2):387-389.
[8] 狄平平,劳苑子,赵立平,等.HPLC法测定复方氨基葡萄糖片中盐酸氨基葡萄糖和硫酸软骨素含量[J].中国药事,2010,24(3):283-286.
[9] 张德柱,宋愿智,沈登林.盐酸氨基葡萄糖胶囊有关物质测定方法研究[J].西北药学杂志,2014,29(3):252-255.
[10]WS1-(X-090)-2005Z,盐酸氨基葡萄糖胶囊[S].
[11]王维,尤瑜敏,周培根.D-氨基葡萄糖测定方法的比较[J].食品研究与开发,2003,24(2):84-87.
[12]张华珺,张喆,张蓉.氨基葡萄糖液相色谱-质谱联用含量测定方法研究[J].中国卫生检验杂志,2013,23(5):1148-1150.
[13]周涛,江维克,艾强,等.贵州刺梨中总维生素C及还原型维生素C含量检测方法的建立与比较[J].中国实验方剂学杂志,2010,16(9):37-40.
[14]王玉洁,薛健,石上梅.中药中维生素C含量测定方法对比研究[J].中国现代中药,2017,19(2):214-216.
[15]刘真真,齐沛沛,王新全,等.超高效液相色谱-四极杆-飞行时间质谱测定果蔬中维生素C[J].色谱,2016,34(11):1048-1054.
[16]李元玲,贺龙强.紫外分光光度法测定新鲜蔬菜中维生素C的含量[J].焦作大学学报,2011,(3):93-94.
[17]于晓萍.分光光度法快速测定蔬菜水果中维生素C的含量[J].工程技术与应用,2009,6(2):16-18.
[18]沈黎,刘玉春.高效液相色谱法同时测定复方亚油酸乙酯胶丸中维生素C和烟酸的含量[J].中国药业,2012,21(14):50-51.
[19]陈玉锋,庄志萍.紫外分光光度法测定橙汁中维生素C的含量[J].安徽农业科学,2011,39(1):236-237,240.
[20]马宏飞,卢生有,韩秋菊,等.紫外分光光度法测定五种果蔬中维生素C的含量[J].化学与生物工程,2012,29(8):92-94.

